Reporte de caso
← vista completaPublicado el 12 de julio de 2016 | http://doi.org/10.5867/medwave.2016.06.6494
Hemorragia perioperatoria grave asociada a punción del ventrículo izquierdo post pericardiocentesis en un paciente con carcinoma de células renales: reporte de caso
Severe perioperative bleeding in renal cell carcinoma after elective pericardiocentesis associated left ventricular puncture: case report
Resumen
En los Estados Unidos se estimó que, durante el 2015, unos 61 560 pacientes serían diagnosticados con cáncer renal y que 14 080 morirían por esta enfermedad. Presentamos el caso de un paciente con carcinoma de células renales y trombo tumoral de vena cava inferior que sufrió una hemorragia perioperatoria grave y coagulopatía después de una esternotomía de emergencia. También abordamos aspectos relevantes del cuidado anestésico perioperatorio incluyendo consideraciones y manejo de coagulopatía, falla renal y hepática en un paciente oncológico. El caso es un hombre de 49 años que fue llevado a embolización tumoral guiada por radiología, nefrectomía radical izquierda y trombectomía de vena cava inferior. En el período postoperatorio desarrolló sepsis, falla orgánica múltiple y efusión pericárdica que requirió pericardiocentesis. Durante la pericardiocentesis sufrió perforación iatrogénica de ventrículo izquierdo que necesitó esternotomía de emergencia y reparación del ventrículo izquierdo. Los pacientes con cáncer son a menudo un reto para el equipo de cirugía y anestesia, y el cuidado de emergencia requiere un abordaje integral y organizado. El uso de factor recombinante VIIa NovoSeven puede ayudar en el manejo de la hemorragia severa perioperatoria después de cirugía cardiotorácica en pacientes oncológicos, pero se deben hacer estudios posteriores para confirmarlo.
Introducción
En los Estados Unidos, los tumores del riñón y la pelvis renal son la séptima y décima causa más común de nuevos casos de cáncer en hombres y mujeres, respectivamente. También son la décima causa de muerte por cáncer en los hombres, quienes son casi el doble de propensos a desarrollar este cáncer en comparación con las mujeres. En el 2015, se estimó que aproximadamente 61 560 pacientes serían diagnosticados con cáncer renal y que 14 080 morirían por esta enfermedad. La mayoría de estos casos sería de carcinoma de células renales. Al momento del diagnóstico, alrededor del 64% de los casos se presenta en estadio localizado; para estos pacientes, las tasas de sobrevida a 5 y 10 años son 72% y 62% respectivamente [1],[2].
Presentamos el caso de un paciente con carcinoma de células renales invasivo, quien sufrió una serie de eventos adversos que lo llevaron a una esternotomía de emergencia, hemorragia grave intra- y postoperatoria, y coagulopatía. Discutimos cómo el equipo de anestesia desarrolló e implementó una estrategia exitosa para el manejo de la hemorragia postoperatoria en este caso de emergencia.
Se obtuvo consentimiento informado para la publicación de este caso.
Presentación del caso
Un hombre de 49 años se presentó a su médico de atención primaria con edema bilateral en miembros inferiores, aumento del perímetro abdominal, dolor abdominal, sensación de mareo, fatiga y disnea. Estos síntomas se habían desarrollado en un curso de cuatro meses después de haber sido tratado con antibióticos y corticosteroides orales por una infección respiratoria alta. El examen por sistemas fue negativo. Una valoración completa de la función cardíaca fue negativa. El paciente tenía historia de depresión, anemia, disfunción eréctil y apnea obstructiva del sueño. No tenía antecedentes de consumo de tabaco, alcohol u otras drogas. No tenía historia familiar de enfermedad hematológica, su tío y abuelo maternos habían sufrido cáncer de pulmón. Fue remitido a un cardiólogo local. Una tomografía del abdomen reveló una masa renal izquierda con un trombo en la vena cava inferior. El paciente fue referido al MD Anderson Cancer Center (centro oncológico de alta complejidad) para su evaluación y tratamiento. Se realizaron estudios de imagen para estadificar el tumor. Una resonancia magnética del abdomen mostró evidencia de una masa renal izquierda (6,4 × 4,5 × 5,6 cm) cuya apariencia era compatible con carcinoma de células renales; la masa se extendía dentro de la vena cava inferior intrahepática y suprahepática, e involucraba la vena renal izquierda. La resonancia magnética también reveló un trombo de la vena renal derecha. Una tomografía de tórax mostró un defecto de llenado de la arteria pulmonar en la rama basal posterior del lóbulo inferior derecho; se sospechaba que este defecto podría ser un émbolo tumoral o un émbolo simple. También había tres nódulos pulmonares, de 3 a 4 mm, que eran indeterminados y podían haber representado granuloma o metástasis. Los resultados de la ultrasonografía doppler bilateral de miembros inferiores, resonancia magnética cerebral y gammagrafía ósea fueron negativos. El paciente fue clasificado como estadio 3 y el plan de tratamiento fue quirúrgico.
La evaluación posterior reveló elevación en las enzimas hepáticas y empeoramiento del estado funcional del paciente, apuntando al diagnóstico de síndrome de Budd-Chiari. Así, el plan inicial de operar fue pospuesto hasta que la condición del paciente mejorara y pudiera tolerar la cirugía. El equipo de radiología intervencionista realizó una embolización de la arteria renal izquierda y obtuvo una biopsia renal izquierda, la cual no fue concluyente en el análisis histopatológico. En los días siguientes, el paciente se deterioró lentamente y desarrolló falla renal, así como encefalopatía causada por uremia y falla hepática.
Un mes más tarde, con la mejoría de su condición, el paciente fue dado de alta del hospital y programado para seguimiento. Luego de un mes de seguimiento, el paciente no tenía síntomas, ni pruebas imagenológicas o de laboratorio que sugirieran síndrome de Budd-Chiari. Se programó entonces para nefrectomía radical izquierda, y posible adrenalectomía izquierda y nefrectomía radical derecha; también trombectomía y reconstrucción de la vena cava inferior. De los procedimientos mencionados se realizaron la nefrectomía radical izquierda, adrenalectomía derecha y la trombectomía y reconstrucción de la vena cava inferior. Durante la cirugía, sin embargo, el trombo tumoral completo no pudo ser removido de la vena hepática, vena renal derecha y vena adrenal derecha, por lo que el equipo quirúrgico se abstuvo de realizar la nefrectomía radical derecha. También se encontró que el trombo tumoral se extendía dentro de la médula espinal y el foramen espinal y no podía ser completamente removido.
La evaluación patológica del espécimen quirúrgico reveló un tumor tipo células claras, grado nuclear Fuhrman 3, que invadía la pared de la vena renal a nivel de su margen de resección, carcinoma metastásico en uno de cuatro nódulos linfáticos; y trombo tumoral con invasión de la pared del vaso a nivel del margen de la vena cava inferior, el margen de la vena renal derecha y el margen de la vena lumbar posterior.
La condición del paciente era estable, y fue dado de alta 10 días después de la cirugía. Una semana después del alta, el paciente se presentó a la sala de emergencias con dolor torácico y abdominal. El paciente fue hospitalizado y se inició tratamiento para sepsis y falla renal. Se evaluó para embolismo pulmonar, lo cual no fue confirmado. En los días siguientes, un ecocardiograma reveló que el paciente tenía una efusión pericárdica grande que no causaba inestabilidad hemodinámica o síntomas. Adicionalmente tenía hipo severo, lo que elevaba los riesgos asociados con la pericardiocentesis. Luego, se encontró que el paciente tenía fibrilación auricular y fue tratado con amiodarona intravenosa. Estudios posteriores, incluyendo pruebas de función hepática revelaron falla de este órgano. Una tomografía abdominal mostró colección intrahepática de fluido. Un segundo ecocardiograma todavía mostraba evidencia de efusión pericárdica, pero a la luz de la reciente cirugía complicada del paciente se descartó realizar una ventana pericárdica. Por tanto, el equipo tratante decidió insertar una sonda de drenaje pericárdico por medio de pericardiocentesis guiada por fluoroscopía. Desafortunadamente, el paciente tuvo un ataque de tos vigoroso e inesperado durante el procedimiento. Entonces, se descubrió que el ventrículo izquierdo había sido perforado durante el avance del catéter. El paciente fue transferido a la sala de cirugía para esternotomía de emergencia con el catéter aún en el tórax (Figura 1).
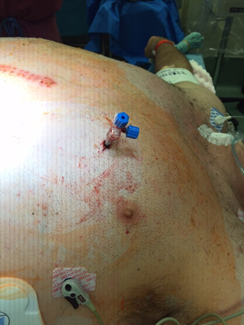
Figura 1. Paciente transferido a sala de cirugía con el catéter aun en el tórax.
Las pruebas de laboratorio preoperatorias mostraban aspartato aminotransferasa (AST) de 77 IU/l (referencia, 15-46 IU/l), alanina transaminasa (ALT) de 366 IU/l (referencia, 7-56 IU/l), bilirrubina total de 2,1 mg/dl (referencia, 0,2-1,3 mg/dl), albumina 3 g/dl (referencia, 3,5-4,7 g/dl), y creatinina 7,63 mg/dl.
Al inicio de la cirugía mostraban tiempo de tromboplastina parcial activada (aPTT) de 195,1 seg, (referencia, 24,7-35,9), tiempo de protrombina (PT) de 20 segundos (referencia, 12,7-15,0), International Normalized Ratio (INR) de 1,73 (referencia, 0,9-1,20), hemoglobina (Hb) de 9,3 g/dl, y conteo plaquetario de 305 000/μl.
Los signos vitales del paciente eran los siguientes: presión arterial: 130/80 mmHg; frecuencia cardíaca: 110 latidos por minuto; frecuencia respiratoria: 20 respiraciones por minuto y temperatura 37˚C.
El equipo de anestesia evaluó al paciente como clase 4E según la clasificación física de la Sociedad Americana de Anestesiólogos (ASA) y como Mallampati clase 2. El plan de anestesia incluyó anestesia general endotraqueal realizando inducción con secuencia de intubación rápida y presión cricoidea, luego de la preparación quirúrgica de la piel con el paciente despierto. El paciente fue monitorizado de acuerdo con los estándares de la ASA. Debido a que el paciente estaba en riesgo de paro cardiorrespiratorio y de arritmia inestable, pusimos parches para marcapasos transcutáneo (Figura 2). Se realizó la inducción de secuencia rápida de anestesia general con 250 μg titulados de fentanilo, 1 mg de midazolam, 20 mg de etomidato, y 100 mg de succinilcolina. La tráquea del paciente fue delicadamente intubada usando laringoscopia directa con hoja Miller N 2 y visión grado 1 de las cuerdas vocales. Se observó CO2 al final de la espiración (ETCO2) positivo e igual murmullo vesicular bilateral.
El mantenimiento anestésico se realizó con desflurano, cisatracurio, y sufentanilo. También se le administró al paciente una dosis de carga de 1 g de ácido aminocaproico como antifibrinolítico, seguido de 1 g/h en infusión.
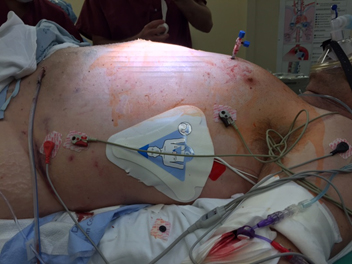
Figura 2. Paciente con el catéter en tórax y parche para marcapaso transcutáneo en posición.
Durante el procedimiento, los cirujanos notaron efusión pericárdica que no coagulaba. El catéter ya estaba afuera del ventrículo y se identificó el sitio de perforación, que estaba exudando sangre. El sangrado fue controlado con sutura de Prolene polipropileno pledget 5-0. También se vio sangre que exudaba de otras superficies y el pericardio parecía estar cubierto de un material rugoso y blancuzco (Figura 3).
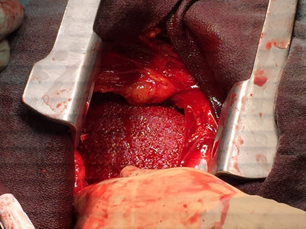
Figura 3. Ventrículo izquierdo después de reparación con sutura Prolene 5-0.
Después del cierre de la incisión, el paciente continuó perdiendo sangre, un estimado de tres litros de sangre fue recolectado de los tubos de toracostomía en un periodo de 20 minutos. El equipo de anestesia manejó el sangrado y la coagulopatía con derivados sanguíneos estándar y líquidos endovenosos. Se utilizaron nueve unidades de glóbulos rojos empacados, 12 unidades de plasma fresco congelado, dos unidades de seis paquetes de plaquetas y 2 × 10 unidades de crioprecipitado. Los líquidos administrados incluyeron 500 ml de albúmina 5%. Para la terapia de fluidos dirigida por metas se usó monitoreo hemodinámico mínimamente invasivo con FloTrac/Vigileo (Edwards Lifesciences, Irvine, CA).
Debido a que la hemorragia no se había detenido 20 minutos después del cierre de la incisión, los cirujanos inicialmente consideraron la reapertura de la incisión con exploración posterior. Este procedimiento no llegó a realizarse por temor a que no fuera tolerado por el paciente.
La sangre continuaba fluyendo por los tubos de toracostomía, indicando falta de respuesta parcial al uso de los derivados sanguíneos, por lo que el equipo de anestesia decidió administrar 10 mg de factor recombinante VIIa NovoSeven (rFVIIa) (Novo Nordisk A/S, Bagsværd, Denmark). Diez minutos después de la administración de este compuesto, la pérdida sanguínea se redujo significativamente, a solo un volumen de 200 ml adicionales recolectados en los siguientes 30 minutos. La pérdida sanguínea total estimada fue 5,5 litros. Como soporte vasopresor también fue necesario el uso de vasopresina durante y después de la cirugía. El paciente fue estabilizado en la sala de cirugía y luego transferido a la unidad de cuidados intensivos. Se realizó una ecocardiografía transesofágica en la sala de cirugía después del procedimiento que reveló líquido mínimo alrededor de la aurícula derecha, que no provocaba colapso de ésta ni de otras estructuras vitales.
Las pruebas de laboratorio al finalizar la cirugía mostraron los siguientes resultados: tiempo de tromboplastina parcial activada de 30 segundos, tiempo de protrombina de 10 segundos, INR de 0,68, hemoglobina de 9,5 g/dl, conteo plaquetario de 184 000/μl y fibrinógeno de 433 mg/dl (referencia, 202-450).
Al final del procedimiento se tomaron muestras de tejido pericárdico que se enviaron a estudio histopatológico subsecuentemente. El reporte final indicaba pericarditis fibrinosa aguda.
Se dejó al paciente con dos tubos de toracostomía, un drenaje Blake de la cirugía previa y una sonda Foley.
En el periodo postoperatorio, el paciente fue manejado en la unidad de cuidado intensivo por nueve días, donde mejoró sostenidamente, se descontinuó su soporte vasopresor, se suspendió la ventilación mecánica y se sometió a diálisis intermitente. El paciente no mostró signos de coagulopatía. Sin experimentar ninguna otra complicación, 24 días después de la cirugía, el paciente fue trasladado a un centro de cuidados agudos de largo plazo donde continuó su manejo.
Discusión
El tratamiento de pacientes con cáncer es a menudo un reto para los equipos quirúrgicos y de anestesia. Tanto el curso natural de la enfermedad como los eventos adversos relacionados con el cuidado médico pueden tener un impacto significativo en el resultado de los pacientes. El caso presentado aquí ofrece una oportunidad para analizar una cadena de eventos adversos en el manejo de un paciente con complicaciones por carcinoma de células renales metastásico, que requiere consideraciones desde el punto de vista quirúrgico y anestésico.
Los pacientes con carcinoma de células renales pueden desarrollar una constelación de complicaciones, como en el caso presentado. El carcinoma de células renales puede causar metástasis a los vasos venosos; la invasión a la vena cava inferior está descrita en 4 a 15% de los casos, y de ellos, 10 a 25% se extienden a la aurícula derecha [3],[4]. El tratamiento para estos casos incluye nefrectomía radical y trombectomía de la vena cava inferior [4],[5]. La elección de la estrategia quirúrgica así como las tasas de morbilidad y mortalidad relacionadas con este procedimiento pueden estar influidas por el nivel y el volumen del trombo tumoral y el tamaño del tumor [5],[6],[7]. Las tasas de sobrevida a los cinco años de los pacientes con carcinoma de células renales llevados a nefrectomía radical y trombectomía pueden caer de 60% a menos de 20% si existen metástasis a distancia [4],[8],[9]. Las complicaciones postoperatorias agudas y crónicas pueden incluir infección local o sistémica, hemorragia, trombosis venosa profunda o embolismo pulmonar, falla renal, necesidad de terapia de reemplazo renal, infarto miocárdico y neumotórax, entre otras [10].
El tratamiento de las complicaciones de la nefrectomía radical y la trombectomía puede presentar sus propios riesgos. La perforación ventricular, a pesar de ser una complicación relativamente rara de la pericardiocentesis, es una emergencia catastrófica que requiere comunicación efectiva entre los equipos de cirugía y anestesia. La tasa de perforación ventricular después de pericardiocentesis guiada por imágenes ha sido reportada en alrededor de 1% de los casos y es influenciada por el volumen y la localización de la efusión, así como de la accesibilidad y el abordaje anatómico escogido [11],[12]. La perforación del ventrículo derecho es más común que la del izquierdo, pero la última usualmente se presenta con sangrado más severo debido a la presión más alta en el ventrículo izquierdo [13].
La relación entre el cáncer y los desórdenes de la coagulación ha sido encontrada en varios estudios. La malignidad induce un estado protrombótico que puede incrementar el crecimiento tumoral y su diseminación. Las células tumorales tienen la capacidad de liberar factores procoagulantes y citocinas inflamatorias, que ponen al paciente en un riesgo elevado de desarrollar trombosis venosas y arteriales. Las manifestaciones clínicas de los desórdenes de la coagulación relacionados con el cáncer varían desde un estado asintomático hasta trombosis de grandes vasos, o incluso sangrado severo causado por coagulación intravascular diseminada [14],[15].
La hemorragia postoperatoria después de cirugía cardiotorácica ha sido reportada en 5 a 11% de los casos, y los productos sanguíneos se necesitan en hasta el 80% de los casos complejos de cirugía torácica. El sangrado postoperatorio puede incrementar dramáticamente las tasas de morbimortalidad y estancia hospitalaria [16],[17],[18]. Tradicionalmente, el sangrado postoperatorio en cirugía cardíaca se ha manejado con productos sanguíneos [16],[19].
Más recientemente, el factor recombinante VIIa se ha utilizado fuera de su indicación (off-label) para ayudar en la hemostasia de casos difíciles, [16],[17],[18],[19] tal como éste, en el que la falla hepática y la sepsis agravaban la coagulopatía [18],[20]. El mecanismo de acción del factor recombinante VIIa involucra la unión al factor tisular. De este proceso se genera trombina a través de la activación del factor X (FX), que más tarde va a activar las plaquetas. A dosis farmacológicas, el factor recombinante VIIa también puede unirse y activar el factor X en las plaquetas activadas. El factor X forma un complejo con el FVa, lo que lleva a una explosión de trombina (thrombin burst), y a la producción de un coágulo estable de fibrina en el sitio de lesión del vaso [21],[22].
Sallah et al. publicaron una serie de casos de 18 pacientes con coagulación intravascular diseminada relacionada con cáncer, en la cual se utilizó el factor recombinante VIIa con éxito después de que la terapia con productos sanguíneos convencionales había fallado [23].
Los pacientes que son sometidos a cirugía oncológica se enfrentan a un mayor riesgo de sangrado severo y coagulopatía durante procedimientos quirúrgicos mayores. Múltiples factores contribuyen a este incremento de riesgo, incluyendo la biología del tumor, la localización del mismo, la complejidad de la resección, el tratamiento oncológico previo y las comorbilidades. La transfusión de productos sanguíneos en cirugía de cáncer, es utilizada para mejorar la entrega de oxígeno y corregir desórdenes de la hemostasia.
En cirugía oncológica, los desórdenes de la coagulación pueden ocurrir en el periodo preoperatorio, usualmente como resultado de la administración de anticoagulantes o complicaciones relacionadas con el cáncer. Sin embargo, también pueden ocurrir en el periodo intra- y postoperatorio, debido comúnmente a hemodilución o consumo de factores de coagulación, esto último ocurriendo en complicaciones como la sepsis [20].
En este paciente fue necesario soporte vasopresor, considerando su hemodinámica en presencia de sepsis, trauma quirúrgico y falla hepática. En pacientes con choque séptico se ha demostrado una disminución en los niveles endógenos de vasopresina, al igual que en los pacientes con falla hepática terminal [24],[25]. Adicionalmente, la desmopresina también ha sido utilizada en el manejo de hemorragia postoperatoria [19].
El equipo de anestesia debe estar preparado para complicaciones hemodinámicas en pacientes oncológicos, y anticipar cada escenario posible para proveer tratamiento oportuno y evitar eventos adversos. Se deben evaluar continuamente consideraciones anestésicas en pacientes sometidos a cirugía oncológica cardiotorácica de emergencia en cada uno de los momentos: previo a la inducción, durante la cirugía y en el periodo postoperatorio. Se deben asegurar líneas venosas y arteriales adecuadas antes de la inducción, y considerar la necesidad de un catéter venoso central. El monitoreo apropiado de la terapia de fluidos es especialmente crítico para estos pacientes; herramientas tales como el FloTrac/Vigileo™ (Edwards Lifesciences, Irvine, CA, USA) son útiles, recordando que la medición del gasto cardíaco en pacientes con sepsis y cirrosis puede ser impreciso [26],[27].
Los productos sanguíneos deben estar disponibles para su uso inmediato, junto con un infusor rápido para manejar el choque hipovolémico y reestablecer la hemodinámica [17],[28]. El manejo de la hipotermia y la acidosis también son imperativos, ya que ambos factores pueden agravar la coagulopatía [19],[29],[30]. Así mismo, se puede desarrollar hipocalcemia, especialmente en pacientes a quienes se les administraron grandes volúmenes de productos sanguíneos; ésta debe tratarse prontamente porque puede empeorar la capacidad de coagulación [29]. La secuencia de intubación rápida después de la preoxigenación debe realizarse con medicamentos de adecuado perfil cardiovascular, como en cualquier caso de trauma cardíaco [31].
Conclusión
El tratamiento de pacientes con cáncer es con frecuencia un reto para los equipos anestésico y quirúrgico. Tanto el curso natural de la enfermedad, como los eventos adversos relacionados con el cuidado médico tienen un impacto significativo en el resultado de los pacientes.
La implementación de una estrategia integral es necesaria para el tratamiento de un paciente críticamente enfermo como el presentado. El manejo de un paciente con cáncer que requiere cirugía cardiotorácica de emergencia puede ser especialmente difícil en presencia de falla orgánica múltiple y coagulopatía.
En este caso, el uso fuera de indicación del factor recombinante VIIa resultó en un manejo efectivo para la hemorragia postoperatoria severa después de la cirugía cardiotorácica de emergencia cuando los productos sanguíneos tradicionales no fueron suficientes. Esto debe analizarse con cuidado, ya que otros factores pudieron haber influido en la mejoría del paciente. Se deben realizar estudios posteriores para evaluar la eficacia y seguridad de este tratamiento en pacientes oncológicos.
Notas
Aspectos éticos
El consentimiento informado solicitado por Medwave, ha sido firmado por el paciente; una copia de este fue remitido a la dirección editorial de la revista.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

