Editorial
← vista completaPublicado el 1 de octubre de 2015 | http://doi.org/10.5867/medwave.2015.08.6273
Los ensayos clínicos y su publicación - las guías CONSORT en primer plano
Clinical trials and study reporting - CONSORT guidelines at the forefront
Introducción
El ensayo clínico, quizás más conocido por su nombre completo “ensayo clínico controlado y aleatorizado”, es el tipo de diseño de investigación estrella en el arsenal de diseños de investigación biomédica, especialmente en la investigación epidemiológica. La razón es simple: se trata del único diseño de investigación que se puede considerar verdaderamente experimental y el experimento representa la manera más rápida y efectiva de desarrollo del conocimiento científico.
En el lenguaje de la investigación clínico-epidemiológica, el ensayo clínico es el diseño con menor riesgo de sesgos, ese flagelo que es la pesadilla de toda la investigación epidemiológica y que ha sido y sigue siendo objeto de artículos, reflexiones y ensayos sobre metodología en los estudios epidemiológicos [1],[2],[3]. Se utiliza (desafortunadamente) solo en la investigación que evalúa medidas terapéuticas o preventivas pues tales medidas constituyen los únicos objetos de investigación que han logrado vencer la fuerte barrera de la ética en la investigación con seres humanos. Por razones éticas, el experimento está prohibido salvo cuando se trata de realizar un ensayo clínico para evaluar una medida terapéutica o preventiva después de ser aprobado por las autoridades competentes, es decir, los comités de ética para la investigación [4].
Diseño de un ensayo clínico
El propósito del diseño -en el ensayo clínico como experimento- es aislar el estudio de toda influencia ajena al objetivo de evaluar diferencias entre tratamientos. Lo fundamental es intentar obtener grupos iguales en todo sentido excepto en la medida terapéutica o preventiva evaluada, de modo que cualquiera sea el resultado, solo se pueda atribuir a la medida objeto de estudio. A partir de esta noción se pueden formular entonces las llamadas tres reglas de oro que forman parte del diseño de un ensayo clínico dirigidas a enfrentar los sesgos más importantes en este tipo de investigación, dado que atentan directamente contra la similitud entre grupos quiméricamente deseada [5].
- Asignación aleatoria. Evita el sesgo de susceptibilidad. La asignación aleatoria es la medida destinada específicamente a lograr la comparabilidad inicial de los grupos pues es la responsable de lograr grupos inicialmente similares en todo, tanto en lo que conocemos como posibles elementos de confusión, como en aquello que desconocemos.
- Comparación simultánea. Evita el sesgo deprocedimiento. La comparación simultánea supone que los grupos de tratamiento se desarrollen en el mismo ámbito temporal y espacial. Intenta evitar que diferencias en los procedimientos externos al ensayo (pero necesarios en la asistencia médica) introduzcan disimilitudes indeseadas en los grupos de tratamiento que podrían conducir a resultados de alguna manera confundidos.
- Observación objetiva. Evita el sesgo de detección y seguimiento. Es la medida destinada a evitar que diferencias originadas en la subjetividad inexorablemente presente en proveedores, pacientes y evaluadores, malogre la similitud necesaria entre los grupos. Es la regla que obliga a emplear los controvertidos placebos, dolores de cabeza inevitables para los comités de ética.
La Figura 1 brinda un esquema del diseño de un ensayo clínico, ilustrando los sesgos más importantes y las tres reglas mencionadas.
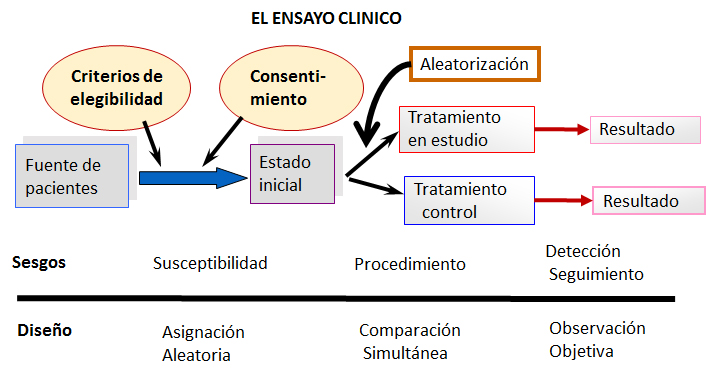
Figura 1. Esquema del diseño de un ensayo clínico básico y potenciales fuentes de los sesgos más comunes.
Todos los elementos de diseño que conforman los ensayos clínicos más modernos y que se han ido introduciendo con el tiempo, se relacionan con el cumplimiento efectivo de estas tres reglas de oro. Examinemos, por ejemplo, el análisis por intención de tratar [6]. Esta regla obliga a los investigadores a incluir en el análisis de los resultados, paradójicamente, a aquellos participantes que no pudieron terminar el ensayo. El desconcierto que genera en los investigadores principiantes (generalmente honestos, eso creemos) es bien alto ¿cómo vamos a incluir en los resultados a alguien que desistió de tratarse o a alguien que tuvo un accidente y no pudo concurrir a las citas programadas? Pues, la forma de hacerlo ya ha sido concebida (para eso está el “último valor llevado adelante” o “last value carried forward, LVCF” y el “peor escenario” o worst scenario) y la razón está relacionada con posibles disimilitudes “convenientes” entre grupos, introducidas exprofeso por investigadores inescrupulosos incitados por las -más inescrupulosas aún- compañías farmacéuticas transnacionales, tal como ha sido ya denunciado en diferentes foros científicos y en particular abordado en nuestra Revista [7].
Abundar más en elementos metodológicos de los ensayos clínicos en el estrecho marco de un editorial de la Revista es imposible; la literatura metodológica sobre ensayos clínicos se cuenta hoy por miles o quizás cientos de miles de artículos, libros, monografías y otros medios de divulgación científica.
El reporte de un ensayo clínico
En el ciclo que conecta a la investigación con la aplicación de sus resultados en la práctica social transita indefectiblemente por su publicación (Figura 2).
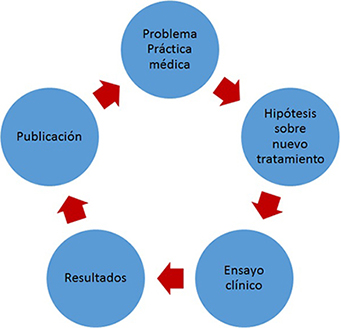
Figura 2. Esquema simplificado de relación entre la práctica médica, la investigación sobre terapéutica y la publicación de resultados
La publicación de los resultados de un ensayo clínico es un requerimiento de las buenas prácticas clínicas (denominación que se le da al “estándar de calidad ética y científica internacional para el diseño, realización, registro y notificación de ensayos que impliquen la participación de los sujetos humanos” [8]). También es un requisito de la ética de la investigación y de los investigadores (ver los artículos 35 y 36 de la Declaración de Helsinki, última versión, octubre 2013 [9] y un editorial anterior de Medwave [10]). Pero es también sin dudas una regla del sentido común. ¿Cómo no publicar los resultados de un estudio que ha consumido cuantiosos recursos humanos y materiales?, ¿cómo privar a la comunidad científica de un resultado de investigación de tal envergadura?, ¿cómo privar de tal resultado a la sociedad?, más aún, ¿por qué contribuir a la repetición innecesaria de estudios ya realizados, dejando de publicar resultados?
Por raro que parezca, el hecho es que la no publicación de resultados de la investigación (en particular de los ensayos clínicos) es un problema relativamente frecuente que preocupa hoy a los que abogamos por una práctica investigativa nacida de la ética y la honestidad y que da lugar a un sesgo que no mencionamos antes y que, esta vez, no está ligado al diseño mismo de la investigación [11]. Un sesgo que deja impotentes a los que luchamos por una práctica médica que parta de la evidencia científica y contra el cual no son suficientes las armas que hoy tenemos. Se trata del llamado sesgo de publicación, es decir, la idea distorsionada que puede generarse en la comunidad científica en general (y en el público lego también), debido a que algunos resultados de investigación (en este caso de ensayos clínicos) no se publican. Desafortunadamente comprobado está que la no publicación no es obra del azar y la tendencia es a no publicar resultados no favorables a las hipótesis planteadas. La consecuencia de este sesgo es un falsa magnificación de la bondad de medidas terapéuticas o preventivas que sin dudas puede tener una repercusión negativa en la sociedad. El sesgo de publicación es hoy objeto de estudio y discusión en ámbitos científicos de diversa índole [12],[13],[14].
Continuemos con el reporte de los ensayos clínicos. Lo primero es destacar que el reporte debe reflejar en detalle el diseño que se utilizó, en resumen, cómo se cumplieron las tres reglas de oro mencionadas antes y todo lo demás que se añade a ellas: criterios de elegibilidad, detalles de los tratamientos, definición y operacionalización de variables primarias y secundarias y hasta la forma en que se procesaron los datos y se realizó el análisis estadístico.
Una introducción es también necesaria; vale decir, fundamentar el ensayo clínico (algo que debe hacerse desde el proyecto inicial por supuesto), es imprescindible. Independientemente de la barrera que significa la obligación de pasar por un comité de ética, el investigador debe tener en mente que experimentar con seres humanos solo es permisible si se respalda por una fuerte razón científica.
Sin abrumar al lector, los resultados del ensayo clínico han de ser claros y transparentes; es necesaria una síntesis que permita la generalización correspondiente; y los intervalos de confianza para los efectos que se estiman son absolutamente imprescindibles. Sin ellos, los lectores no tendrán una idea precisa de la magnitud del efecto logrado, sean o no significativas las diferencias encontradas. Mucho se ha hablado ya de la inoperancia de los socorridos valores de p y la diferencia entre significación clínica y significación estadística [15],[16],[17].
La discusión de los resultados es el punto más débil pero también necesario en el reporte de una investigación, particularmente un ensayo clínico. El lector no solo tiene derecho a conocer resultados sino a participar de las reflexiones de los autores en torno a estos y distinguir su lugar en lo que hasta el momento es conocido.
Esbozado lo anterior, pasemos a lo que probablemente interesa más a nuestros lectores/autores/investigadores. ¿Cómo en definitiva se puede realizar un buen reporte de los resultados de un ensayo clínico que permita una publicación decorosa de estos? La respuesta podría ser complicada porque escribir de manera resumida, sin obviar aspectos importantes, sobre el fundamento, el método y los resultados de un estudio que ha consumido tiempo, recursos, y en particular, conocimiento y habilidades, no es una tarea sencilla.
Algo de historia sobre CONSORT
Afortunadamente en 1994 -a raíz de las reiteradas alusiones a reportes de mala calidad de los ensayos clínicos en las revistas médicas y varias disquisiciones alrededor de este tema que preocupaba entonces a editores, científicos de la medicina y autoridades sanitarias- se publicaron dos artículos que proponían una manera estructurada para publicar ensayos clínicos. Uno de estos fue una comunicación especial de la revista JAMA [17] y el otro un artículo de posición de la revista Annals of Internal Medicine [18]. Ambos artículos reportaban las ideas de dos grupos que trabajaron de forma independiente en la búsqueda de una forma sistemática y estructurada para publicar resultados de ensayos clínicos: el The standards of reporting trials group autor del artículo publicado en JAMA y el Working Group on Recommendations for Reporting of Clinical Trials in the Biomedical Literature que publicó el artículo del Annals of Internal Medicine.
En 1995, un editorial de la revista JAMA [19] hacía un llamado a la unión de estos dos grupos con el fin de lograr una propuesta adecuadamente combinada. Ambos grupos fueron receptivos a este llamado y en 1996 salió a la luz la primera versión de una guía para el reporte de los resultados de ensayos clínicos [20] producto del trabajo conjunto de los dos grupos iniciales. Fue publicada inicialmente en la revista JAMA y casi inmediatamente la BMJ divulgó su adherencia a las recién publicadas guías y reprodujo básicamente sus enunciados [21]. La nueva guía tomó el título de CONSORT que resulta el acrónimo de su nombre en inglés: Consolidated Standards of Reporting Trials. En 2001 se produjo la primera gran revisión de las guías iniciales publicada simultáneamente en tres revistas médicas prestigiosas: Annals of Internal Medicine [22], JAMA [23] y Lancet [24].
CONSORT 2010 y Medwave
En 2010 se produce una tercera revisión de CONSORT que esta vez fue publicada por ocho revistas médicas, algunas de acceso abierto como PLoS Medicine [25], y BMC Medicine [26].
Hasta el día de hoy, además de las guías iniciales y sus dos revisiones posteriores dirigidas al diseño básico de un ensayo clínico paralelo, se han publicado extensiones a ensayos clínicos con distintas particularidades. Se distinguen el CONSORT para estudios de no inferioridad [27]; el CONSORT para ensayos en grupos [28]; el CONSORT para los llamados ensayos pragmáticos [29]; y el que se refiere a estudios de tratamientos no farmacológicos donde se incluirían los ensayos con procedimientos quirúrgicos, terapias rehabilitadoras y otras [30].
La argumentación detrás de un buen reporte de un ensayo clínico se puede resumir con las palabras de Douglas G. Altman [21]:
Como cualquier estudio, los ensayos clínicos aleatorizados están sujetos a sesgos si se hacen mal. Por lo tanto, es esencial que estos ensayos se hagan bien y se informen adecuadamente. Los lectores no deben tener que inferir lo que probablemente se hizo, se les debe decir explícitamente. Debe utilizarse la metodología adecuada y también debe observarse que esta se utilizó.
La guía CONSORT básica 2010 contiene la lista de chequeo (checklist) con 25 ítems, algunos de ellos con sub-ítems, lo que en realidad le confiere 37 aspectos que deben reportarse. La guía sugiere además que el autor incluya un diagrama de flujo de pacientes donde se vea claramente el número de personas elegibles inicialmente y el número que se perdió en cada etapa subsiguiente, incluye para esto una propuesta concreta ilustrada con una figura de cómo debe hacerse este flujograma. No se limita al reporte de aspectos del método que se empleó para realizar el ensayo clínico sino que incluye elementos de la introducción, del reporte de resultados y de la discusión que debe hacerse sobre estos.
El autor se ve entonces comprometido a no olvidar el reporte de todos los aspectos incluidos en la guía o en última instancia a explicar por qué no se realizó alguno de los aspectos que deben reportarse. Lo que podemos llamar “buena noticia” en este contexto es que los investigadores deberán conocer y pensar en la guía CONSORT no solo a la hora de escribir el reporte de sus resultados sino desde que lo están planificando.
Según se anuncia en el sitio web de CONSORT (http://www.consort-statement.org/about-consort/endorsers) existen hoy más de 600 revistas biomédicas que respaldan a las guías CONSORT y varios editoriales como el International Committee of Medical Journal Editors (ICMJE) y la World Association of Medical Editors (WAME). Una revisión sistemática publicada en 2012 sugiere que el uso de CONSORT puede efectivamente mejorar el reporte de ensayos clínicos [31].
Nuestra Revista respalda la iniciativa CONSORT y promueve su uso mediante la inclusión de la guía CONSORT entre los documentos que deben revisar los autores de ensayos clínicos antes de someter su manuscrito a la evaluación por la revista, y la fuerte recomendación en las instrucciones a los autores a que “se guíen por las normas que recomienda la iniciativa internacional conocida por The EQUATOR Network (Enhancing the QUAlity and Transparency Of health Research)” donde aparece CONSORT.
A modo de conclusión
Los ensayos clínicos constituyen la forma más eficaz, efectiva y eficiente de evaluar la bondad de una nueva medida terapéutica o preventiva. Su utilización con este fin contribuye decididamente a aportar a la sociedad nuevos tratamientos que a la larga realmente mejoren la calidad de vida de los seres humanos. Por esta razón, no basta con realizar un ensayo clínico con el mayor rigor sino que sus resultados deben ser publicados adecuadamente en los espacios destinados para este fin y en el momento adecuado. Las guías CONSORT en sus diferentes variantes constituyen hoy el mejor patrón o pauta para elaborar un reporte óptimo sobre el fundamento, el método y los resultados de un ensayo clínico.
Notas
Conflictos de intereses
Las autoras declaran no tener conflictos de intereses con la materia de este artículo.

