Publicado el 1 de octubre de 2008 | http://doi.org/10.5867/medwave.2008.09.1709
Infecciones pulmonares emergentes
Emerging lung infections
Resumen
Este texto completo es una transcripción editada de una conferencia que se dictó en el XXV Congreso Chileno de Medicina Intensiva realizado en Pucón entre el 17 y el 20 de Octubre 2007. El congreso fue organizado por la Sociedad Chilena de Medicina Intensiva, bajo la presidencia del Dr. Sebastián Ugarte y el secretario ejecutivo del congreso fue el Dr. Antonio Hernández.
Introducción
Se denomina enfermedades infecciosas emergentes a aquellas que han aumentado en forma sostenida en las últimas dos décadas; son causadas por diversos agentes etiológicos, como priones, virus, bacterias, hongos y parásitos; afectan a diferentes poblaciones de riesgo y tienen gran variedad en cuanto a vía de transmisión, historia natural y ecoepidemiología.
Las infecciones reemergentes son aquellas que reaparecen luego de una disminución significativa en su incidencia.
El Ministerio de Salud (MINSAL) de Chile ha publicado una lista de todas aquellas patologías consideradas como emergentes o reemergentes, agrupadas según el agente etiológico. En ese listado se reconocen como infecciones pulmonares emergentes a la Influenza Aviar, el Síndrome Respiratorio Agudo Severo (SARS) y la infección por Virus Hanta.
Síndrome respiratorio agudo severo (SARS)
El SARS significó un gran desafío para la comunidad mundial cuando apareció, a fines del año 2002. Descrita inicialmente en la provincia de Guangdong, China, a partir de un brote de neumonía atípica, esta enfermedad se fue extendiendo rápidamente a los países vecinos y luego llegó a América del Norte y Europa. Si bien en un inicio no se conocía su causa, el patrón de transmisión hizo que las sospechas recayeran sobre un agente etiológico específico, lo que motivó intensas investigaciones. A continuación se resume la cronología de los eventos que llevaron a establecer la existencia del SARS como enfermedad y su etiología:
- En noviembre de 2002 se comunicó el primer caso de neumonía atípica, en la ciudad de Foshan, provincia de Guangdong.
- En enero de 2003 se produjo un brote de neumonía en la capital de la misma provincia.
- En febrero de 2003 la OMS recibió la notificación de 305 casos de una enfermedad respiratoria en esta provincia china.
- A mediados del mismo mes, un médico enfermo proveniente de Guangdong contagió a otros pasajeros en un hotel de Hong Kong.
- Uno de estos contactos viajó hasta Toronto, Canadá y falleció a principios de marzo en esa ciudad, contagiando a cinco de sus familiares.
- El 12 de marzo de 2003 la OMS emitió una alerta global.
- El 15 de marzo de 2003 la OMS definió el SARS y estableció redes multicéntricas de laboratorios con el objetivo de encontrar la causa de este síndrome.
- Luego de una prolija y rápida investigación se determinó que un nuevo tipo de coronavirus, el SARS-CoV, era el agente etiológico del cuadro (1).
El número probable de casos de SARS llegó a 3.500 en mayo de 2003; la mayor incidencia ocurrió en China y sus países vecinos, América del Norte y algunos países de Europa. En mayo de 2003 viajaban muy pocos pasajeros en el metro de Beijing, que antes solía estar repleto, por temor al contagio.
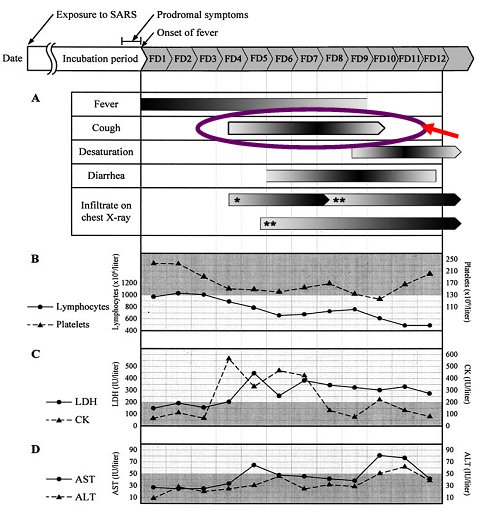
En el año 2004 aparecieron las primeras publicaciones sobre la experiencia adquirida sobre el cuadro clínico del SARS. En una de estas publicaciones se describe que los síntomas iniciales son inespecíficos: el enfermo comienza con fiebre, que se mantiene en el tiempo; luego aparece la tos, que no se presenta desde el inicio, sino que comienza alrededor del cuarto día; posteriormente sobreviene la insuficiencia respiratoria, que en un porcentaje importante de pacientes se acompaña diarrea. En ese momento comienzan a aparecer alteraciones radiológicas, tales como infiltrados intersticiales y lobares. En el laboratorio se encuentra linfopenia al ingreso, en 70% de los casos; menos frecuente es la trombocitopenia y el aumento de LDH, CK y enzimas hepáticas. El estudio mediante técnicas de PCR en muestras de aspirado nasofaríngeo permite identificar el agente etiológico en 85% de los enfermos (2) (Fig. 1).
 Tamaño completo
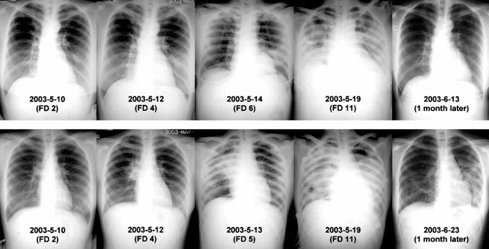
Tamaño completo En la Fig. 2 se observan distintos patrones radiológicos y su evolución en el tiempo en dos pacientes con SARS. En la serie superior se observa infiltrados intersticiales progresivos, que al mes tienden a la resolución completa; en la serie inferior se observa una imagen condensante en el lóbulo superior derecho que evoluciona a síndrome de distrés respiratorio agudo, con imágenes residuales tipo neumonía necrotizante al mes de evolución (2).
 Tamaño completo
Tamaño completo En un estudio se analizó el efecto de ribavirina en 44 pacientes con SARS provenientes de dos centros distintos de Taiwán. No se encontró beneficio, más aún, la mortalidad fue levemente mayor en el grupo con ribavirina, aunque la diferencia no fue estadísticamente significativa. En el subgrupo de pacientes hipoxémicos el fármaco generó una caída en los niveles de hemoglobina, la que resultó ser un factor de riesgo independiente de mortalidad (3).
En el año 2006 se publicó un estudio retrospectivo, efectuado en 401 pacientes que cumplían con los criterios diagnósticos establecidos por la OMS de un total de 1278 casos de probable SARS, en China, durante el primer semestre de 2003. Se distinguieron dos grupos: aquellos que presentaron SARS crítico, definido por la presencia de índice Pa/FiO2 menor de 300, y aquellos con SARS no crítico. De los portadores de SARS no crítico, 59% (149/249) recibieron corticoides y todos sobrevivieron; en cambio, 79% (121/152) de los pacientes con SARS crítico recibieron corticoides y fallecieron 25 pacientes. No hubo diferencias con el uso de corticoides en el grupo de pacientes con SARS no crítico, pero en el grupo con Pa/FiO2 menor de 300 esta medida terapéutica contribuyó a disminuir la mortalidad y la duración de la estadía hospitalaria. Las dosis de hidrocortisona que se utilizaron fueron 100 más menos 80 mg/día en el grupo no crítico y 120 más menos 80 mg/día en el grupo de pacientes críticos. La aparición de complicaciones se asoció a la necesidad de ventilación mecánica invasiva, pero no al uso de corticoides (4).
Si bien la tasa de letalidad global del SARS es de 15%, aumenta hasta 70% en individuos mayores de 60 años. Otros factores de riesgo de mortalidad por SARS son el sexo masculino y la presencia de alguna comorbilidad. La influencia del sistema de salud no está clara. En la Fig. 3 de muestra el equipo de protección que se recomienda para el personal de salud que atienda a pacientes con SARS: de arriba abajo, gorro y bata, máscara número 95 y guantes, gafas y cubre calzado o botas quirúrgicas.
 Tamaño completo
Tamaño completo Influenza aviar (H5N1)
La influenza aviar es un tipo de gripe causado por el virus influenza H5N1, que afecta a las aves de corral. Habitualmente los virus influenza son altamente especie-específicos y es rara su transmisión a otra especie; de hecho, desde 1959 se había descrito sólo 10 casos de infección humana por el virus de la influenza aviar. De los cientos de cepas de virus influenza A aviar, sólo cuatro pueden causar infección en humanos: H5N1, H7N3, H7N7 y H9N2 y producen una enfermedad leve, que se caracteriza solamente por conjuntivitis, con excepción del virus H5N1, que es altamente patogénico.
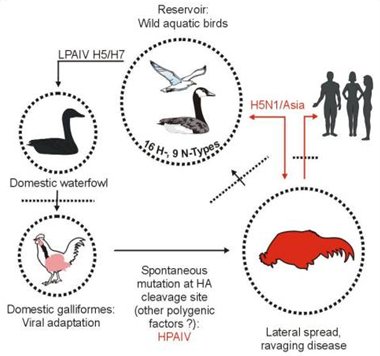
En Asia es común que la crianza de aves de corral se realice muy cerca de zonas residenciales, por lo que se cree que existiría un reservorio en aves salvajes a partir del cual se contaminarían las aves domésticas, en las cuales se produciría algún tipo de mutación espontánea que originaría una cepa altamente agresiva para la especie humana (Fig. 4)
 Tamaño completo
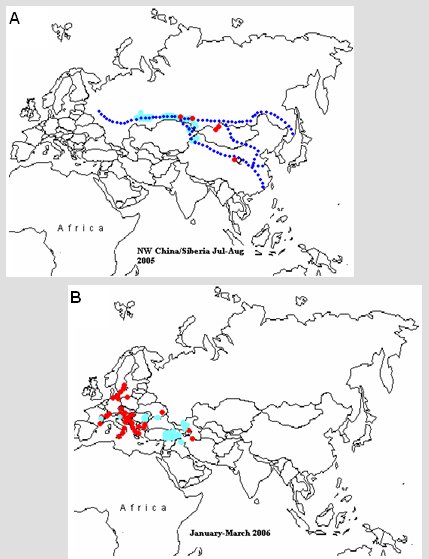
Tamaño completo En los brotes estudiados de influenza aviar se ha descrito cinco fases de diseminación, de las cuales las más importantes son la 2 y la 4. Los brotes se iniciaron en China, en aves de corral; posteriormente el virus apareció en aves salvajes; en la fase 2, que ocurrió en verano de 2005, no se observó una propagación que siguiera las rutas de migración de las aves, sino las rutas de transporte comercial de ellas (Fig. 5 A). Entre enero y marzo de 2006 ocurrió la fase 4, en la que se produjo la diseminación en aves de corral y salvajes en Europa, se identificaron brotes persistentes en Turquía y Rumania, se observó muerte de aves salvajes en pequeños números, principalmente gansos y, en menor grado, patos, y se produjeron brotes importantes en aves de corral en Alemania y Francia (Fig. 5 B). Después de esto sobrevino la fase 5, en que se produjo la diseminación de este brote hacia África.
 Tamaño completo
Tamaño completo En cuanto a la virología del H5N1, existen varias cepas genéticas circulando en el sudeste asiático que se mantienen en las aves de corral. Existen tres tipos de linaje del genotipo Z que han afectado a distintos países europeos y en Nigeria se han encontrado dos genotipos diferentes. Por otro lado, existe una amplia variabilidad en la susceptibilidad de las aves salvajes según la especie, edad y carga viral de la exposición; por ejemplo, las palomas se infectan, pero no diseminan el virus. El virus sobrevive en el agua por largo tiempo en condiciones de bajas temperaturas, baja salinidad y alcalinidad moderada. Se ha demostrado que al menos 42 especies de aves salvajes han sido infectadas por el virus H5N1.
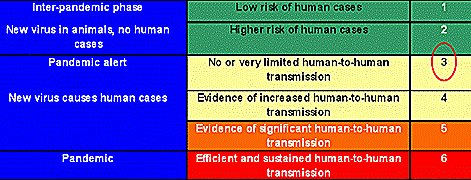
Junto con la expansión de este brote en aves silvestres y de corral se ha producido un aumento de los casos de infección humana por H5N1, lo que ha causado preocupación en todos los ministerios de salud y en la Organización Mundial de la Salud (OMS). El número acumulativo de casos de influenza aviar A/H5N1 ha aumentado de 4, en el año 2003, hasta 331 en septiembre de 2007, con una mortalidad de 61%. En cuanto a la vigilancia epidemiológica, la OMS describe seis fases, agrupadas en tres etapas: etapa inter-pandémica, etapa de alerta pandémica y etapa pandémica. La situación actual, a nivel global, es de alerta pandémica, que corresponde a la fase 3, en la cual el riesgo de infección humana es considerable y existen nuevos subtipos del virus en humanos, pero no existe transmisión humano-humano o ésta es muy limitada (Tabla I).
 Tamaño completo
Tamaño completo Históricamente se describen tres grandes pandemias causadas por el virus influenza durante el siglo XX: la llamada gripe española (1918-19), que se produjo después de la primera guerra mundial, causada por el virus H1N1; la pandemia de 1957, por H2N2 y la de 1968, provocada por la cepa H3N3. Hoy existe la posibilidad de que se genere un nuevo virus pandémico a partir del virus influenza aviar A H5N1. Esta situación de alerta pandémica se ha reconocido en Chile y, en consecuencia, se ha creado un sistema de vigilancia epidemiológica de influenza aviar en humanos, junto con un plan nacional de preparación para una eventual pandemia de influenza. Lo anterior permitió que el Servicio Agrícola y Ganadero (SAG) detectara algunos casos de gripe aviar en aves de la quinta región y procediera a sacrificarlas, erradicando el foco de infección. En este momento no existe influenza aviar en Chile.
Infección por hantavirus
El síndrome cardiopulmonar por hantavirus (SCPH) se describió por primera vez en los Estados Unidos, en 1993, a raíz de la irrupción de un síndrome de distrés respiratorio agudo de alta letalidad, en el que se logró identificar como agente etiológico a un virus ARN del género hantavirus, denominado virus sin nombre. A diferencia del cuadro descrito en Asia y Europa, llamado fiebre hemorrágica con síndrome renal, estos pacientes cursaban sin hemorragia, por lo que se eligió la denominación de síndrome pulmonar por hantavirus. En Sudamérica el cuadro se describió sucesivamente en Brasil, Paraguay, Argentina y Chile y se encontró una especie nueva de este virus en Argentina que se denominó virus Andes, cuyo reservorio es el roedor Oligorizomys longicaudatus. El virus aislado en Argentina es el mismo que ha provocado los casos en Chile.
La presentación típica del SCPH se inicia con fiebre elevada, mialgias y astenia y luego de un pródromo de 2 a 7 días sobreviene disnea de evolución rápida, con desarrollo de insuficiencia respiratoria aguda e inestabilidad hemodinámica secundaria a shock mixto, séptico y cardiogénico, de donde proviene la denominación actual del síndrome. La radiografía de tórax muestra un rápido desarrollo de infiltrados intersticiales bilaterales, a lo que se asocia hemoconcentración y trombocitopenia.
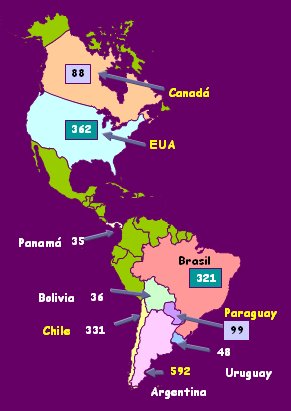
En el año 2004 se comunicaron 1910 casos en la región de Las Américas, que provenían principalmente de Brasil, Estados Unidos, Argentina y Chile (Fig. 6).
 Tamaño completo
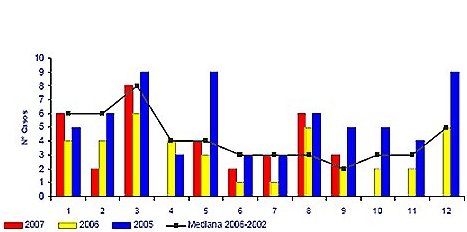
Tamaño completo La vigilancia en Chile durante los últimos tres años muestra una incidencia estable, con predominio en los meses de verano (Fig. 7). Lo que más preocupa es que la letalidad del cuadro también se ha mantenido estable, con cifras cercanas a 30%, con excepción del año 2006 en que aumentó a 44%.
 Tamaño completo
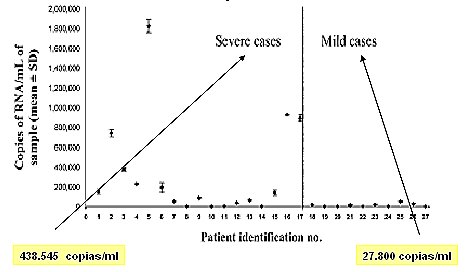
Tamaño completo En un trabajo publicado en 2006 (5) se encontró que la carga viral observada en los pacientes con enfermedad leve era menor que en aquellos con enfermedad grave: 27.800 copias/ml versus 438.545 copias/ml, en promedio (Fig. 8).
 Tamaño completo
Tamaño completo
Experiencia en SCPH en el Hospital Clínico Regional de Concepción
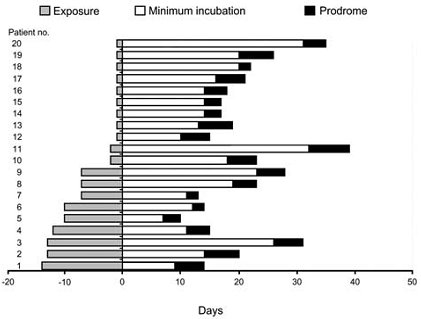
En el Hospital Clínico Regional de Concepción se ha diagnosticado SCPH en 23 pacientes, en su mayoría de sexo masculino (82,6%), de edad promedio 30 años con rango de 15 a 49. En cuanto a antecedentes epidemiológicos, la gran mayoría de los pacientes había realizado actividades agrícolas o forestales en zonas rurales (20 de 23 casos). El contagio habría ocurrido en actividad recreativa en 1 caso; en recinto penitenciario, en 1 caso y fue de origen suburbano en 1 caso. El período estimado de incubación fue 20 días, con rango de 18 a 25 días, similar a los datos publicados por el grupo de Vial en 2006 (6) (Fig. 9).
 Tamaño completo
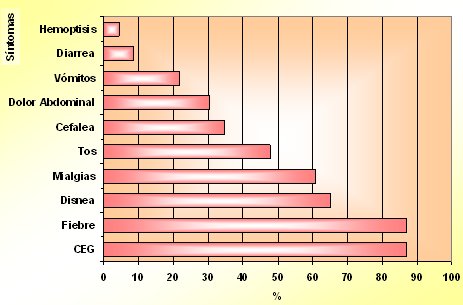
Tamaño completo En cuanto a los síntomas presentes en el momento del ingreso, más de 60% de los pacientes presentó compromiso del estado general, fiebre, disnea y mialgias; ocasionalmente hubo tos, cefalea y con menor frecuencia síntomas gastrointestinales (Fig. 10).
 Tamaño completo
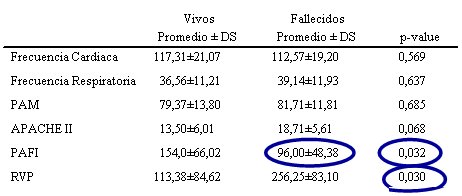
Tamaño completo El índice PaO2/FiO2 inicial en pacientes con SCPH, así como la resistencia vascular pulmonar (RVP) de ingreso, son un factor determinante de mortalidad. Hubo cierta asociación, no significativa, entre mortalidad e índice Apache II inicial.
El manejo intrahospitalario de estos pacientes es de tipo invasivo, con catéter de Swan-Ganz, ventilación mecánica, corticoides y ocasionalmente, hemodiálisis. La hospitalización se mantuvo por 14 días en promedio; 11 de los pacientes estuvieron en la unidad de pacientes críticos; la tasa de letalidad del grupo fue cercana a 30%, similar a las cifras nacionales. Se encontraron menos manifestaciones hemorrágicas y el índice PaO2/FiO2 de ingreso fue un fuerte predictor de letalidad, al igual que en otras series; no hubo diferencia en parámetros hemodinámicos de ingreso entre vivos y fallecidos, excepto para la RVP (Tabla II).
 Tamaño completo
Tamaño completo Del análisis de los pacientes con SCPH atendidos en el Hospital Clínico Regional de Concepción se llegó a las siguientes conclusiones:
- La presentación fue similar a la descrita en otras series nacionales (7, 8, 9).
- Se encontraron menos manifestaciones hemorrágicas.
- Hubo tendencia a mayor letalidad en presencia de puntaje APACHE II más elevado, pero esto no fue estadísticamente significativo, a diferencia del trabajo de Riquelme.
- Al igual que en otras publicaciones nacionales, no hubo diferencias significativas entre vivos y fallecidos en cuanto a hematocrito, recuento de plaquetas, recuento de leucocitos y tipo y cuantía de la hemorragia.
- Tampoco hubo diferencia estadísticamente significativa a favor del uso de corticoides.
Resumen
- Las enfermedades emergentes tienen un importante impacto epidemiológico, con letalidades globales de 15%, 40% y 62% para SARS, SCPH e Influenza H5N1, respectivamente.
- Los síntomas iniciales son más bien inespecíficos y requieren de una historia acuciosa para tener un diagnóstico precoz.
- Se requiere un laboratorio con implementación para exámenes específicos.
- Algunas de estas patologías tienen alto riesgo de transmisión al personal de salud, como es el caso de SARS y virus influenza H5N1.
- Es necesario mantener el actual estado de alerta de pandemia para gripe aviar.

