Congresos
← vista completaPublicado el 1 de noviembre de 2007 | http://doi.org/10.5867/medwave.2007.10.586
Medicina nuclear en evaluación de epilepsias
Nuclear medicine in assessing epilepsies
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del II Congreso Chileno de Medicina Nuclear, realizado en Viña del Mar entre los días 6 al 11 de noviembre de 2006. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Presidente de la Sociedad: Dr. Juan Carlos Quintana Fresno.
Presidente Comité Científico: Dra . Teresa Masssardo Vega
Introducción
La epilepsia es una de las enfermedades neurológicas graves más prevalentes; afecta a entre 0,5% y 1% de la población general; 20% de los epilépticos no se controlan adecuadamente con medicamentos y la mayoría de los pacientes refractarios a tratamiento presentan epilepsia parcial, de tipo focal.Las epilepsias se dividen en tres grandes grupos (ILAE): epilepsias parciales, epilepsias generalizadas y epilepsias no clasificadas. Las epilepsias parciales se subdividen a su vez en parciales simples, que no tienen compromiso de conciencia; parciales complejas, que presentan compromiso de conciencia; y parciales con generalización secundaria (Fig. 1).
 Tamaño completo
Tamaño completo Figura 1. Clasificación de las epilepsias según la Liga Internacional contra la Epilepsia
Epilepsia parcial
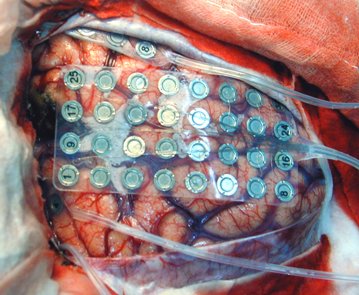
La mayoría de las crisis parciales complejas surgen en el lóbulo temporal y por eso se denominan epilepsias del lóbulo temporal, aunque las crisis se pueden iniciar en otras áreas corticales. Entre los pacientes con epilepsia focal, 40% son refractarios a tratamiento médico; de los pacientes con epilepsias del lóbulo temporal que son sometidos a tratamiento quirúrgico, entre 57% y 80% quedan libres de crisis luego de la cirugía. En cambio, la resección de focos extratemporales es menos eficaz: sólo 40% a 50% de los pacientes quedan libres de crisis.Hay varios métodos localizadores para el estudio de las epilepsias parciales. El electroencefalograma (EEG), que sigue siendo el método más importante, se puede utilizar en período interictal o ictal. El EEG ictal, aislado, no permite localizar el foco epileptogénico en aproximadamente 40% de los casos, pero en muchos pacientes la localización se puede lograr sumando al EEG ictal los hallazgos clínicos y las imágenes. En casos contradictorios se realiza electrocorticografía ictal, que consiste en la instalación de electrodos directamente en la superficie cerebral. Debido a que es un método invasivo y a las posibles complicaciones, se reserva sólo para casos dudosos (Fig. 2).
 Tamaño completo
Tamaño completo Figura 2. Colocación de electrodos para electrocorticografía
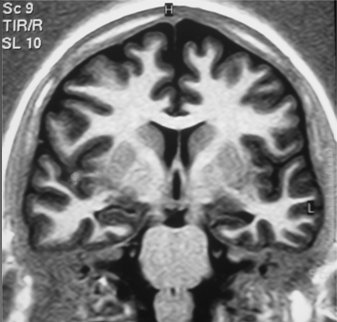
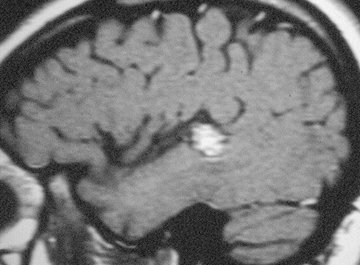
Con resonancia magnética (RM) se puede identificar atrofia hipocampal en el lado del foco epileptogénico hasta en 75% de los casos. El cálculo volumétrico y el aumento de la señal en T2 aumentan la sensibilidad y especificidad de los hallazgos de la resonancia. En la Fig. 3 se observa una imagen de resonancia en un corte coronal a través del lóbulo temporal, con atrofia del hipocampo izquierdo. Con esta técnica imaginológica también se pueden identificar pequeños tumores y anormalidades del desarrollo cortical, en pacientes con epilepsia refractaria a tratamiento (Fig. 4).
 Tamaño completo
Tamaño completo Figura 3. Resonancia magnética: Atrofia hipocampal izquierda
 Tamaño completo
Tamaño completo Figura 4. Resonancia magnética: Tumor cortical temporal superior
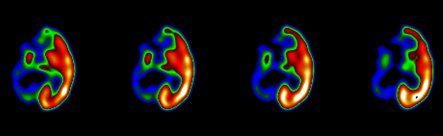
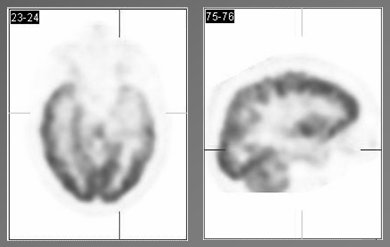
Otro método muy útil para el estudio de la epilepsia parcial es la tomografía por emisión de positrones (PET) con fluordeoxiglucosa, que es un análogo estructural de la glucosa, cuya acumulación tisular es directamente proporcional al metabolismo de ésta. En epilepsias del lóbulo temporal, la existencia de áreas hipometabólicas se asocia con la localización del foco epileptogénico, aunque su extensión es mayor que la anormalidad histológica. El grado de hipometabolismo no se asocia con la edad, duración de la epilepsia ni actividad epileptiforme interictal. La Fig. 5 muestra un corte a lo largo del eje del lóbulo temporal y sagital, con marcada asimetría de metabolismo de la glucosa entre los lóbulos; se observa importante hipometabolismo temporal mesial izquierdo, que se extiende hacia el polo anterior y la corteza lateral. Las áreas hipometabólicas se pueden extender hacia la corteza frontal y parietal adyacente y hacia el tálamo ipsilateral, aunque en menor magnitud.
 Tamaño completo
Tamaño completo Figura 5. Hipometabolismo temporal mesial izquierdo en PET con fluordeoxiglucosa, en un paciente con epilepsia focal
Epilepsia focal del lóbulo temporal
La epilepsia focal más importante es la epilepsia del lóbulo temporal. La anormalidad histológica más frecuente en la epilepsia focal temporal es la esclerosis temporal mesial, con pérdida neuronal y gliosis en el hipocampo y amígdala. En el corte histológico y macroscópico de la Fig. 6 se observa disminución del tamaño y pérdida neuronal en el hipocampo izquierdo.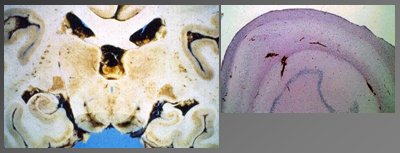 Tamaño completo
Tamaño completo Figura 6. Esclerosis temporal mesial con pérdida neuronal y gliosis en hipocampo y amígdala
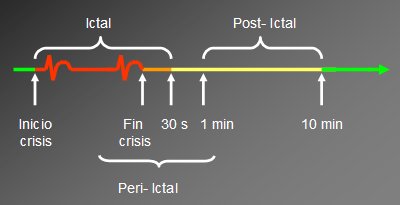
La perfusión cerebral regional cambia dinámicamente durante el transcurso de las crisis epilépticas. Para propósitos del estudio de perfusión cerebral con SPECT, las crisis epilépticas se dividen en tres períodos: ictal, que abarca desde el inicio de la crisis hasta los 30 primeros segundos, una vez finalizada la crisis; post-ictal, que va desde el minuto hasta los diez minutos post crisis; y el período peri-ictal, que considera desde el fin de la crisis hasta el primer minuto posterior al término del episodio (Fig. 7).
 Tamaño completo
Tamaño completo Figura 7. Clasificación de SPECT en epilepsia, de acuerdo al momento de la inyección del radiofármaco
En el período inter-ictal, esto es, sin crisis, el flujo y el metabolismo cerebral pueden estar normales o reducidos. La disminución del metabolismo es frecuente en epilepsias del lóbulo temporal (más de 70%) y, en el caso del flujo sanguíneo regional, se detecta en 55% de los casos; en 10% de los casos puede ser contralateral; esta alteración del flujo y metabolismo cerebral es menos común en otras formas de epilepsia. Generalmente, la extensión del área de hipoperfusión e hipometabolismo es mayor que la alteración histológica. Las alteraciones de flujo son menos marcadas y menos exactas que los cambios en el metabolismo regional de la glucosa.
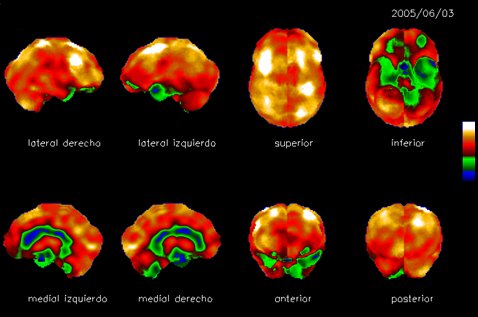
El patrón de hipoperfusión con SPECT en el período inter-ictal, muestra grado y extensión variables de hipoperfusión; en general compromete el polo anterior y la corteza temporal mesial y puede haber extensión hacia la corteza temporal lateral y la corteza frontal y parietal adyacentes. Ocasionalmente puede haber aumento de la perfusión local. En la Fig. 8 se muestra una reconstrucción tridimensional del flujo sanguíneo regional, en paciente epiléptico durante el período inter-ictal; se observa hipoperfusión del lóbulo temporal izquierdo, que compromete tanto la corteza mesial como la corteza lateral y el polo anterior.
 Tamaño completo
Tamaño completo Figura 8. Período inter-ictal. Reconstrucción tridimensional del flujo sanguíneo regional
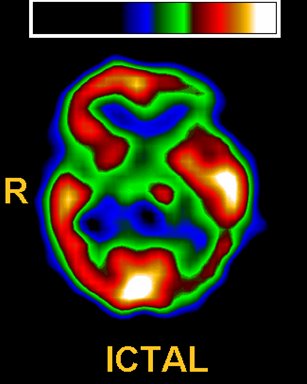
Durante el período ictal, el flujo sanguíneo regional puede aumentar en el foco epileptogénico hasta 300%, en relación con el flujo basal; puede haber propagación hacia el lóbulo temporal contralateral, generalmente de menor intensidad y extensión; y puede haber compromiso de la ínsula y el lóbulo frontal basal ipsilateral. En la Fig. 9 en un corte transversal de un estudio de SPECT cerebral ictal: se observa marcada hiperperfusión temporal mesial izquierda, con propagación a la corteza lateral e hiperperfusión de los ganglios basales ipsilaterales; se aprecia, además, una zona de hipoperfusión en la periferia, en este caso localizada en corteza frontal ventrolateral y temporal lateral posterior.
 Tamaño completo
Tamaño completo Figura 9. Período ictal. Flujo sanguíneo regional
En el caso de la Fig. 10 se realizó una sustracción del estudio ictal menos el basal; la diferencia se fusionó sobre la imagen de RM del mismo paciente. Se puede observar una marcada hiperperfusión ictal temporal mesial derecha, con propagación hacia la corteza lateral, al polo anterior y a los núcleos basales de ese lado. La hiperperfusión de los ganglios de la base se asocia con posturas distónicas del miembro superior contralateral.
 Tamaño completo
Tamaño completo Figura 10. Período ictal. Sustracción ictal-basal fusionado sobre RM
En el período post-ictal inmediato hay una marcada disminución del flujo y del metabolismo, de mayor magnitud que la que se observa en el período inter-ictal. El inicio y duración de este período no se pueden definir a partir de parámetros clínicos y presentan gran variabilidad interindividual. Como ya se mencionó, en la periferia del área de hiperperfusión existe un halo de hipoperfusión. En el período post-ictal, este halo de hipoperfusión domina y puede extenderse ampliamente al hemisferio ipsilateral y al lóbulo temporal contralateral; si persiste hiperperfusión, ella está limitada a la región anteromesial del lóbulo temporal afectado.
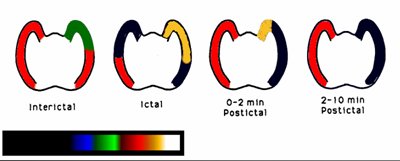
En el esquema de la Fig. 11 se grafican los cambios de la perfusión cerebral regional, durante la evolución de una crisis epiléptica. En el período inter-ictal hay una leve hipoperfusión temporal mesial del polo anterior, la que puede propagarse a la corteza lateral; en el período ictal se presenta una marcada hiperperfusión de estas estructuras, rodeadas de un halo de hipoperfusión de mayor intensidad; en el período post-ictal inmediato se origina una disminución marcada de la perfusión del lóbulo afectado y puede quedar un área de mayor perfusión en la región temporal mesial. Posteriormente se aprecia hipoperfusión profunda de todo el lóbulo afectado.
 Tamaño completo
Tamaño completo Figura 11. Patrón de perfusión ictal: Secuencia de cambios durante una crisis epiléptica en epilepsia del lóbulo temporal
En series publicadas, con más de 500 pacientes con epilepsia del lóbulo temporal unilateral demostrada, se ha encontrado que el SPECT ictal localiza correctamente el foco epileptogénico en más de 90% de los casos y en menos de 5% lateraliza en forma incorrecta. En series realizadas con inyección post-ictal, con un promedio de administración del radiofármaco de cuatro minutos post-crisis, la sensibilidad es 70% y la lateralización incorrecta es menor de 5%.
Otras epilepsias focales
La epilepsia parcial intratable puede surgir fuera del lóbulo temporal y, en ausencia de una lesión estructural, su localización es difícil. En estos casos, los estudios funcionales con SPECT y PET pueden ser de utilidad para localizar los focos de hipometabolismo o de hiperperfusión. En un metaanálisis realizado en 241 pacientes con epilepsia neocortical, a quienes se estudió con PET y RM, se demostró 67% de focos de hipometabolismo significativos usando PET y 47% de lesiones usando RM.La Fig. 12 corresponde al estudio de un paciente con epilepsia refractaria extratemporal. Se observa un foco de hiperperfusión ictal en la región parieto-occipital izquierda; el estudio anatómico con RM fue normal.
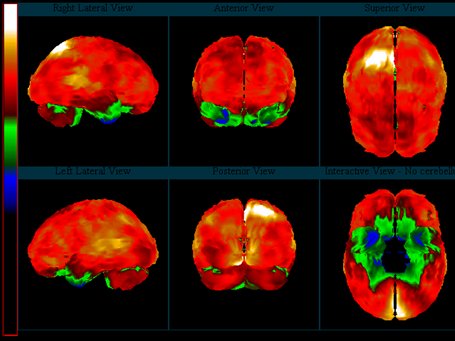 Tamaño completo
Tamaño completo Figura 12. Epilepsia refractaria extratemporal: Foco de hiperperfusión ictal parietal derecho
En un estudio realizado en 117 casos de epilepsias extratemporales, la RM encontró alteraciones relevantes en 60%, el PET en 78% y el SPECT ictal, en 70%. La epilepsia del lóbulo frontal se asocia con hiperperfusión ictal de los ganglios basales ipsilaterales y del hemisferio cerebeloso contralateral. En la epilepsia de origen parietal, la hiperperfusión de la región parietal anterior se asocia con manifestaciones sensorio-motoras, y la hiperperfusión de la región posterior con crisis psicoparéticas, es decir, con mirada fija e inmovilidad.
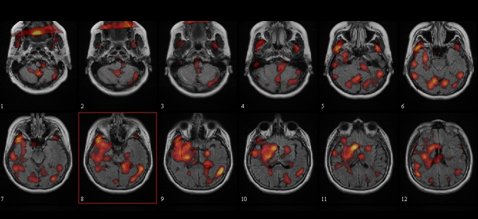
En la Fig 13 se muestra el estudio de un paciente de cinco años de edad, con crisis simples de la hemicara derecha y una lesión fronto-parietal izquierda, debida, presumiblemente, a la instalación de un drenaje subdural cuando tenía seis meses de edad. En el estudio de perfusión basal se observa un área focal de hipoperfusión, que en el estudio post-ictal resulta más marcada y más extensa; en el estudio ictal se aprecia aumento de perfusión de la periferia de la lesión; el estudio post-ictal fue inyectado dentro del primer minuto de iniciada la crisis. Este caso demuestra que los cambios de perfusión son muy rápidos en las crisis extratemporales.
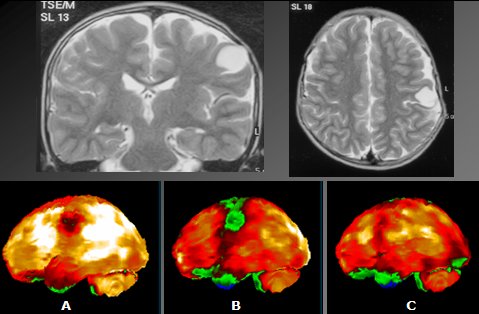 Tamaño completo
Tamaño completo Figura 13. Epilepsia refractaria extratemporal. A. Basal B. Post-ictal C. Ictal
En las epilepsias occipitales es frecuente la propagación hacia uno de los lóbulos temporales, o ambos; para identificar el foco de origen se requiere una inyección muy temprana. En un estudio efectuado en 17 casos de epilepsia occipital, el PET identificó el foco en 60% de ellos y el SPECT ictal, en 29%; en 76% se identificó el lado con hiperperfusión ipsilateral, especialmente en el lóbulo temporal. En la Fig. 14 se muestra la reconstrucción tridimensional de la RM de un paciente con epilepsia occipital; en azul, la sustracción de la imagen ictal menos la basal, con localización de un foco en la región parieto-occipital izquierda, el que se propaga hacia la corteza lateral del lóbulo temporal ipsilateral.
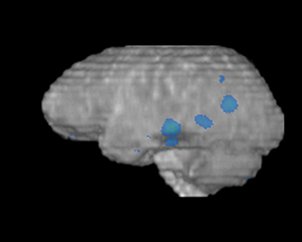 Tamaño completo
Tamaño completo Figura 14. Epilepsia refractaria occipital y propagación temporal. Sustracción ictal-basal fusionada con RM
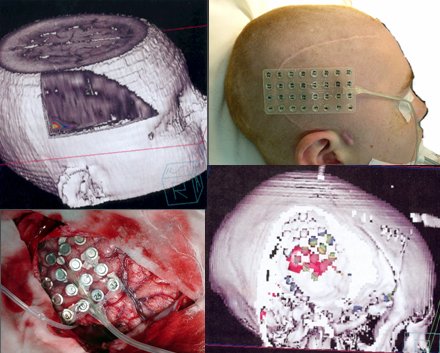
Otro caso que ilustra la utilidad del co-registro de los estudios funcionales con estudios neuroanatómicos, como RM y tomografía axial computada (TC), es el de un paciente previamente operado de epilepsia del lóbulo temporal derecho, que recidivó con un foco fronto-temporal de ese lado. En el estudio de perfusión se identificó un área de hiperperfusión ictal al realizar la sustracción ictal menos la basal, que se muestra en el panel superior como un foco de color amarillo. Se realizó una reconstrucción tridimensional de la imagen de RM, que sirvió para guiar la posición de los electrodos subdurales, los cuales aparecen en el panel inferior. En la imagen de TC se realiza un control con los electrodos in situ, que se proyectan sobre el foco de hiperperfusión ictal (foco color blanco rodeado de halo rojo) (Fig. 15).
Medwave. Año VII, No. 10, Noviembre 2007. Derechos Reservados.
Las crisis gelásticas se caracterizan por risa ictal y normalmente se originan por hamartomas hipotalámicos. El SPECT ictal puede mostrar hiperperfusión en el hamartoma, pero la propagación cortical puede confundir la interpretación.
En epilepsias generalizadas no se ha identificado anormalidades características; los estudios funcionales pueden demostrar una anormalidad focal insospechada. El estudio metabólico con fluordeoxiglucosa ha demostrado un aumento generalizado del metabolismo durante las crisis de ausencia.
Figura 17. SPECT en paciente epilepsia parcial continua
 Tamaño completo
Tamaño completo La epilepsia parcial continua puede deberse a muchas causas, como infartos o alteraciones metabólicas; el SPECT muestra hiperperfusión focal, aun en pacientes con EEG de superficie normal. El caso de la Fig. 17 es un paciente que presenta crisis caracterizadas por clonías permanentes de la mano derecha. El estudio con SPECT muestra un foco pequeño de hiperperfusión en la región fronto-parietal izquierda.
Figura 16. SPECT en síndrome de Rasmussen
 Tamaño completo
Tamaño completo Otras epilepsias
Las epilepsias intratables neonatales y del lactante tienen mal pronóstico y contribuyen al deterioro neurológico progresivo de estos pacientes. Estudios metabólicos con fluordeoxiglucosa PET serían sensibles a la detección de pequeños focos de desorganización neuronal; las resecciones basadas en estudios metabólicos con PET y electrocorticografía se pueden asociar a una mejoría neurológica importante y control de las crisis. Algunos niños con espasmos infantiles presentan focos hipermetabólicos y anormalidades focales al EEG; las resecciones guiadas por PET y EEG permiten que hasta 75% de los casos permanezcan sin crisis y muchas veces presenten mejoría importante en el desarrollo neurológico.El síndrome de Lennox-Gastaut se caracteriza por crisis secundariamente generalizadas en la infancia, convulsiones frecuentes intratables, retardo mental y un EEG característico. Los estudios funcionales con SPECT y PET han encontrado múltiples tipos de alteraciones, tanto focales como difusas, y en otros casos no se identifican anormalidades; en ausencia de lesión estructural, lo más frecuente es hipometabolismo difuso. En algunos centros se han realizado resecciones guiadas por PET y EEG cuando hay anormalidades claramente focales. El PET también puede servir para guiar callosotomías o hemisferectomías cuando hay compromiso metabólico de un solo hemisferio.
El síndrome de West se asocia a cambios difusos en el SPECT ictal, en la mayoría de los casos, pero en 30% de ellos puede haber hiperperfusión cortical focal. En pacientes con epilepsias catastróficas y hemiparesia contralateral se pueden realizar hemisferectomías; si las anormalidades de perfusión y metabolismo se limitan al hemisferio afectado, es un muy buen índice de resultado quirúrgico favorable.
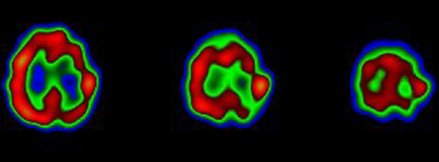
El síndrome de Rasmussen es una enfermedad infrecuente de la infancia. Se presume de origen viral y se caracteriza por epilepsia parcial intratable, hemiparesia progresiva y atrofia de un hemisferio cerebral. El único tratamiento es la hemisferectomía. El SPECT puede mostrar hipoperfusión focal, lo que puede servir para guiar la biopsia. En este caso se observa una marcada disminución de tamaño y de perfusión del hemisferio derecho, en un paciente con síndrome de Rasmussen (Fig. 16).
Figura 15. Recidiva epilepsia refractaria temporal
 Tamaño completo
Tamaño completo