Congresos
← vista completaPublicado el 1 de octubre de 2001 | http://doi.org/10.5867/medwave.2001.10.761
Diagnóstico molecular y aproximación clínica del hiperaldosteronismo primario
Molecular diagnosis and clinical approach of primary hyperaldosteronism
Resumen
Este texto completo es la trancripción editada y revisada de la conferencia dictada en la XIV Reunión Científica de la Sociedad Interamericana de Hipertensión, 25-29 de marzo de 2001, Santiago.
Editora Científica: Dra. Gloria Valdés.
Introducción
Al analizar el diagnóstico molecular y las consideraciones clínicas en el aldosteronismo primario, he decidido no mirar hacia el pasado sino hacia el futuro. Se presentarán algunos posibles genes candidatos y se intentará rescatar algunos aspectos que se vienen pasando por alto desde hace 30 ó 40 años, a pesar de que todos conocen su existencia.
En la presente exposición se tratarán tres temas: la frecuencia y aproximación diagnóstica actual, la diferenciación entre diferentes tipos y la aproximación experimental para el estudio fisiopatológico de la forma más común, que es la hiperplasia bilateral de la zona glomerulosa.
Tamizaje (screening)
Originalmente, Cohn estimó que 20% de los pacientes con hipertensión tenían hiperaldosteronismo primario, lo cual se explica, probablemente por un factor de selección, ya que él era uno de los pocos en el mundo que podía medir aldosterona. Luego se dijo que era muy raro, y que había más investigadores que pacientes con aldosteronismo primario.
Un estudio que se realizó en 1983 demostró, sorprendentemente, que era muy probable que Cohn tuviera razón, ya que se encontró que 7% de los pacientes tenían aldosteronismo primario. Más tarde, en muchas regiones del mundo y de una manera casi uniforme, se demostró claramente que esta enfermedad es bastante común y que entre 7 y 10% de los pacientes con hipertensión esencial tienen hiperaldosteronismo primario, el que constituye la causa más frecuente de hipertensión secundaria en esta etapa. Esto ocurrió debido a la evolución de los criterios de medición. En el pasado, o no se buscaba o se usaban criterios muy poco sensibles que detectaban pocos casos, como la actividad de renina plasmática suprimida y la excreción aumentada del metabolito de la aldosterona, medido a nivel urinario en pacientes con hipertensión e hipokalemia.
Después se utilizó infusión salina para comprobar supresión y, finalmente, reconociendo datos que habían estado disponibles por muchos años, publicados por muchos autores, un grupo japonés simplemente dividió la aldosterona plasmática por la renina (razón aldosterona plasmática/renina) y comprobó que, en los pacientes con hiperaldosteronismo primario, esta razón está alterada debido a que la primera aumenta y la segunda está suprimida. Por último, una prueba que daba la misma información, pero que era más complicada, consistía en cargar al paciente con sodio, además de darle fludrocortisona para retener el sodio, con lo que se supone que se suprime la aldosterona.
Los criterios de tamizaje que hoy se recomiendan se basan en medir aldosterona y actividad de renina en plasma, y, si la razón es mayor de 30 y la aldosterona está algo elevada, significa que existe una alta probabilidad de tener la enfermedad. Si la razón está entre 9 y 16, aún existe una posibilidad. Finalmente, si la razón es baja, es poco probable, ya que la razón depende en gran medida de los niveles de renina.
En último término, para confirmar el diagnóstico de hiperaldosteronismo se recomiendan dos métodos distintos: en uno simplemente se administra fludrocortisona y dieta rica en sodio. La alternativa, que muchos grupos usan porque es fácil, aunque falla en algunos pacientes, consiste en administrar gran cantidad de sal y luego medir la aldosterona urinaria; si ésta es mayor de 12 microgramos en 24 horas, se confirma que el paciente tiene un hiperaldosteronismo primario.
Clasificación
Existen diferentes tipos de hiperaldosteronismo primario, que en general corresponden a pacientes que tienen un adenoma de diferentes tipos o a pacientes que tienen una hiperplasia bilateral de la zona glomerulosa, que son las causas más comunes. Hay variaciones menores y causas raras, que no se abordarán en este momento.
Un tipo que suscita un tremendo interés en la actualidad es el aldosteronismo que responde a glucocorticoides, que es probablemente la primera forma monogénica de hipertensión.
La incidencia se puede apreciar muy bien en la información que entrega Young, de la Clínica Mayo. Entre 1955 y 1985, sólo había alrededor de 9 casos al año. En su gran mayoría, eran adenomas y 98% de ellos eran hipokalémicos. Cuando empezaron a usar la razón aldosterona/renina se reconocieron unos 120 casos al año y la gran mayoría de ellos tenían hiperplasia. En otras instituciones, la incidencia de hiperplasia se acerca a 95%. Esto depende de cuán leve sea la enfermedad cuando se reconoce una forma o la otra.
Histología en el hiperaldosteronismo primario
A comienzos de la década del 60 apareció la descripción de un estudio histológico de 153 glándulas suprarrenales extraídas de pacientes con aldosteronismo primario realizado por Neville, en el cual se encontraron tres tipos de cambios morfológicos: tumores, nódulos o hiperplasia. En los pacientes clasificados como portadores de tumor se encontró que la forma más común era el adenoma suprarrenal, en el cual el resto de la glándula tenía hiperplasia. Otros tenían un adenoma suprarrenal y no sólo tenían hiperplasia del resto de la glándula, sino que también otros nódulos, generalmente micronódulos, pero algunos parecían macronódulos. Por último, los carcinomas eran raros. De los pacientes que tenían hiperplasia, algunos sólo tenían hiperplasia, otros tenían hiperplasia con micronódulos y otros tenían hiperplasia con micro y macronódulos; por último, algunos sólo tenían micronódulos (Cancer 1966; 19:1854-68).
Aproximación al hiperaldosteronismo
Para saber si un paciente que tiene un adenoma, nodular o no, tiene variaciones histológicas menores en su superficie, una forma es buscar la clonalidad de la hiperplasia con los nódulos, entre el adenoma versus los nódulos. Los que tienen adenoma tienden a ser monoclonales; en cambio, los que tienen hiperplasia tienden a ser policlonales en el origen de las células.
Es importante distinguir esto, porque si a un paciente con adenoma se le extrae la glándula suprarrenal, se curará bioquímicamente desde el punto de vista de la hipertensión. En cambio, en un paciente con hiperplasia se puede lograr la mejoría bioquímica al extraer ambas glándulas suprarrenales; con esto, obviamente, se obtendrá un individuo hipoadrenal, pero la hipertensión generalmente no mejorará mucho.
Los métodos de estudio evolucionaron desde la toma de muestra en vena de glándula suprarrenal, que era técnicamente muy difícil, hasta la tomografía axial de la glándula, que era muy costosa y poco sensible para diagnosticar hiperplasia versus adenoma. En la tomografía suprarrenal, que se usó durante muchos años, la pesquisa de un tumor a un lado originaba el diagnóstico de un adenoma, pero luego se vio que muchas veces en realidad se trataba de un nódulo que parecía un tumor en una de las glándulas suprarrenales.
Muestra de la vena adrenal
Hoy se ha vuelto a emplear la toma de muestra de vena adrenal. En teoría, la mejor manera de hacerlo es poniendo catéteres en ambas venas adrenales para recolectar la aldosterona y medir aldosterona y cortisol con el fin de asegurarse de que se trata de la vena adrenal. En las instituciones que están aplicando este método en forma permanente, el porcentaje de éxito, especialmente en la suprarrenal derecha, que es dificíl, es del orden de 95%; en cambio, en instituciones que no tienen tanta experiencia, el éxito se aproxima a 10%, por lo que el método no es muy útil, desde este punto de vista, simplemente debido a problemas técnicos. Sin embargo, mientras más se realiza más va mejorando, especialmente si queda a cargo de un solo operador, lo que no ocurre cuando, en una institución, 10 personas hacen un procedimiento cada una y nadie aprende con él.
En un caso descrito por Young se vio que la aldosterona en el lado afectado estaba claramente elevada y que en el lado no afectado no lo estaba; sin embargo, sí estaba aumentada en comparación con la vena cava inferior, es decir que esa glándula suprarrenal aún estaba produciendo aldosterona, a pesar de que supuestamente estaba suprimida por el lado contralateral. Esto es muy importante.
Desde el punto de vista de la concordancia, en un estudio recién publicado por Magill del grupo de Milwaukee, se describen 15 pacientes con adenoma suprarrenal, de los cuales ocho tienen hallazgos concordantes por tomografía computarizada y la muestra suprarrenal bilateral. Cuatro presentaron resultados discordantes (tumor a un lado y la aldosterona elevada proviene del lado opuesto) y tres tienen escáner normal, pero se pueden localizar con muestra venosa. En 21 pacientes con hiperaldosteronismo idiopático, cuatro tenían hallazgos concordantes, pues el escáner indicaba hiperplasia y ellos obtuvieron secreción desde ambos lados. En ocho casos había resultados discordantes: parecía que tenían un adenoma, pero en realidad tenían hiperplasia; y nueve tenían escáner normal. O sea, en 68% de los pacientes la información por escáner fue inexacta o nula, lo que no significa forzosamente que el escáner no sirva para tomar una decisión terapéutica (J Clin Endocrinol Metab 2001;86:1066-71).
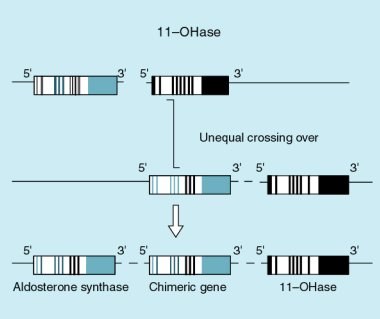
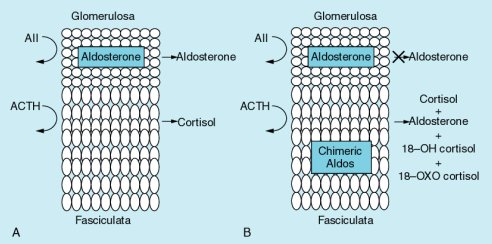
Es importante destacar que según datos publicados por Mosso y Fardella (J Clin Endocrinol Metab 2000;85:1863-7), en una proporción significativa, los pacientes con hiperplasia parecen responder a dexametasona y no tienen el gen quimérico propio de la forma genética de hiperaldosteronismo que responde a glucocorticoides (Figura 1, 2). El mecanismo de este fenómeno es totalmente desconocido, pero es bastante común. Un número significativo de pacientes han permanecido normotensos después de recibir una pequeña dosis de dexametasona durante largos períodos, lo que indica que ésta es una forma de alternativa cuya patogénesis no conocemos.
 Tamaño completo
Tamaño completo Figura 1. Gen quimérico de aldosterona sintetasa que responde a ACTH.
 Tamaño completo
Tamaño completo Figura 2. Localización de la síntesis normal de mineralocorticoides, y alteración de ésta en presencia del gen quimérico.
En uno de los estudios realizados por Gordon, cirujano del grupo de Brisbane (World J Surgery 1998;22:1243-5), se tomó a un grupo de pacientes con adenoma clasificados con muestra de vena adrenal antes y después de ser sometidos a cirugía, y se comprobó que había dos tipos de pacientes: unos que curaron su hipertensión y otros que sólo mejoraron el control de presión. Antes de la cirugía todos presentaron supresión después de fludrocortisona y una cantidad máxima de sal. Después de la cirugía, en la que se extirpó la glándula suprarrenal con el adenoma, repitieron la prueba de supresión con fludrocortisona. En los pacientes que curaron su hipertensión la supresión fue totalmente normal a los tres días de fluorhidrocortisona y sal. En los que mejoraron, los niveles de secreción y los niveles serológicos disminuyeron significativamente, pero no se pudieron suprimir con fluorinef. Esto indica que estos individuos en realidad tenían hiperplasia, pero parecía que tuvieran un nódulo dominante que producía la mayor parte de la aldosterona, cuya extirpación redujo la secreción a niveles en los cuales es poco probable que se produzca hiperaldosteronismo primario. Es casi lo mismo que ocurre en el bocio multinodular, en el que puede existir un marcado crecimiento de la glándula, pero puede haber un nódulo que secreta la mayor parte de la hormona tiroidea y produce el hipertiroidismo. Cuando se reduce ese nódulo o se daña con yodo radioactivo, el resto de la glándula “despierta” y el paciente permanece normal, pero hay diversos clones que secretan una excesiva cantidad de hormona tiroidea, en este caso de aldosterona, y entonces el síndrome recidiva más adelante. Al analizar en esta población los niveles de renina plasmática se puede apreciar que con la cura la renina tiende a aumentar significativamente más, pero en realidad no se puede diferenciar entre las dos poblaciones debido a que existe una sobreposición significativa.
En 33 pacientes que curaron su hipertensión (49% del total), alrededor de 38% no curaron bioquímicamente. Es probable que estos pacientes, en su mayoría, tuvieran hiperplasia y simplemente tenían un nódulo dominante; por esta razón, la tomografía computarizada podría ser útil, ya que aunque se pudiera perder el diagnóstico en algunos pacientes, hay que considerar que muchos operadores no tienen la habilidad para hacer un muestreo bilateral, por lo que el diagnóstico por imágenes podría ser suficientemente preciso en la gran mayoría de los casos.
Causas genéticas de la hiperplasia bilateral
Muchos han investigado las posibles causas genéticas de la hiperplasia bilateral de la zona glomerulosa y han buscado polimorfismos del gen de la sintetasa de aldosterona humana, pero ha sido como la democracia: se ha realizado en múltiples partes del mundo y se han obtenido diferentes resultados, de modo que, en términos prácticos, hasta ahora ha resultado inútil (algunas personas pueden estar en desacuerdo).
Una hipótesis que se mencionó anteriormente es que la mayoría de los pacientes con aldosteronismo primario tienen hiperplasia bilateral de la zona glomerulosa, con nódulos dominantes que se comportan como si se tratara de un adenoma y, al extirparlos, el mecanismo que regula la secreción de aldosterona permanece anormal.
A nivel experimental, hemos desarrollado estudios con anticuerpos monoclonales contra la sintetasa de aldosterona, que se encuentra sólo en la zona glomerulosa, y contra la 11- beta-hidroxilasa, que se encuentra sólo en la zona fasciculada. Se ha comprobado en ratas que, al administrar una dieta normal en sodio, la sintetasa de aldosterona sólo presenta reactividad en alrededor de 25 a 30% de las células de la zona glomerulosa. Si la rata recibe una dieta baja en sodio, 100% de las células expresan la sintetasa de aldosterona. Si se le da cloruro de sodio al 1%, lo que corresponde a cantidades industriales de sodio, durante un mes, se ven algunos nidos de células que nunca suprimen la producción de aldosterona. A partir de esto se deduce que existen diferentes clones de células dentro de la glándula suprarrenal normal, las que poseen diferentes sensibilidades frente a la supresión por sal. Una de las hipótesis plantea que, en la hiperplasia de la zona glomerulosa, la predominancia de una zona en la cual no se puede suprimir la aldosterona terminará en una excesiva producción de aldosterona. Aproximadamente 10 a 15% de las células no se pueden suprimir con grandes cantidades de sal.
Volpe, en Italia, publicó un modelo animal potencial; en éste, ratas espontáneamente hipertensas susceptibles de accidente vascular encefálico (SHRSP), se compararon con ratas hipertensas no susceptibles (SHR) y con ratas normotensas (WKY). Los tres grupos recibieron una dieta alta en cloruro de sodio (4%) y fueron sometidos a análisis del balance de sodio y de parámetros hormonales. Las SHRSP sufrieron un marcado descenso en la natriuresis frente a la carga de sodio, en comparación con las SHR o WKY. La actividad de renina plasmática resultó suprimida significativamente en la misma magnitud, en los tres grupos, lo mismo que las concentraciones plasmáticas de aldosterona. Sin embargo, se observó una supresión de la aldosterona en las SHRSP en menor grado que en las otras dos cepas, Se concluyó, pues, que las ratas SHRSP tienen un impedimento para la supresión de la aldosterona plasmática y una excreción de sodio defectuosa frente a la ingesta de altas cantidades de sal (J Hypertens 1993;1:793-8). Al analizar la expresión del gen de sintetasa de aldosterona en la glándula suprarrenal, se puede ver que en estas ratas hay un incremento en la expresión de la sintetasa de aldosterona. Este puede ser un modelo animal de hiperplasia bilateral de la zona glomerulosa, muy útil para estudiar esto.
Una aproximación diferente ha utilizado técnicas de hibridación por sustracción y “display” diferencial de RNA, con la hipótesis básica de que si hay un aumento en clones o si hay una hiperplasia en la glándula adrenal, debe de haber genes que están disregulados. Es muy probable que se trate de genes que normalmente están regulados por condiciones bajas en sodio, y que sólo se desrregulan en condiciones patológicas. Con estas técnicas, que producen genes expresados diferencialmente, se han buscado genes que se expresan sólo en la zona glomerulosa, que están regulados hacia arriba o hacia abajo.
Hasta el momento hemos encontrado una serie de nuevos genes, algunos de los cuales ya se conocían pero que habían sido escasamente estudiados, como por ejemplo el de la fosfodiesterasa 2, que sólo se expresa en la zona glomerulosa. Es una fosfodiesterasa 2 estimulable por GMP cíclico, cuyo papel exacto no está aclarado. Otro hecho sorprendente fue que en la rata había genes inducidos por interferón parecidos a genes humanos presentes principalmente en linfocitos, a los que se debe la diferenciación linfocítica. Nosotros hemos encontrado dos genes más que son equivalentes en la rata, rat 10 y rat 16, y los humanos tienen además tres genes distintos. Por último, otro gen es el RGS-4, que sirve para mostrar la inmunorreactividad principalmente en la zona glomerulosa y en la médula, y parece que se regula por el ancho de la zona glomerulosa, ya que cuando ésta disminuye, aquél decrece.
El RGS-4 es regulador de la señal de proteína G. Hoy en día se han descrito más de 20 tipos de reguladores de la señal de proteína G, los que actúan, básicamente, estimulando la hidrólisis de GTP del complejo primario, para que éste pueda asociarse nuevamente y disminuir la cascada de señalización de la célula adrenal. Uno de los genes más sorprendentes que se han encontrado en la zona glomerulosa y también en la médula es RGS-4, que previamente se había encontrado en el cerebro, por hibridación in situ está clara y fuertemente expresado en la zona glomerulosa, y menos fuertemente en la médula. Por Northern Blot se expresa principalmente en la zona glomerulosa, y mediante análisis de protección de ribonucleasa en dieta baja en sodio hay un marcado aumento en la expresión de RGS-4. Actualmente estamos estudiando las amplias funciones biológicas que puede haber en la glándula suprarrenal y los efectos que podría tener allí.
El otro gen que hemos encontrado es el MIA, actividad inhibitoria de melanoma, encontrado por otro grupo como factor diferenciante de condrocitos, que fue aislado independientemente. Inhibe el crecimiento del melanoma y no se sabe muy bien por qué no inhibe el de los condrocitos. Es un péptido pequeño que también es altamente expresado en la zona glomerulosa y no en la zona fasciculada.
Conclusión
En resumen, el hiperaldosteronismo primario es muy común, aunque muchos clínicos lo dejan pasar inadvertido, más bien por inercia.
La mayoría de los pacientes tienen hiperplasia bilateral de la zona glomerulosa. Algunos de ellos se comportan como adenomas y se corre el riesgo de tratarlos como tales si no se tienen los medios para hacer el diagnóstico de certeza. Esta situación, lamentablemente, ocurre en muchos lugares. Es fácil comprender por qué la extracción de la glándula suprarrenal con zona glomerulosa bilateral mejora la anormalidad metabólica; sin embargo, se desconoce por qué no se logra la normalización de la presión arterial.
Por último, los factores que influyen en el crecimiento autónomo de la zona glomerulosa y en el incremento de la expresión de enzimas aldosterogénicas son todavía desconocidos. Además de los genes que se han identificado hasta el momento, hay 16 genes más en el muestreo diferencial, la mitad de ellos conocidos, muchos de ellos con participación en la reparación del ADN. De algunos de ellos sólo sabemos que están en el genoma humano. Estos serán el foco de investigación en nuestro laboratorio en los próximos años.

