Cursos
← vista completaPublicado el 1 de marzo de 2003 | http://doi.org/10.5867/medwave.2003.02.3181
Radiobiología y cinética celular aplicada al fraccionamiento del cáncer de próstata (parte 1)
Radiobiology and cell kinetics applied to the fractionation of prostate cancer (part 1)
Resumen
Este texto completo es la transcripción editada y revisada del Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la Universidad de Chile entre el 3 de abril y el 7 de agosto de 2002. Editor Científico: Dr. José Manuel Ojeda.
La disciplina de la radioterapia se ha formado en base a estudios clínicos y una base empírica al contrario de otras disciplinas que se basaron desde su comienzo en las ciencias básicas de donde se comenzaron a aplicar los nuevos principios y descubrimientos a la medicina.
Así por ejemplo a principio de 1900 los tratamientos de radioterapia se daban en una fracción o en pocas fracciones, luego se comenzaron a usar más de una fracción, no porque esto se supiera que era más beneficioso para el paciente, sino que, porque los tubos de rayos X de ese periodo se calentaban demasiado al dar una gran dosis de una sola vez.
Así se descubrió de forma empírica que al fraccionar la radiación se podía evitar las reacciones tardías de los tejidos sanos beneficiando al paciente con el fraccionamiento.
Esto se demostró con los experimentos realizados en las décadas de los 20 y 30 en París, donde los cabreros no podían ser esterilizados con una fracción de radiación sin causar gran daño a la piel del escroto, de lo contrario al fraccionar la radiación en el tiempo se podía esterilizar al cabrero sin dañar la piel. Los testículos se compararon como un modelo tumoral y la piel como los tejidos normales que limitan la dosis. (Figura 1)
 Tamaño completo
Tamaño completo Figura 1.
Tampoco se sabía como actuaba la radiación, sus consecuencias, ni los daños que podía producir con el tiempo.
Desde los años 40 en adelante, aparecieron fórmulas matemáticas en un esfuerzo de comparar los distintos tipos de fraccionamiento y tratamientos que para aquella época eran de una gran heterogeneidad. Así aparecieron las curvas de isoefecto (Strandquist 1944), la dosis nominal estándar NSD (Ellis 1971) y la ecuación linear cuadrática (Fowler 1980) entre otras.
Se determinó que la fracción estándar para muchos tumores es de entre 1,8 y 2,0 Gy, dado que en estudios clínicos se utilizaron, obteniendo un porcentaje de curación aceptable con relativamente pocas secuelas y complicaciones. También se determinó que el fraccionamiento convencional de dar una fracción al día por 5 días a la semana era el más óptimo, no por que se hubiera comparado a otros esquemas, sino por la comodidad de irradiar al paciente una vez al día y evitando los fines de semana con la obtención de buenos resultados.
Sin embargo esto se tomó casi como un dogma, siendo la fracción de 1,8 y 2,0 Gy la que debe usarse de preferencia y en la que se comparan todos los demás tratamientos.
Así incluso algunos autores proclamaron sus leyes, como la de Whiters: “Ocupa la dosis total más alta sin causar efectos tardíos severos, usando dosis pequeñas por fracción como 1,8-2.0 Gy, para lograr mantener los efectos tardíos moderados, en comparación con la muerte celular del tumor; y entrega esta dosis en el menor tiempo total que puedas sin causar efectos agudos severos”.
Base radiobiológica
Se ha postulado que los blancos celulares de la radiación podrían ser las proteínas, las membranas (celular, nuclear, organelos-mitocondrias) y la molécula de ADN.
El efecto principal estaría representado por el daño al ADN, donde la radiación por un efecto físico, al expulsar electrones orbitarios, ioniza la materia, lo que produce una rotura de enlaces químicos, que a su vez, se traducirá en un efecto biológico, dependiendo de la molécula afectada. Para una determinada dosis de radiación, una cantidad específica de energía es depositada en las células, lo que resulta en daño ionizante para el ADN.
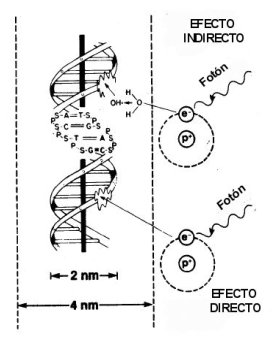
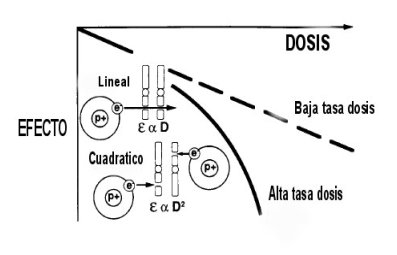
En el caso de radiaciones de baja transferencia lineal de energía, como los rayos X, este efecto ocurre de manera directa cuando se ioniza directamente la molécula de ADN y de manera indirecta al ionizar el agua, que es la molécula predomínate en los tejidos (Figura 2).De esta manera se producen radicales libres altamente reactivos que reaccionan con la molécula de ADN, produciendo roturas de enlaces químicos.
 Tamaño completo
Tamaño completo Figura 2.
Este efecto indirecto es el principal en las radiaciones que se usan en radioterapia, correspondiendo al 70 % del daño causado por la radiación, y el cual puede ser modificado por el oxígeno y algunos agentes químicos puesto que para que se produzcan radicales libre, se necesita la presencia de oxigeno o una molécula dadora de electrones (radiosensibilizadores). La radiación ionizante produce una amplia gama de lesiones dentro del ADN. De las lesiones producidas la que parece estar mas asociada a daño letal es la rotura de doble hebra. Hay una correlación entre él numero de roturas de doble hebra y eventos letales, pero esto no muestra cuales son las letales ni excluye la posibilidad de que otro tipo de lesiones contribuyan a la letalidad.
El daño en la molécula de ADN es susceptible de ser reparado si se mantiene la base complementaria. Si el daño ocurre en ambas hebras y en bases cercanas opuestas, el daño no puede ser reparado, produciendo un quiebre en la molécula, que será evidente en la fase M del ciclo celular, donde se visualizarán los cromosomas. Algunas de estas zonas “cortadas” tienen afinidad por juntarse con otra molécula de ADN (sticky end) formando así las aberraciones cromosómicas, al juntarse un trozo de cromosoma con otro.
De esta manera que cuando la célula intente duplicarse, sino puede reparar el daño genético, irá a apoptosis en G1si aun tiene su sistema P53 –Rb intacto, de lo contrario, continuará hasta fase M donde por las aberraciones cromósomicas letales inducidas por la radiación (dicéntrico, anillo, puente en anafase, Figuras 3, 4 y 5 respectivamente) morirá.
 Tamaño completo
Tamaño completo Figura 3.
 Tamaño completo
Tamaño completo Figura 4.
 Tamaño completo
Tamaño completo Figura 5.
Se considera que una célula está esterilizada cuando ya no puede replicarse, independientemente si está morfológicamente intacta.
Reparación del ADN
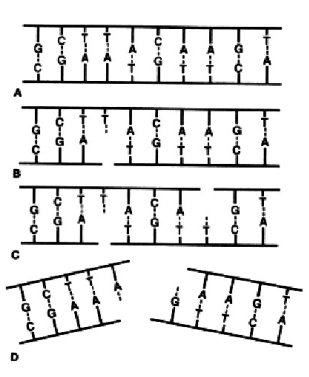
Las diferencias en la sensibilidad celular a la radiación depende de las diferencias en el procesamiento químico y biológico del daño producido, lo que se llama de manera colectiva reparación. La mayoría de las roturas de doble hebra (Figura 6 D) se vuelven a unir. Las lesiones que permanecen en el tiempo se deben a saturación del proceso de reparación, tiempo insuficiente para reparar, o una mala reparación. Se ha propuesto que la habilidad de reparación del ADN esta influenciada por la presencia de otras lesiones menores en la vecindad inmediata a la rotura de doble hebra. Sitios de daño local múltiple donde un racimo de ionizaciones ha causado un grupo de lesiones juntas, puede resultar en una gran posibilidad de perdida de material genético.
Hay varios mecanismos bioquímicos que pueden modificar la conversión de ionizaciones en daño biológico relevante. Por ejemplo, un efecto inmediato de la radiación es la perdida de átomos de hidrógeno de la molécula de ADN, esto se puede revertir rápidamente por moléculas dadoras de hidrógeno como aquellas que contengan grupos sulfhidros. Estas moléculas necesitarían tener acceso a los sitios de daño y necesariamente deberían ser lo suficientemente pequeñas o estar ya presentes junto al ADN.
La molécula de glutatión reducida, que es la molécula con grupos sulfhidro más abundante y la cistamina son posibles candidatos para mediar entre este tipo de radiorresistencia. Si estas modificaciones a la radiación ocurren fisiológicamente, debería esperarse una correlación entre los niveles de sulfhidro y radiorresistencia. Esto se ha encontrado en algunos casos pero no universalmente. Otro mecanismo de modificación bioquímica rápida al daño al ADN es el metabolismo enzimático de los productos de la radiolisis del agua. El peróxido de hidrógeno es generador de radicales hidroxilo, y convertido a agua más oxígeno por una catalasa, o a agua y un cosustrato deshidrogenado por las peroxidasas. Los radicales superóxidos son catalizados por una superóxido dismutasas. Así los niveles de estas enzimas pueden determinarla cantidad de daño al ADN.
Las células han desarrollado una amplia variedad de mecanismos de reparación para combatir los diferentes tipos de daño al ADN. Las vías de reparación parecen operar con cierta jerarquía:
- inversión del daño;
- reparación de la escisiones, para el daño confinado a una lesión de hebra única (Figura 6 B-C)
- reparación de lesiones de doble hebra mediante precombinación o uniones de término.
 Tamaño completo
Tamaño completo Figura 6.
Estos 3 mecanismos reparan toda la gama de lesiones, desde la más simple hasta la restauración de grandes lesiones complejas. Si la función de un componente es defectuosa, la reparación pasa al siguiente mecanismo en jerarquía.
Manifestación del daño biológico de la radiación
Debido a que el ADN es el principal blanco de la radiación, y que la muerte celular ocurre generalmente cuando esta se divide el daño de la radiación se manifestará de diferente manera y en tiempo diferente, en tejidos que se recambian rápido (piel, mucosas, medula ósea), con respecto a los de recambio tardío (tejido conjuntivo, endotelio, estroma de los órganos, riñón, pulmón SNC). Como en los tejidos de recambio rápido hay un alto índice de células en replicación, estas serán las que se mueran en ese instante por la radiación, evidenciando el efecto como mucositis, epitelitis, citopenias. Esto representa el efecto agudo de la radiación y se puede ver desde el comienzo del tratamiento hasta semanas de terminado. Por el contrario el efecto de la radiación en tejidos de respuesta tardía sólo se verá a medida que se vayan recambiando, ósea cuando se dividan las células, lo que se manifestará meses o años después de irradiado el tejido.
Los tumores en general, como tienen una proporción alta de clonogénicos en replicación, se comportan como los tejidos de recambio rápido.
Curvas de sobrevida
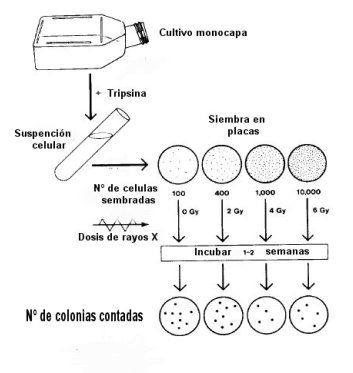
Por medio de experimentos a partir de un tumor o un tejido normal se puede obtener una suspensión de células aisladas al agregarles tripsina para separarlas.
Las células deben ser capaces de formar colonias visibles en una placa petri. De esta manera se siembra un cierto numero de células en una placa petri y se le va aplicando una dosis de radiación en forma creciente.
Luego de cada dosis de radiación se cuenta la cantidad de colonias que se forman frente a un control. Así con cada aumento de la dosis disminuye él numero de colonias (Figura 7). La fracción de células que sobrevive con cada dosis de radiación se gráfica semilogarítmicamente versus la dosis en una escala lineal, obteniéndose una curva de sobre vivencia celular versus dosis de radiación.
 Tamaño completo
Tamaño completo Figura 7.
Ecuación lineal cuadrática
Si los datos experimentales obtenidos con los cultivos celulares se grafican formarán una curva que se adapta a la ecuación:
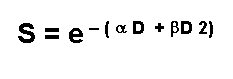 Tamaño completo
Tamaño completo En que S es la fracción de sobrevida, D la dosis de radiación, alfa y beta constantes.
Hay dos componentes de muerte celular, uno que es proporcional a la dosis alfaD y otro que es proporcional al cuadrado de la dosis betaD2
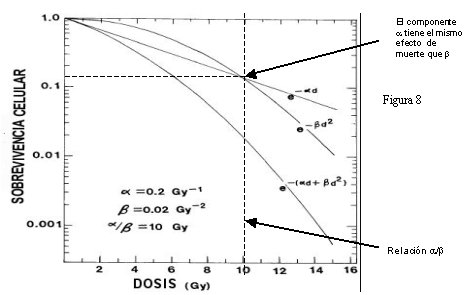
Alfa y beta son constantes para cada subcurva. La dosis en que ambos efectos son equivalentes se denomina relación alfa/beta (Figura 8). Cada tejido tiene su propia curva y propia relación alfa beta.
 Tamaño completo
Tamaño completo Figura 8.
El componente de muerte celular alfa se asocia a daño irreparable como las lesiones de doble hebra, por eso es lineal con la dosis, el componente beta se asocia con daño de hebra única que es posible de reparar, pero a medida que se acumula los mecanismo de reparación se saturan, siendo entonces la muerte celular función del cuadrado de la dosis, por eso a dosis bajas el componente beta no es de gran cuantía, pero a medida que se incrementa la dosis la curva comienza a doblarse y a tener mayor pendiente. Al juntar ambas curvas se obtiene la curva de la suma de ambos componentes lineal y cuadrático.
Si se considera a la braquiterapia de baja tasa de dosis como millones de fracciones de pequeña cantidad el componente beta siempre será reparado en su totalidad no influyendo en la muerte celular, de esta manera se puede obtener el componente alfa para esa línea celular. Si se usa radioterapia externa con fracciones más grandes parta la misma línea celular en estudio, habrá tanto un componente alfa y uno beta de muerte celular, ya que habrá una acumulación de daño con fracciones mayores para el componente beta que no podrá ser reparado. De esta manera se puede obtener la constante beta al restar el componente alfa, obtenido por medio de la braquiterapia, a la curva lineal cuadrática (Figura 9). La curva de la ecuación lineal cuadrática se curva continuamente por lo que no calza con los datos experimentales a dosis altas, pero si se adecua razonablemente a las primeras décadas de sobrevida celular.
 Tamaño completo
Tamaño completo Figura 9.
Los tejidos de recambio rápido y la mayoría de los tumores tiene un alfa/beta elevado (10 en promedio) siendo la curva de más pendiente, en cambio los tejidos de recambio lento tienen un alfa/beta pequeño (3 en promedio) siendo la curva de menor pendiente y con un “hombro en su inicio”.
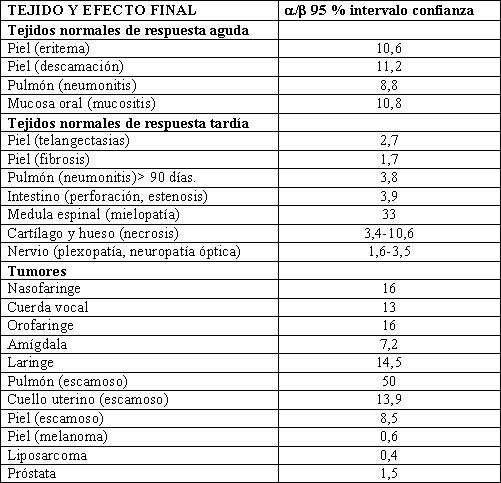
Algunas excepciones de tumores con alfa/beta bajo son los melanomas, los liposarcomas y últimamente se evidenció a los cánceres de próstata (Tabla 1).
 Tamaño completo
Tamaño completo Tabla 1. Relación alfa/beta para tejidos humanos normales y tumorales.
Base radiobiológica del fraccionamiento
Cuando una determinada dosis de radiación por ejemplo 4 Gy es entregada como dos fracciones separadas por varias horas (2Gy –2Gy) la curva de sobrevida es mayor que si la radiación se da en una sola fracción. Esto significa que entre ambas dosis hay reparación de daño subletal. Este daño subletal se repara con mejor calidad y cantidad en los tejidos sanos ya que las células tumorales tienen una inestabilidad genética en que pierden y a veces ganan propiedades, pero que globalmente su capacidad de reparación sería deficitaria en comparación a los tejidos normales. Esta es la gran ventaja que se obtiene al fraccionar la radiación permitiendo curar los tumores sin dañar los tejidos normales que los rodean.
Se ha determinado que el tiempo mínimo para que ocurra reparación entre dos fracciones de radiación es de 6 a 8 horas.
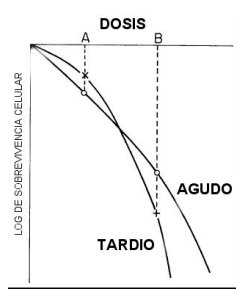
Cada tejido y tumor tiene su propia curva de supervivencia. En general los tumores y los tejidos de recambio rápido su curva tiene mayor pendiente al comienzo de la curva, en cambio los tejidos de recambio lento su curva tiene mayor hombro (menor pendiente) al comienzo de la curva y pendiente más pronunciada a fracciones mayores de radiación. Así puede obtenerse mayor ventaja usando fracciones pequeñas de radiación para proteger los tejidos de recambio lento afectando más al tumor que a estos. Por ejemplo en la Figura 10, al usar fraccionamiento con dosis A afecta mayormente a los tejidos de respuesta aguda (tumor), si se usan fracciones más grandes como en B el mayor daño lo reciben los tejidos de recambio lento que son los que van a producir complicaciones tardías graves. Esto también se puede analizar en la Figura 11, donde se comparan dos tratamientos, uno con fraccionamiento pequeño A y otro con fraccionamiento mayor B; la curva de cada tejido se va repitiendo en cada fracción hasta completar el tratamiento y la dosis total C, donde se aprecia la gran variación en los efectos tardíos con fracciones grandes, no siendo influenciados mayormente los tejidos de respuesta aguda (tumor), por un fraccionamiento mayor.
 Tamaño completo
Tamaño completo Figura 10.
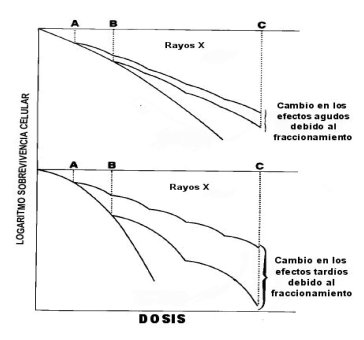 Tamaño completo
Tamaño completo Figura 11.

