Cursos
← vista completaPublicado el 1 de junio de 2007 | http://doi.org/10.5867/medwave.2007.05.3324
Coinfección de hepatitis B y C con VIH
Co-infection between hepatitis B and C with HIV infection
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Avances en Gastroenterología 2006, organizado por la Sociedad Chilena de Gastroenterología entre los días 8 y 11 de agosto de 2006.
Introducción
En esta presentación se van a entregar los siguientes mensajes:
- La terapia anti-retroviral altamente activa o HAART (Highly Active Anti-Retroviral Therapy) es un arma de doble filo para el hígado, ya que puede alterar su función.
- En la hepatitis B, siempre se debe considerar la interacción con el virus de la inmunodeficiencia humana (VIH).
- En la infección por el virus hepatitis C se debe considerar la toxicidad mitocondrial en el momento de tratar a un paciente.
- Es importante tener presente y manejar el concepto de la reconstitución inmune en pacientes coinfectados con los virus hepatitis B (VHB) y hepatitis C (VHC).
- El trasplante hepático es una opción posible en los pacientes VIH.
La mortalidad secundaria a patología hepática en pacientes VIH se redujo en forma muy importante luego de la introducción de la HAART, a mediados de la década de los 90, pero quedó en evidencia que la cirrosis asociada a la infección debida a VHC y VHB es un factor importante de mortalidad (1). Muchos estudios demuestran que, después de la introducción de HAART, el síndrome de inmunodeficiencia adquirida (SIDA) sigue siendo una importante causa de mortalidad, seguido por la cirrosis hepática, y que la enfermedad hepática terminal es la causa más frecuente de mortalidad en estos pacientes (Fig. 1).
Figura 1. Mortalidad en VIH.
En los pacientes con HAART mejora la mortalidad global, pero cabe preguntarse si son comparables con pacientes que reciben terapia anti-retroviral convencional o que no reciben tratamiento (2) (Fig. 2a). Se sabe, además, que la mortalidad hepática mejora en los pacientes tratados con la terapia anti-retroviral (Fig. 2b).
Figura 2a Efecto benéfico de HAART en mortalidad global.
Figura 2b Efecto benéfico de HAART en mortalidad hepática.
Sin embargo, aunque la HAART mejora la sobrevida, no muestra actividad específica contra el virus C y, por otra parte, puede causar hepatotoxicidad mediante los inhibidores de las proteasas, que son parte integral de muchos esquemas anti-retrovirales y causan un trastorno metabólico que se caracteriza por resistencia a la insulina, menor recaptación de glucosa, hiperlipidemia y esteatosis macrovesicular, todo lo cual puede llevar a fibrosis hepática. Por otro lado, el uso de los análogos de nucleósidos puede introducir el factor de toxicidad mitocondrial y esteatosis microvesicular, lo que puede aumentar aún más el desarrollo de fibrosis en estos pacientes (Fig. 3). La terapia anti-retroviral altamente activa disminuye la mortalidad general, pero produce un efecto negativo sobre el hígado: hepatotoxicidad, esteatosis, fibrosis y reconstitución inmune (Fig. 4).
Figura 3. Toxicidad crónica de HAART.
Figura 4. Impacto de HAART en el hígado.
Reconstitución inmune
Un efecto importante de la HAART es la reconstitución inmune (Fig. 5). Cuando se inicia esta terapia, el paciente presenta elevación de las transaminasas, lo que induce a creer que se está desarrollando hepatotoxicidad secundaria al esquema anti-retroviral, resistencia a los antivirales, esteatohepatitis o infecciones. Sin embargo, se debe recordar el concepto de reconstitución inmune: en la medida en que un paciente comienza con el tratamiento anti-retroviral, mejora la respuesta inmune y aumentan los CD4; por lo tanto, en la hepatitis C y B el daño hepatocelular, que está mediado inmunológicamente, comienza a ser más evidente, lo que se manifiesta por una elevación de las transaminasas, debido a mayor daño por necrosis o apoptosis. Un fenómeno que puede ser positivo para el paciente es que la reconstitución inmune puede llevar a la seroconversión, pero también puede llevar a la descompensación a un enfermo con fibrosis o cirrosis hepática.Figura 5. Reconstitución inmune.
Coinfección VHB y VIH
Si se hace un paralelo entre ambos virus: en el mundo hay 40 millones de personas infectadas con VIH y 400 millones, con VHB; VIH es un virus ARN y VHB, ADN; ambos virus se integran en el genoma; el VIH replica en los linfocitos CD4 y el VHB, en los hepatocito; ambos virus tienen una transcriptasa reversa, que es una polimerasa con un dominio dotado de actividad de transcriptasa reversa, la cual sirve de blanco terapéutico para los análogos de nucleósidos; ambos virus tienen la capacidad de producir mutaciones en los sitios activos de los análogos de nucleósidos, con el potencial de generar resistencia al anti-retroviral.Con respecto a la epidemiología, aproximadamente 10% de los pacientes con VIH son portadores crónicos de antígenos de superficie de hepatitis B (HBsAg). La prevalencia es variable y depende del factor de riesgo predominante en la población: es mayor en pacientes cuyo factor de riesgo principal es la homosexualidad. La cronicidad luego de la infección aguda es más frecuente en los pacientes coinfectados, en cuyo caso sube de 5% a 30%, aproximadamente. Por último, la enfermedad hepática y la fibrosis progresan con más rapidez en los pacientes coinfectados, fenómeno independiente del recuento de linfocitos CD4.
El diagnóstico de hepatitis B en los pacientes infectados por VIH se realiza con los marcadores virales y la interpretación es similar a la que se realiza en un paciente no coinfectado. Se recomienda la búsqueda del virus delta, particularmente en los pacientes que tienen antígenos de superficie y cargas virales de VHB bajas o indetectables. La medición del ADN del VHB tiene un papel más preponderante en los pacientes coinfectados que en los que no lo están. Por último, se debe hacer la evaluación general del paciente, con medición de la función hepática, exámenes de imágenes y evaluación de algunos marcadores no invasivos de fibrosis; además, en muchos de estos pacientes la biopsia hepática se mantiene como instrumento útil de evaluación.
Un tipo particular de paciente es el que tiene una hepatitis B oculta, que se caracteriza por anti core anti-HBc positivo aislado, con antígeno de superficie (HBsAg) negativo y ADN de hepatitis B detectable; lo anterior ocurre en alrededor de 50% de los pacientes con anti-core y se puede detectar la presencia del ADN viral en niveles bajos. El significado de esta viremia de hepatitis B es incierto y la situación más importante ocurre cuando se asocia con un daño hepático importante, como cirrosis, sin otra etiología clara. Algunos autores recomiendan el uso de antivirales en estas situaciones para tratar de reducir ese ADN, aunque sea bajo.
Los paradigmas generales del tratamiento de la hepatitis B han ido cambiando, situación que también involucra a la coinfección con VIH: el paradigma actual plantea la necesidad de lograr la supresión viral, con el propósito de reducir el ADN viral de hepatitis B, mejorar los niveles de transaminasas, disminuir la resistencia anti-retroviral y negativizar el HBeAg, con una terapia indefinida en muchos de estos enfermos. Esto ya está cambiando hacia la búsqueda de una respuesta completa, que se manifieste por ADN indetectable, valores de transaminasas normales, resistencia mínima, seroconversión, pérdida del antígeno e y disminución mantenida del ADN viral al suspender la terapia. En el futuro, el paradigma contemplará lograr la eliminación del virus, que se define como la obtención de respuesta completa de los parámetros anteriores, más seroconversión del antígeno de superficie, erradicación del cccADN, lo que podría definir la curación de la hepatitis B, evitar reactivaciones y reducir la progresión de la enfermedad hepática.
En el tratamiento de estos pacientes es importante revisar la historia de exposición a antivirales; la mayoría de estos pacientes han recibido lamiduvina como parte de su tratamiento anti-retroviral y es probable que un paciente VIH tenga resistencia a la lamiduvina, lo que es casi la norma en vez de la excepción. En cuanto a la hepatitis aguda por VHB, no hay mayor evidencia que respalde que estos pacientes deban ser tratados en la fase aguda de la enfermedad.
Los pacientes que tienen hepatitis crónica por VHB asociado con VIH se clasifican en dos grupos. Primero están los pacientes que no tienen necesidad de terapia anti-retroviral, porque no cumplen los criterios de un recuento de linfocitos CD4 menor de 200 o síntomas de infecciones oportunistas; en los pacientes coinfectados con VHB, algunos autores recomiendan iniciar el tratamiento anti-retroviral cuando el recuento de células CD4 baja de los 500. La evaluación es similar a la de los pacientes no coinfectados. La indicación de tratamiento dependerá de si la infección está activa y constituye una enfermedad progresiva; el criterio que más se utiliza es el parámetro del ADN viral de hepatitis B con una carga viral mayor de 100.000 copias; la otra indicación es que exista actividad inflamatoria importante o fibrosis en la biopsia hepática.
Los principios de la terapia, en los pacientes sin tratamiento anti-retroviral HAART, establecen que no se debe utilizar drogas anti-retrovirales orales con actividad anti-VIH fuera de HAART, como lamiduvina, emtricitabina y tenofovir; por lo tanto, las drogas de elección son las que no tienen actividad anti-VIH, como entecavir, que es el antiviral más potente contra el VHB sin actividad anti-VIH y el interferón pegilado, que se mantiene como una buena opción en pacientes con niveles de CD4 normales o sobre 500. En pacientes con cirrosis descompensada que no están en tratamiento anti-retroviral, o cuyo esquema no lo contemple, la adición de adefovir en dosis bajas (10 mg) podría ser una alternativa, pero siempre subsiste la duda de que este fármaco pueda generar resistencia al VIH.
El otro grupo de pacientes es el que necesita terapia anti-retroviral. Actualmente se recomienda utilizar la combinación de dos nucleósidos o nucleótidos con actividad anti-VHB y anti-VIH; la combinación ideal es emtricitabina más tenofovir (Truvada), ya que ambos son antivirales con actividad doble. Lo anterior se debe asociar a un inhibidor de la transcriptasa reversa no nucléotido, o inhibidor de la proteasa. En Julio de 2006, la Federal Drug Administration (FDA) de los Estados Unidos aprobó la combinación de emtricitabina, 200 mg, fumarato de tenofovir 300 mg y efavirenz, 600 mg (Atripla), la cual permite tratar ambos virus con sólo un comprimido diario, lo que mejora la adherencia al tratamiento.
La potencia de los antivirales se relaciona con la barrera genética o la facilidad relativa para generar mutaciones que generen resistencia. Como se ve en la Fig. 6, emtricitabina y tenofovir son potentes, por lo que suelen ser la primera elección cuando se decide un tratamiento; adefovir es menos potente que lamivudina. Tenofovir es la primera alternativa en estos pacientes, sin olvidar la importancia, en el manejo general de estos enfermos, de la prevención, mediante control y vacuna, de todos los contactos.
Figura 6. Potencia antiviral y resistencia.
Coinfección VHC y VIH
La prevalencia de hepatitis C en pacientes portadores de VIH es de 30%, según cifras internacionales (3, 4 y 5) (Fig. 7). En el tratamiento de estos pacientes se debe evitar el uso de nevirapina debido a su hepatotoxicidad, que se manifiesta con más frecuencia cuando el recuento de linfocitos CD4 es mayor de 200 y cuando existe coinfección con VHC. Se recomienda iniciar la terapia anti-retroviral un poco antes que en los pacientes no coinfectados, para obtener los efectos benéficos de dicha terapia sobre la progresión de la fibrosis y, además, porque el tratamiento con interferón produce neutropenia y linfopenia y, por tanto, disminución de los niveles de linfocitos CD4. El papel de la biopsia hepática se ha discutido ampliamente y cobra mayor importancia en los pacientes con genotipo 1; los portadores de genotipo 2 y 3 se pueden tratar sin necesidad de biopsia. Los métodos no invasivos tienen especial importancia en este grupo de pacientes.Figura 7. Prevalencia mundial de la coinfección HCV en pacientes HIV (+).
El tratamiento consiste en la combinación de interferón pegilado con ribavirina, con el objetivo de asegurar la respuesta viral sostenida. El momento de inicio del tratamiento dependerá de la fase de la hepatitis: en la hepatitis C aguda, los criterios son similares a los de los pacientes no coinfectados, es decir, tratar durante la etapa aguda; en cambio, en hepatitis C crónica, a los pacientes que no están recibiendo terapia anti-retroviral y que tienen recuentos mayores de 200 CD4 se les debe indicar el tratamiento y, en los pacientes con bajo recuento de linfocitos CD4, se debe intentar iniciar la terapia anti-retroviral para elevar el recuento de linfocitos CD4, sin dejar de tener presente la reconstitución inmune y la función hepática. Es decir, se debe iniciar la terapia anti-retroviral y luego iniciar la terapia anti-VHC, ya que la disminución de los linfocitos CD4 disminuye la respuesta al tratamiento. La cirrosis descompensada en estos pacientes se considera una contraindicación del tratamiento.
Se han realizado diversos ensayos clínicos en que se compara el interferón pegilado con el interferón convencional (6, 7, 8), ambos asociados con ribavirina en distintas dosis, y se han observado respuestas alejadas de las de pacientes no coinfectados (Tabla I). En consecuencia, la recomendación de consenso es usar dosis de ribavirina de 1000 mg a 1200 mg en pacientes con genotipo 1 y dosis de 800 mg en pacientes con genotipo 2 ó 3. La duración del tratamiento debe ser de 48 semanas, independiente del genotipo. La monitorización de la respuesta es semejante a la de los pacientes no coinfectados: se mide la carga viral a las 12 semanas y, si no hay disminución de 2 logaritmos, el paciente debe suspender el tratamiento. Además se debe efectuar monitorización por reacción de polimerasa en cadena (PCR) a las 24 semanas y, si es positiva, ese paciente no responderá a la terapia y se debe suspender el tratamiento. Se debe evitar la zidovudina, ya que, en combinación con ribavirina, produce anemia (9).
 Tamaño completo
Tamaño completo Tabla I. Interferón pegilado (PegIFN) más ribavirina (RBV) en coinfección HIV/HCV.
La esteatosis en la coinfección VHC-VIH es frecuente: afecta entre 40% y 67% de los pacientes y se puede combinar esteatosis microvesicular con macrovesicular. Los factores de riesgo para desarrollar esteatosis son los mismos que en los demás pacientes no coinfectados: índice de masa corporal; genotipo 3; raza caucásica y, probablemente, también los hispanos, y mayor fibrosis; pero se agregan otros factores, como son la hiperglicemia o resistencia a la insulina; la presencia de lipodistrofia y la duración del tratamiento con inhibidores de la proteasa, todos los cuales son factores asociados con los efectos de la terapia antiretroviral.
Otro punto a considerar es la toxicidad mitocondrial, cuyo cuadro clínico se caracteriza por dolor abdominal, náuseas, hepatitis aguda, esteatosis y acidosis láctica. Este cuadro se origina por la inhibición de la ADN polimerasa mitocondrial (gamma) por los análogos de nucleósidos y puede llevar a la insuficiencia hepática. Un grupo de análogos de nucleósidos son los d-análogos y, en orden de potencia, los que presentan mayor inhibición de la ADN polimerasa mitocondrial son: zalcitabina (ddC), didanosina (ddI), stavudina (d4T) y zidovudina (AZT): dicha inhibición se potencia con el uso de ribavirina.
Respecto al trasplante hepático en VIH, en la Tabla II se observan los resultados de un trabajo de la serie de Pittsburgh y otros centros, comparados con la base de datos de la UNOS (United Network of Organ Sharing data) (10), con una sobrevida a 3 años de 73% y 79%, respectivamente, sin diferencias significativas. En las distintas series, la causa más frecuente de trasplante hepático en pacientes con VIH es la hepatitis C. Asimismo, se observa una disminución de la mortalidad post-trasplante en los pacientes coinfectados con VHC-VIH; la mortalidad está determinada principalmente por la reinfección por VHC.
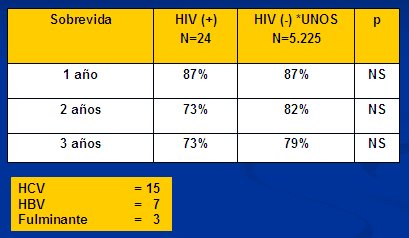 Tamaño completo
Tamaño completo Tabla II. Sobrevida del trasplante hepático en VIH (+).
Referencias
- Second International Workshop on HIV and Hepatitis Co-infection. Amsterdam, January 12th-14th, 2006 [Abstract 3].
- Qurishi N et al, Lancet 2003.
- Sherman et al. Antiviral Ther. 2000; 5(Suppl 1):64-65.
- Lauer, Walker. N Engl J Med. 2001; 345:41-45.
- Soriano et al. XIIIth IAS; July 9-14, 2000; Durban, South Africa. Abstract ThOrB655.
- Chung RT, et al. N Engl J Med. 2004; 351:451-459.
- Torriani FJ, et al. N Engl J Med. 2004; 351:438-450.
- Carrat et al. JAMA. 2004; 292:2839-2848.
- Alberti et al. J Hepatol 42; 615-624. 2005.
- Ragni M et al. J Infect Dis. 2003; 188:1412-20.

