Cursos
← vista completaPublicado el 1 de abril de 2003 | http://doi.org/10.5867/medwave.2003.03.3341
Cáncer de mama durante el período de embarazo y lactancia
Breast cancer during pregnancy and lactation
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 3 de abril y 7 de agosto de 2002. Director: Dr. José Manuel Ojeda.
Introducción
Aproximadamente 400.000 mujeres mueren en el mundo cada año por cáncer de mama (1). En Chile, en el período comprendido entre 1997 y 2000 se notificaron 3.283 cánceres de mama en el sistema público de salud, de los cuales el 31% ocurrió en mujeres menores de 50 años de edad (2), lo que concuerda con otros estudios publicados (1,3,4,7,8,9,10). En nuestro país el cáncer de mama corresponde a la tercera causa de muerte por cáncer en las mujeres. En 1998 se registraron 982 muertes por cáncer de mama, lo cual determina una tasa de mortalidad de 13 por 100.000 mujeres (2).
La definición tradicional de cáncer de mama y gestación utilizada en la literatura, es el diagnóstico de cáncer de mama durante el embarazo o hasta después de un año del parto o aborto (1). Dado que cada vez más mujeres posponen la maternidad para la cuarta y quinta décadas de la vida, período en el cual se incrementa la incidencia de cáncer de mama, se prevé que aumentará aún más su ocurrencia en mujeres embarazadas y en lactancia (5,6).
Aunque el cáncer de mama es el segundo cáncer que con mayor frecuencia se presenta en mujeres embarazadas en el mundo, después del cáncer de cuello uterino, diversos autores estiman que aún es un evento infrecuente cuya incidencia varía entre 1 en 10.000 a 1 en 3.000 embarazos (3,4). Una publicación que recopiló la información de 32 estudios de pacientes con cáncer de mama asociado a embarazo, realizados entre 1937 y 1982, concluyó que el 0,2% al 3,8% de todos los cánceres de mama coinciden con embarazo o lactancia (4). En el grupo de mujeres menores de 30 años, en el cual el cáncer de mama tiene muy baja incidencia, la asociación con embarazo o lactancia es más frecuente, como se demuestra en 2 estudios norteamericanos (9,10), donde el 9,7% y 25,6%, respectivamente, de los cánceres de mama ocurridos en mujeres menores de 30 se asociaron a embarazo o lactancia.
Diagnóstico
La mujer embarazada con cáncer de mama presenta habitualmente un tumor palpable o un aumento focal de la consistencia de la mama (9). Los cambios fisiológicos que ocurren en la mama por la influencia hormonal, como la hiperplasia lobular y galactostasis, especialmente evidentes durante la lactancia, tienden a ocultar las masas mamarias, lo que comúnmente contribuye al atraso en el diagnóstico en éste grupo de pacientes. Varios estudios han demostrado una demora de tres a seis meses en el diagnóstico de cáncer de mama en mujeres embarazadas o en lactancia, por lo que se responsabiliza a este factor del estadio más avanzado que caracteriza al cáncer de mama en la embarazada (9,10,11,12,13).
La interpretación de los hallazgos del examen físico de la mama es más difícil a medida que progresa el embarazo. Un examen basal detallado antes del embarazo, y una mamografía en caso de estar indicada según sea la edad y factores de riesgo de la paciente, es de gran ayuda. Si esto no es posible, la primera visita obstétrica es una buena oportunidad para detectar anormalidades, ya que en el primer trimestre del embarazo han ocurrido pocos cambios en la glándula mamaria, lo que facilita su evaluación.
Considerando que el 80% de las biopsias mamarias realizadas durante el embarazo resultan ser lesiones benignas, el hallazgo de un tumor de mama, o un aumento focal de la consistencia de ésta, requieren de seguimiento a corto plazo, dada la posibilidad que se trate de tejido mamario hipertrófico; si éste persiste luego de 2 a 4 semanas se debe realizar mayor estudio (1,12,13).
Mamografía
La eficacia de la mamografía en el diagnóstico del cáncer mamario durante el embarazo es controversial. Algunos estudios retrospectivos han encontrado tasas de falsos negativos entre el 22% y el 75%, lo que se ha atribuido al aumento del contenido hídrico de la mama, incremento de la vascularización, hipertrofia glandular, contenido lácteo en conductillos y disminución relativa del tejido adiposo, todo lo cual contribuye al aumento de la densidad del parénquima (14,15).
Existe debate acerca de la utilidad y rendimiento de la mamografía en la embarazada, sin embargo el procedimiento puede ser realizado en forma segura con el uso de protección abdominal y puede aportar importante información para el diagnóstico (16,17).
La evidencia actual sugiere que no hay aumento del riesgo para el feto en cuanto a malformación congénita, aborto o restricción del crecimiento por radiación ionizante a dosis menores de 5 rad (31). La dosis recibida por el útero, con dos proyecciones por lado, equivale aproximadamente a 0,002 mRad por cada mama (0,004 mRad para ambas mamas). La radiación de fondo natural a la que se expone el feto es 2 mRad cada semana. Así, la exposición potencial a la radiación de un feto por una mamografía es 5000 veces menor que la exposición semanal procedente de la radiación natural habitual (17).
Ultrasonido
No está contraindicado durante el embarazo y permite el diagnóstico diferencial entre tumores sólidos y quísticos. Su utilidad en el diagnóstico diferencial entre tumores sólidos benignos y malignos en mujeres gestantes ha sido evaluada sólo en estudios pequeños, por lo que la información debe ser interpretada con cautela. A pesar de esto, el ultrasonido mamario parece tener un lugar importante en la evaluación inicial de la embarazada con tumor mamario (14,15,16,17).
Resonancia Magnética (RM)
La RM se ha utilizado para el diagnóstico de malformaciones fetales en el periodo prenatal, y en los estudios publicados no se han descrito efectos adversos en el feto (18,19). No se han publicado estudios que evalúen la utilidad de la RM en el diagnóstico de tumores de mama en mujeres embarazadas o en lactancia.
Biopsia
Independientemente del resultado obtenido con la mamografía o el ultrasonido, un tumor mamario clínicamente sospechoso en una mujer gestante debe ser estudiado histológicamente para un diagnóstico definitivo. El diagnóstico diferencial de un tumor de mama durante el embarazo debe ser realizado con el método menos invasivo y de mayor rendimiento disponible, lo cual puede variar según sea la experiencia y recursos disponibles en cada grupo de trabajo (17).
Varios estudios extranjeros han demostrado la utilidad de la punción aspirativa con aguja fina, para estudio citológico, en el diagnóstico del cáncer de mama asociado a embarazo y lactancia (20,21,22), pero destacan que su interpretación adecuada requiere de un patólogo entrenado. Sin embargo en nuestro medio no hay estudios que validen esta técnica, por lo que existe controversia en cuanto a su uso y rendimiento. Se debe tener presente que un estudio citológico sólo es útil cuando el resultado es positivo para células neoplásicas. Los resultados negativos no descartan el diagnóstico de cáncer y requieren mayor estudio.
La biopsia core tiene buen rendimiento y permite el diagnóstico de invasión. Si es necesario, es posible realizar biopsias incisionales o excisionales con seguridad durante el embarazo (23,24,25).
El temor a las complicaciones que la biopsia mamaria pueda producir en la paciente embarazada o en lactancia puede inducir al médico a posponerla, pero varios autores concuerdan que los infrecuentes casos descritos de fístulas lácteas no son motivo para evitar realizarla. Otras complicaciones no son más frecuentes que en los controles (10,16,17,23,25). Un estudio de Petrek (10) que incluyó a 63 pacientes embarazadas con cáncer de mama, reveló una conducta evasiva de los clínicos a realizar biopsias durante el embarazo o la lactancia. En este estudio, menos del 20% de los cánceres fueron diagnosticados durante el embarazo y casi el 50% de los tumores detectados durante el embarazo fueron estudiados en las 12 semanas siguientes al parto. El gran tamaño de los cánceres, 3,5 cm en promedio, en aquellas pacientes cuyo diagnóstico fue hecho recién en el período postparto, sugiere que probablemente ya existía un tumor palpable durante el embarazo, el cual debió ser estudiado. De ahí la importancia de un examen clínico acucioso y una conducta activa frente a la detección de una lesión, particularmente en la embarazada.
Etapificación
En mujeres con cáncer de mama, estén o no embarazadas al momento del diagnóstico, se utiliza el sistema TNM para etapificar la enfermedad, para planificar el tratamiento y establecer el pronóstico. Existen varios estudios retrospectivos en que se observa que las mujeres con cáncer de mama asociado al embarazo o lactancia presentan, al momento del diagnóstico, una etapa más avanzada, mayor tamaño del tumor y aparentemente una mayor frecuencia de compromiso axilar y diseminación, por lo que la presencia de metástasis debe ser descartada, especialmente en hueso, pulmón e hígado, sitios más frecuentemente afectados (7,26,27).
Según un estudio (28), el 28% de las mujeres embarazadas con cáncer de mama presenta una enfermedad en etapa I, el 30% en etapa II y el 41% en etapas III y IV. Además, entre el 61% y 89% de las mujeres embarazadas tienen compromiso axilar, notoriamente más elevado que el 40 a 50% encontrado en las mujeres no embarazadas (29).
En la etapificación se requiere de medidas especiales para proteger al feto. No existe contraindicación para realizar radiografía de tórax en pacientes embarazadas, pero debe efectuarse con protección abdominal adecuada (1,16,30). Puede existir dificultad para la evaluación de las bases pulmonares en embarazos avanzados, cuando el útero grávido comprime el diafragma.
El ultrasonido abdominal para evaluar metástasis hepáticas es seguro. La TAC abdominopélvica y la cintigrafía están contraindicadas durante el embarazo, por el riesgo de exposición fetal a la radiación y deben ser diferidas hasta el puerperio. La RM puede ser utilizada durante la gestación en caso de requerir mayor evaluación de las vísceras abdominales y de la columna torácica y lumbosacra (17,18,19).
Marcadores biológicos
Pocos estudios han evaluado los aspectos patológicos del cáncer de mama en la paciente embarazada y comparado a los hallazgos en la mujer no gestante.
Receptores hormonales
En el único estudio publicado a la fecha, que ha utilizado la técnica de inmunohistoquímica (32), se encontró que la mayoría de los cánceres de mama en embarazadas son positivos para los receptores hormonales. Esto se contrapone a los estudios más antiguos en que se utilizó el método bioquímico para titular receptores para estrógenos y progesterona, los que mostraban con mayor frecuencia la ausencia de estos en mujeres embarazadas (26,27,31). Hoy se sabe que los sitios activos de los receptores hormonales se encuentran ocupados por los altos niveles de esteroides producidos durante la gestación, existiendo también un proceso de internalización (down regulation), con lo cual el método bioquímico disminuye su rendimiento y aumentan los resultados falsos negativos.
Factores genéticos
Con respecto a la expresión de HER2/neu en cáncer de mama y embarazo, el 58% de los casos presenta tinción positiva, comparado con el 16% de los controles (32).
El efecto de las mutaciones de BRCA1, BRCA2 y BRCA3 sobre la incidencia del cáncer de mama en la embarazada no es claro, ya que se dispone de poca información. Hay dos publicaciones (33,34) donde se encontró un predominio significativo de mutaciones de BRCA1 Y BRCA2 en mujeres embarazadas con cáncer de mama, con un 88%, en comparación al 20% del grupo control.
Manejo perinatal y tratamiento
El objetivo principal es el control de la enfermedad local y sistémica, como en toda mujer con cáncer de mama. Las estrategias terapéuticas son similares, pero se deben considerar las repercusiones que el tratamiento puede tener en el feto y en el embarazo.
Cirugía
El tratamiento quirúrgico no se debe demorar a causa del embarazo. La mastectomía con disección axilar se puede realizar con mínimo riesgo para el feto y la gestación (35,36,43). De un registro de 5405 cirugías realizadas en mujeres embarazadas, por distintas causas (35), se concluyó que la incidencia de abortos espontáneos, malformaciones congénitas y óbito fetal no aumentaron en comparación a la población general. Sin embargo, se observó un incremento de recién nacidos de bajo peso, lo cual se atribuyó a la prematurez determinada por la interrupción anticipada del embarazo. También hubo aumento de la mortalidad neonatal precoz, donde la mayoría de los casos corresponden a prematuros extremos. Ningún tipo específico de anestesia o técnica quirúrgica se asoció a resultados perinatales adversos en este estudio.
Otro estudio (37) tampoco encontró aumento de las malformaciones fetales en un estudio que involucró a 2565 mujeres embarazadas que fueron sometidas a cirugía y comparadas con un grupo control de mujeres embarazadas.
La cirugía conservadora de la mama es técnicamente posible de realizar en la paciente embarazada. Sin embargo, la radioterapia requerida para completar el tratamiento local está absolutamente contraindicada durante el embarazo, por el riesgo que implica para el feto la exposición a la radiación, ya que la dispersión abdominal es considerable incluso con protección (30).
Aunque no existen aún seguimientos a largo plazo, se acepta que la cirugía conservadora es una alternativa de tratamiento en pacientes embarazadas en el tercer trimestre del embarazo, que presenten lesiones susceptibles de este tipo de cirugía, en quienes la radioterapia es posible posponer hasta inmediatamente después del parto.
En el caso de pacientes embarazadas con indicación de quimioterapia neoadyuvante, ésta puede ser administrada durante la gestación a partir del segundo trimestre. Luego, es posible realizar la cirugía conservadora, ya sea durante el embarazo o bien después del parto. En ambas situaciones se logra obtener una edad gestacional mayor al momento del parto, con lo que disminuyen los riesgos neonatales relacionados con la prematurez, y se posibilita el manejo conservador, efectuando la radioterapia una vez resuelto el embarazo.
En un estudio de cohortes prospectivo del MD Anderson Cancer Center (31) publicado en 1999, de 24 embarazadas con cáncer de mama, fue posible tratar con cirugía conservadora a 2 pacientes, a las cuales se las irradió durante el puerperio.
Tratamiento sistémico
Las indicaciones de terapia sistémica en la mujer embarazada con cáncer de mama son iguales a las de la paciente no gestante. Existe poca información respecto a la fármacocinética de los diferentes agentes citotóxicos en forma individual en la embarazada. La mayor parte de los fármacos antineoplásicos se clasifican en la categoría D, que son aquellos en los cuales hay evidencia de riesgo fetal, si bien se piensa que los beneficios superan los riesgos (38,39).
Durante el embarazo existen cambios fisiológicos que incluyen modificaciones de la función renal y hepática, aumento del volumen plasmático, hemodilución, entre muchos otros, que influencian la farmacología de las drogas antineoplásicas (39). No existen estudios prospectivos que hallan descrito la concentración de citotóxicos in útero o en tejido fetal. Aunque la barrera trofoblástica regula la penetración de los fármacos, se ha informado de un caso de óbito fetal con concentraciones tisulares mensurables de antraciclinas, cuya madre había recibido doxorrubicina poco tiempo antes del parto (40).
Tratamiento sistémico en el primer trimestre
En una revisión (39) de 139 embarazadas que recibieron quimioterapia durante el primer trimestre por diversas neoplasias se encontró un 17% de malformaciones fetales, en comparación con 1,3% de 150 embarazadas que fueron tratadas durante el segundo y tercer trimestres.
En otro estudio (41) de 217 embarazadas tratadas con quimioterapia entre 1983 y 1995 por diversas neoplasias, 20 recién nacidos (9,2%) tuvieron anomalías congénitas, ocurrieron 15 (6,9%) abortos espontáneos y 4 (1,8%) óbitos fetales. La mayoría de estos resultados adversos ocurrieron en mujeres que recibieron quimioterapia durante el primer trimestre.
Basados en la evidencia disponible, se concluye que el período de exposición a la quimioterapia es crítico, con mayor riesgo durante la organogénesis, donde se estima que la tasa de malformaciones mayores es de 10 a 17%, por lo que no debe utilizarse en éste período (39,40,41,42).
Tratamiento sistémico en segundo y tercer trimestres
Existe en la literatura sólo un estudio prospectivo de cohortes en pacientes embarazadas con cáncer de mama que recibieron quimioterapia durante el segundo y/o tercer trimestre, en donde no ocurrió ninguna malformación congénita, mortinatos o abortos espontáneos (31). Las 24 mujeres de este estudio fueron tratadas con 5-fluoracilo 1000 mg/m2 i.v., adriamicina 50 mg/m2 en infusión continua por 72 horas y ciclofosfamida 500 mg/m2 i.v., por un promedio de 4 ciclos. Los autores concluyeron que la quimioterapia puede ser administrada durante el segundo y tercer trimestres del embarazo con mínimas complicaciones para el feto y la madre. Las complicaciones maternas registradas anteparto fueron un caso de diarrea y fiebre de origen no precisado que se resolvió con medidas generales y sintomáticas, y una paciente con el antecedente de trombosis venosa profunda en una pierna quien desarrolló otro episodio en la misma extremidad y que fue hospitalizada para manejo anticoagulante con heparina. La edad gestacional al momento del parto, en promedio, fue de 38 semanas. De los recién nacidos, sólo uno presentó restricción del crecimiento intrauterino, registrando un peso inferior al percentil 10 para la edad gestacional, y uno presentó leucopenia transitoria sin complicaciones infecciosas. Este feto fue expuesto a quimioterapia dos días antes del parto.
La restricción del crecimiento intrauterino, probablemente se deba al efecto de las drogas antimitóticas en los tejidos trofoblástico y fetales (11,40,41,42).
No existen estudios publicados con el uso de taxanos durante el embarazo, por lo cual actualmente no se recomienda su uso.
Muchas de las drogas citotóxicas, especialmente los agentes alquilantes, son excretados en la leche materna, por lo que las mujeres que reciben quimioterapia deben evitar el amamantamiento mientras dure el tratamiento. Se debe tener cuidado también con los antieméticos utilizados durante el embarazo en mujeres que están con quimioterapia ya que su perfil de seguridad es limitado (38).
Terapia hormonal
Ebert (41) informó de un feto expuesto a tamoxifeno durante toda la gestación, el cual resultó en un parto de pretérmino a las 26 semanas con síndrome de Goldenhar, caracterizado por hipoplasia facial, displasia óculo-auricular-vertebral y retardo mental. El uso de moduladores selectivos de los receptores estrogénicos e inhibidores de la aromatasa no están recomendados, ya que pueden interferir con los cambios hormonales del embarazo normal.
Radioterapia
La radiación local requerida para completar el tratamiento conservador está contraindicada durante el embarazo, por los riesgos que implica la exposición fetal. Una dosis terapéutica de 5000 cGy en la mama puede resultar en una exposición fetal de 10 a 15 cGy durante el primer trimestre y a 200 cGy en el tercer trimestre, esto por la mayor proximidad del feto al campo de radiación a medida que el embarazo progresa (43).
Datos obtenidos de la detonación atómica de Hiroshima-Nagasaki demuestran que una dosis aérea de 1 a 9 cGy durante las semanas 6 a 11 del embarazo tienen como consecuencia una incidencia del 11% de microcefalia y retardo mental, comparada con un 4% en el grupo control (44,45). Además, en los niños expuestos a radiaciones ionizantes in útero, existe un aumento del riesgo de desarrollar leucemia en la infancia (46).
Interrupción del embarazo
Aunque en el pasado se pensaba que la interrupción del embarazo mejoraba la sobrevida en mujeres embarazadas con cáncer de mama, la evidencia disponible actualmente demuestra que el embarazo no ejerce un efecto adverso en el pronóstico, por lo que el aborto terapéutico no mejora la evolución de las pacientes (47,48). En un estudio con 24 embarazadas con cáncer de mama tratadas con mastectomía radical, la sobrevida no mejoró en aquellas pacientes que habían abortado (47). Es más, algunos estudios incluso han sugerido que las mujeres sometidas a interrupción del embarazo pueden tener un deterioro del pronóstico y disminución de la sobrevida, comparadas con aquellas que continuaron su gestación (49,50).
Control prenatal
La paciente embarazada con cáncer de mama requiere de control prenatal multidiciplinario, lo que implica la participación de un equipo médico especializado en salud materno fetal.
El ultrasonido debe ser utilizado para determinar edad gestacional, elemento de gran importancia para determinar la fecha de parto, lo cual permite planificar un tratamiento adecuado y es de gran utilidad para la evaluación anatómica fetal y del crecimiento intrauterino. En algunos casos puede ser necesaria la amniocentesis para estudio del líquido amniótico y determinar la madurez pulmonar fetal, especialmente si se considera interrumpir el embarazo antes del término (51).
Parto en embarazadas con cáncer de mama
Es difícil obtener conclusiones basados en los estudios existentes, ya que todos, excepto uno (31), son retrospectivos, pero el hallazgo más constante en embarazadas con cáncer de mama es el bajo peso de nacimiento y el parto prematuro, por la tendencia a interrumpir anticipadamente el embarazo con el objeto de iniciar el tratamiento posterior al parto. La edad gestacional promedio al momento del parto fue de 34,7 semanas en la serie de Giacalone (42) y de 38 semanas en la cohorte de Berry (31). Además, se observó la ocurrencia de algunos casos de restricción del crecimiento fetal (31,41,42).
Toda vez que exista indicación de extracción fetal prematuramente, y las condiciones maternas y fetales permitan el uso de corticoides 48 horas antes del parto, éstos deben ser siempre administrados, ya que se ha demostrado su utilidad entre las 24 y 34 semanas de gestación en la prevención de complicaciones neonatales como síndrome de membrana hialina, hemorragia intraventricular, enterocolitis necrotizante y displasia broncopulmonar (51).
Seguimiento a largo plazo de los recién nacidos
Existen pocas publicaciones sobre los efectos que a largo plazo puede tener la exposición in útero de la quimioterapia materna en cuanto al estado físico y desarrollo mental de los niños expuestos.
Berry (31) no informó de ninguna alteración del desarrollo. De 50 recién nacidos pertenecientes a mujeres embarazadas que recibieron quimioterapia por leucemia aguda, hubo crecimiento y desarrollo normal y ninguna evidencia de neoplasia en ninguno de los 7 niños que tuvieron seguimiento prolongado por 17 años (52). En otro estudio, Giacalone (42) encontró que 16 niños expuestos in útero a quimioterapia tuvieron un desarrollo normal. Li y cols (53) encontraron sólo 2 neoplasias infantiles en un grupo de 146 mujeres tratadas durante 286 embarazos.
Avilez y col (54) estudiaron 20 niños expuestos a quimioterapia in útero en pacientes con leucemia. Se registró 1 mortinato de causa desconocida, 1 falleció a los 21 días de vida por sepsis atribuido a leucopenia secundaria a la quimioterapia y 1 falleció a los 3 meses por gastroenteritis aguda. En los 17 restantes hubo seguimiento por 22 años, no registrándose secuelas a largo plazo. En este estudio los niños fueron seguidos con examen físico y hemograma cada 3 meses en los primeros 2 años de vida y cada 6 meses hasta los 22 años. Se realizó evaluación neurológica y pruebas formales de inteligencia en dos oportunidades, con intervalo de 3 años.
Basados en estos estudios, se puede concluir, con prudencia, que la exposición in útero a quimioterapia como parte del manejo del cáncer en la embarazada, parece no afectar el desarrollo normal a largo plazo de los niños expuestos.
Seguimiento de la paciente
Las pacientes con antecedente de cáncer de mama durante el embarazo deben ser controladas según el protocolo de seguimiento publicado por la Sociedad Americana de Oncología Clínica (55) y el National Comprehensive Cancer Network (56) para mujeres tratadas por cáncer de mama: Anamnesis y examen físico cada 3 a 6 meses durante los tres primeros años después del tratamiento y cada 6 a 12 meses por los dos años siguientes.
Posteriormente se sugiere controles una vez al año. Además, se debe realizar mamografía anual, bilateral en caso de cirugía conservadora o de la mama contralateral en caso de mastectomía radical. No se recomienda realizar durante el seguimiento otros exámenes de laboratorio o imagenológicos por su bajo rendimiento, a menos que clínicamente se sospeche una recidiva.
Pronóstico
Numerosos estudios de casos y controles han sugerido que cuando las pacientes son pareadas por edad y estadío de presentación, no existe diferencias significativas en la sobrevida entre pacientes embarazadas con cáncer de mama y mujeres no embarazadas con cáncer de mama (tabla 1) (9,10,26,27,48,58).
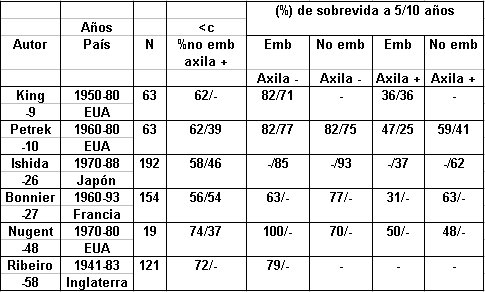 Tamaño completo
Tamaño completo Tabla 1. Estudios retrospectivos publicados de seguimiento y sobrevida*.
*Información involucra a 18 instituciones de salud e incluye pacientes con cáncer de mama en el periodo de lactancia dentro de los 2 años posteriores al parto. emb= embarazada. no emb= no embarazada.
axila += presencia de linfadenopatías axilares. axila -= auscencia de linfadenopatías axilares.
Embarazo posterior a un cáncer de mama
Alrededor del 10% de las mujeres tratadas por cáncer de mama se embarazan posteriormente y el 70% de éstas lo hace durante los 5 años siguientes (59,60).
Existe sólo un estudio que sugiere que el embarazo posterior al tratamiento de un cáncer de mama afecta adversamente la supervivencia (61). La mayoría de los estudios han concluido que las mujeres que se embarazan después de un tratamiento exitoso para cáncer de mama no presentan un deterioro en la sobrevida (47,62,63) y existe otro recién publicado (64) del International Breast Cancer Study Group que muestra que el pronóstico puede ser incluso mejor, al menos en etapas tempranas, al compararlas con un grupo control de mujeres que no se embarazan. Además, no hay datos que sugieran que la lactancia afecte adversamente el pronóstico de un cáncer de mama tratado.
En las mujeres tratadas adecuadamente por un cáncer de mama las recomendaciones para futuros embarazos se basan en diversos factores, entre los cuales el más importante es la posibilidad de recidiva. Según diferentes autores (1,16) es razonable aconsejar un plazo de 2 a 3 años, ya que se estima que aproximadamente el 80% de las recidivas ocurren en un periodo de 2 a 5 años luego del tratamiento, pero el peor pronóstico se observa en las pacientes que recidivan dentro del primer año, en quienes el riesgo de enfermedad diseminada es seis veces superior en comparación a mujeres sin recidiva (65,66).
Podemos concluir que la evidencia actual indica que no existe contraindicación para que las mujeres tratadas por un cáncer de mama se embaracen, después de un periodo mínimo de 2 años desde finalizado el tratamiento y de haber descartado reactivación de la enfermedad.

