Publicado el 1 de abril de 2004 | http://doi.org/10.5867/medwave.2004.03.3489
Leucemia linfoblástica aguda y alta hiperdiploidía en pediatría
Acute lymphoblastic leukemia and high hyperdiploidy in children
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
Introducción
La leucemia linfoblástica aguda (LLA) es el cáncer más común en los niños y está entre los más curables de las malignidades pediátricas. Corresponde a 32 - 35% del total de cánceres, con una incidencia anual de 2,5 a 3 casos por cada 100.000 niños menores de 15 años. En Chile esto equivale a 100-120 casos nuevos al año (1).
En los últimos años ha habido un notable avance en la posibilidad de curar estos pacientes. El protocolo PINDA 96 (Programa Nacional de Drogas Antineoplásicas), que acaba de finalizar, muestra una sobrevida libre de eventos global a 4 años de 80,0% ± 2, que alcanza un 93,0 % ± 2 en riesgo bajo, con una mediana de observación de 39 meses y con 624 pacientes evaluables a lo largo de todo Chile (2).
Debido a los grandes avances desarrollados hasta hoy en cuanto a cura de la enfermedad, tanto a nivel internacional como nacional, se hace cada vez más importante detectar aquellas asociaciones con factores pronósticos. Un factor clásicamente descrito como de buen pronóstico en la literatura es el cariotipo de las leucemias con alta hiperdiploidía, que responden mejor a regímenes de quimioterapia y muestran resultados superiores cuando se comparan con sus contrapartes no hiperdiploides (3-4).
A pesar del buen pronóstico que la alta hiperdiploidía implica en el cariotipo, hay un porcentaje de niños que van a recaer, aquí surgen las preguntas: ¿qué hace que estas células hiperdiploides sean más respondedoras a la quimioterapia, por qué hay algunas que evolucionan distinto, hay factores clínicos o de laboratorio que nos ayuden a conocer anticipadamente cual será la respuesta y como evolucionará nuestro paciente?
Es por estas razones que resulta un tema interesante de analizar, desde todas sus perspectivas, tanto biológicas como clínicas.
Definición y etiología
Se entiende por hiperdiploidía la presencia en el cariotipo de las células leucémicas de 47 a 65 cromosomas, y alta hiperdiploidía definida por 51 a 65 cromosomas (3).
Históricamente este cariotipo hiperdiploide es descrito entre el 23 a 42 % de las leucemias linfoblásticas recién diagnosticadas (5). Y recientemente se habla de un 30% de LLA con alta hiperdiploidía, de células precursoras B (6).
Con respecto a su asociación con inmunofenotipo, Pui et al describe que los porcentajes de hiperdiploidía varían si se correlacionan con el inmunofenotipo. Se encontró en un 33% de los casos clasificados como LLA antígeno positivo (CALLA +) pre B precoz (común), en contraste con un 18% de los casos pre B y 5% de las de células T.
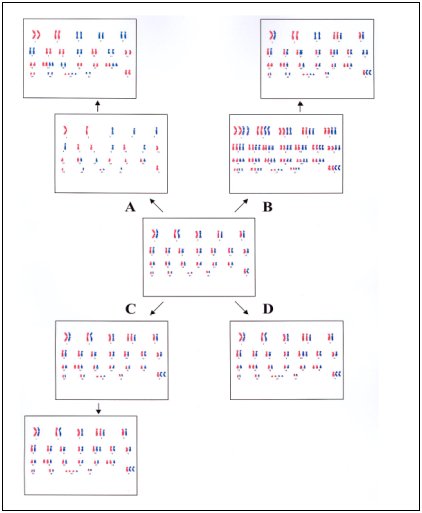
Teóricamente existen 4 vías de formación del pattern hiperdiploide por diferentes mecanismos:
- Por la duplicación de un set de cromosomas near haploide (± 23) (Figura 1A),
- Por previa poliploidización con subsecuente pérdida de cromosomas (Figura 1B),
- Por sucesivas ganancias de cromosomas en consecutivas divisiones celulares (Figura 1C),
- Por simultánea ocurrencia de trisomías y tetrasomías en una sola mitosis aberrante (Figura 1C).
 Tamaño completo
Tamaño completo Figura 1.
Estas cuatro posibilidades no han sido fácilmente investigadas en forma experimental. Sin embargo resultados de estudios actuales sugieren fuertemente que la mayoría de las LLA estudiadas en niños surgen en un solo paso, aunque la posibilidad de ganancia secuencial no puede ser excluida con certeza (5-7).
Con respecto al origen parental de los cromosomas, Paulsson et al revelan que no existe duplicación preferencial de copias heredadas paterna o maternamente de X, 4, 6, 9, 10, 17, 18 y 21. En cambio predomina el origen paterno en la trisomía 8 y materno en la trisomía 14, alcanzando ambos en su trabajo diferencias estadísticamente significativas, concluyendo así que la impronta no es patogénicamente importante en la LLA hiperdiploide, con la posible excepción de lo observado en los cromosomas 8 y 14 (7).
Con respecto al momento de aparición, ya existen evidencias que demuestran que la formación de la hiperdiploidía es un evento temprano en la leucemiogénesis de estas leucemias, que ocurriría en útero (6).
Alta hiperdiploidía y apoptosis
Varias teorías intentan explicar el buen resultado de este tipo de leucemias, entre ellas una de las más estudiadas es que estos blastos leucémicos tendrían grandes requerimientos de sobrevida, ya que presentarían marcada tendencia a sufrir apoptosis (8).
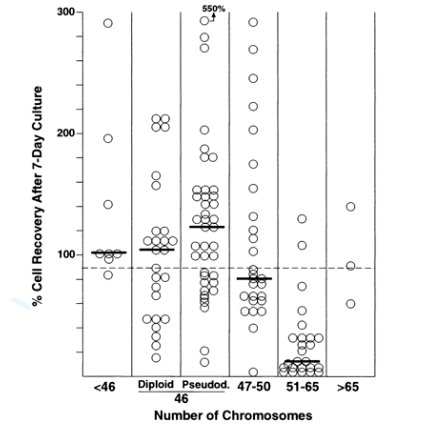
Uno de los trabajos más interesantes fue desarrollado por Chikako et al (9). En él demuestra que existe marcada disminución de la sobrevida in vitro de las células con alta hiperdiploidía luego de ser cultivadas en medios enriquecidos, comparado con células de otros números cromosómicos, lo que se puede observar en la figura 2. Esto se explicaría por mayor porcentaje de apoptosis a pesar de condiciones ideales de cultivo.
 Tamaño completo
Tamaño completo Figura 2. Recuperación de células según número de cromosomas, después de 7 días.
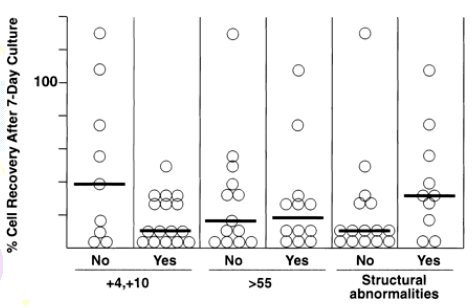
Otras características que han mostrado importancia clínica también fueron analizadas in vitro, entre ellas las trisomías 4 y 10, la presencia de más de 55 cromosomas, la coexistencia con anomalías estructurales, no encontrando diferencias significativas en sus sobrevidas (Figura 3).
 Tamaño completo
Tamaño completo Figura 3.
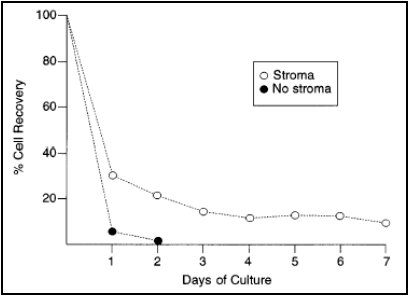
Las células hiperdiploides mueren rápidamente tanto en cultivos sin estroma como estromales, lo que puede observarse a través de microscopía con cambios morfológicos a las 48 y 72 horas, encogimiento celular y fragmentación nuclear. El siguiente gráfico muestra el porcentaje de células recuperadas en los días 1 a 7 del cultivo, que cae en forma muy importante ya a las 48 horas (Figura 4).
 Tamaño completo
Tamaño completo Figura 4.
Chikako et al también sugiere que el mecanismo de muerte celular de células hiperdiploides es similar a la apoptosis por drogas citotóxicas. Lo que se demuestra por citometría de flujo; con reducción en forward scatter (FSC), que indica reducción del tamaño celular, y aumento en side scatter (SSC) que indica aumento de la granularidad celular. Muestra ligamiento a Annexin V FITC, que es un indicador de apoptosis, y tinción con propidium iodide, que es signo de permeabilidad de membrana. Muestra el contenido de DNA, medido por tinción con propidium iodide después de permeabilización de la membrana celular y marcación con dUTP-BrdU, que es incorporado en las células con fragmentación del DNA (Figura 5) (9).
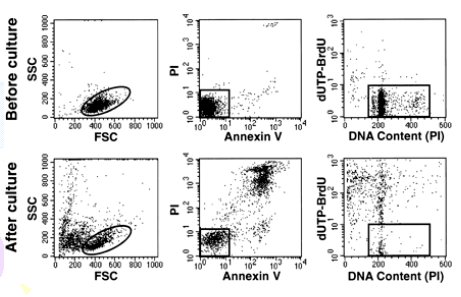 Tamaño completo
Tamaño completo Figura 5.
Importancia clínica
Clásicamente se ha descrito que las LLA son de buen pronóstico clínico, pero a pesar de ello hay un porcentaje de niños que presenta mala evolución.
En primer lugar, con respecto al pronóstico y número de cromosomas, se ha estudiado que el número de cromosomas que presenta mayor frecuencia es 55 (10); la asociación pronóstica se da en los pacientes que presentan 54 a 58 cromosomas, que tienen mejores resultados que los pacientes con 51 a 53 ó 59 a 68 cromosomas (5).
En relación a las anomalías estructurales, Pui y Raimondi et al (11) presentan un análisis de 138 niños con LLA hiperdiploide, encontrando una diferencia estadísticamente significativa en cuanto a que entre los niños que presentaban recaída durante el período de observación, había un claro mayor porcentaje de anomalías estructurales. En contraste con este hallazgo, en un estudio más reciente de 700 casos (10), en que los autores excluyen del estudio las anomalías estructurales con factores pronósticos conocidos, no encuentran asociación con el resto de ellas. Podemos concluir que cuando en una LLA hiperdiploide tenemos una anomalía estructural que se asocia claramente con un tipo de evolución, la asociación de hiperdiploidía y buen pronóstico se pierde.
En tercer lugar, otro punto analizado es la presencia de trisomías, con resultados algo variable en diferentes estudios, sin embargo aparecen con clara asociación a buenos resultados las trisomías 4, 10, 17 y 18 en forma independiente cada una de ellas, como también en asociaciones (5,10,12). La sobrevida libre de eventos alcanza el 96,6% cuando se asocian las trisomías 4 y 10 (12).
Moorman et al en un trabajo recientemente publicado, que tiene el poder de un número de pacientes estudiados de 700, describe claramente grupos de riesgo. Los pacientes con más alto riesgo de recaer son los niños varones mayores de 10 años, las niñas mayores de 10 años, sin trisomía 18 y los niños de 1 a 9 años sin trisomía 18, alcanzando una sobrevida libre de eventos de sólo un 50%. A diferencia de las niñas de 1 a 9 años con trisomía 18 que alcanzan la mejor sobrevida libre de eventos, de un 86% (10). Para sobrevida global, los pacientes menores de 10 años, con trisomías 4 y 18, alcanzan un 96%.
Al estudiar la asociación de LLA hiperdiploide y sexo se confirma la asociación de sexo masculino y peores resultados (10,11).
LLA hiperdiploide y drogas
Dentro de las teorías que se manejan para la mejor respuesta a los tratamientos habituales de las leucemias linfoblásticas agudas, la más importante de ellas es la respuesta de estos blastos a las drogas quimioterápicas, lo que lleva ya algunos años en estudio.
El metotrexato es una de las drogas más ampliamente usadas para el tratamiento de los niños con diagnóstico de LLA. Diferencias entre individuos en la acumulación en linfoblastos de metotrexato y su metabolito activo, el metotrexato poliglutamato, puede contribuir a los diferentes efectos del tratamiento entre los diferentes subtipos de LLA.
Panetta et al demuestra, mediante un modelo matemático, en blastos de 20 leucemias recién diagnosticadas tratadas con infusiones de metotrexato de 24 horas, que los blastos hiperdiploides acumulan significativamente más metotrexato que sus contrapartes no hiperdiploides y de células T (13).
Ahora, en la búsqueda de cómo estos blastos hiperdiploides acumulan más metotrexato, Belkov et al midió, mediante reacción de polimerasa en cadena reversa, la expresión del carrier reducidor de folatos. Los blastos hiperdiploides tenían significativamente expresión más alta de este carrier que los no hiperdiploides, explicando que este mecanismo daría cuenta de la mayor acumulación del antimetabolito (Figura 6) (14).
 Tamaño completo
Tamaño completo Figura 6.
En relación a hiperdiploidía y presencia de trisomías en clínica, se demuestra también que aquellos blastos con alta hiperdiploidía y trisomías 4 y 10 alcanzan niveles de metotrexato aún mayores, lo que explicaría su comportamiento clínico (15).
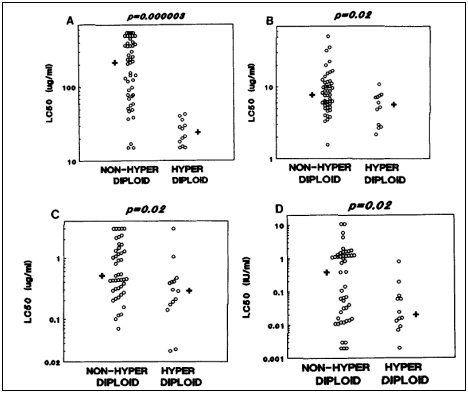
A pesar de que el metotrexato es la droga más asociada a alta hiperdiploidía, Kaspers et al relaciona estos blastos con sensibilidad a antimetabolitos y otras drogas. Encuentra marcada mayor sensibilidad a mercaptopurina, tioguanina, citarabina y asparraginasa que las células no hiperdiploides (Figura 7 A-D). No hubo diferencia en cuanto a: prednisolona, dexametasona, vincristina, vindesina, daunorrubicina mitoxantrona y tenipósido.
 Tamaño completo
Tamaño completo Figura 7. A: Mercaptopurina, B: Tioguanina, C: citarabina, D: Asparraginasa.
Otro hallazgo de este trabajo es el porcentaje de células hiperdiploides que se encuentran en fase S, significativamente mayor que las demás. Sin embargo este porcentaje mayor no está asociado con mayor sensibilidad a las drogas.
Conclusiones
La leucemia linfoblástica es el cáncer infantil más frecuente, que en los últimos años ha alcanzado mejorías importantes en sobrevida libre de eventos y sobrevida global.
La alta hiperdiploidía aparece como un grupo de pacientes con mejor pronóstico, esto probablemente explicado por una marcada tendencia de este tipo de blastos a entrar en apoptosis, además de mayor sensibilidad a la quimioterapia; de ello lo más descrito hasta hoy es su relación con alta respuesta a metotrexato y además a otros antimetabolitos y otras drogas.
Probablemente la formación de esta hiperdiploidía es un fenómeno bastante precoz en la formación de células B, se dice que este proceso ocurriría in vitro, lo que se ha demostrado por hallazgos compatibles en las pruebas de screening de recién nacidos que se han recuperado, una vez que el niño presenta la patología.
Lo más importante de todo esto sigue siendo su asociación con factores clínicos de buen pronóstico: hiperdiploidías de 54 a 58 cromosomas, la presencia de trisomías 4, 10, 17 y 18, la menor edad al diagnóstico y el sexo femenino.
La idea de aclarar en forma lo más detallada posible cuáles serían los niños con muy buena respuesta a tratamiento, para pensar algún día en la posibilidad de adecuar la terapia a cada niño en particular, y no someter a quimioterapias con efectos colaterales que tal vez exceden la intensidad que el paciente requiere.

