Cursos
← vista completaPublicado el 1 de diciembre de 2002 | http://doi.org/10.5867/medwave.2002.11.3504
Nuevas terapias en el cáncer de pulmón IV
New therapies in lung cancer IV
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la Universidad de Chile durante los días 3 de abril y 7 de agosto de 2002.
Editor Científico: Dr. José Manuel Ojeda.
Angiogénesis: El endotelio como objetivo
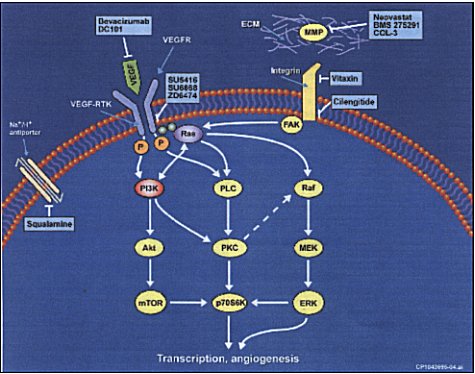
Factor de crecimiento endotelial vascular (VEGF). Es el factor angiogénico regulado más común tanto en tumores naturales o injertados, transformándolo en un objetivo primario para la terapia antivascular (Figura 3) (47). Tiene cinco isoformas, que son variantes en el splicing y existen como homodímeros con uniones disulfuro. Estas tienen algunas similitudes con otros factores de crecimiento como el factor de crecimiento derivado de plaquetas. Estas isoformas se unen con alta afinidad a receptores fms-like tirosina kinasa (flt-1) y fetal liver kinasa (flk-1), que se expresan casi exclusivamente en células endoteliales. La significación biológica de las múltiples formas del receptor VEGF no está dilucidada. Su mayor rol fisiológico es promover angiogénesis correctiva en respuesta a hipoxia. También funciona como factor de permeabilidad vascular, contribuyendo a proliferación endotelial, promoviendo la filtración extravascular de proteínas plasmáticas y la formación de un gel de fibrina, que funciona como sustrato para el crecimiento endotelial y tumoral. Sin importar la naturaleza del cambio genético angiogénico, la vasculatura tumoral total puede ser incrementada por VEGF inducido por hipoxia. Antagonizar al VEGF puede entonces eliminar el anticipado segundo estímulo angiogénico. Más aún, VEGF funciona como factor de sobrevida para vasos sanguineos inmaduros que requieren la presencia continua de VEGF, que luego se convierten en independientes de VEGF al madurar y acoplan células periendoteliales. Recientemente se ha demostrado que VEGF prolonga la sobrevida de células endoteliales humanas induciendo la expresión de la proteína antiapoptótica bcl-2. Información reciente ha demostrado también la regulación recíproca del VEGF por el gen p53. Por lo tanto, el retiro de VEGF produce regresión de vasos sanguíneos neoformados.
 Tamaño completo
Tamaño completo RhuMAb VEGF
VEGF circulante, como también los receptores de VEGF son abundantes en el pulmón normal y también en células de NSCLC. Se ha desarrollado un anticuerpo monoclonal recombinante humanizado RuMAb VEGF. Contiene la estructura de la inmunoglobulina G1 (93%) y regiones de unión VEGF complementarias (7%), que bloquea la unión de todas las isoformas a los receptores e inhibe la actividad biológica del VEGF. Los resultados de un estudio fase II de RhuMabVEGF combinado con paclitaxel y carboplatino en NSCLC avanzado fueron promisorios (48)
DC101
Es un anticuerpo monoclonal que se une en forma específica a VEGFR-2 murino. Ha demostrado inhibición del crecimiento tumoral y metástasis in vivo. Tratamiento de combinación de DC101 y una dosis baja de Vinblastina resultó en una regresión sostenida en modelos tumorales en animales sin aumento concomitante de toxicidad del huésped o resistencia adquirida de droga (49). El interés en el uso de dosis bajas en forma continua o quimioterapia de mantención usando agentes convencionales se ha generado por la observación que existe efecto en las células endoteliales tumorales. La actividad clínica de este agente aún está por demostrarse.
SU 5416
Es una molécula sintética que actúa como inhibidor competitivo reversible de la unión de ATP del VEGFR2. También muestra inhibición de c-kit y PDFR. Las toxicidades que limitaron la dosis en estudios fase I fueron cefalea, náuseas y emesis severa. A pesar de su corta vida media, demuestra actividad de vida media larga aun cuando se administre en forma infrecuente (intravenoso 2 veces por semana)debido al secuestro intracelular, lo que resulta en efecto inhibitorio persistente incluso luego de que los niveles extracelulares sean indetectables (50). Una formulación oral, de administración una vez por día, mostró biodisponibilidad aceptable y está siendo evaluada usando varios esquemas.
SU 6668
Es un inhibidor competitivo de la unión de ATP al receptor tirosina kinasa de segunda generación, amplio espectro y activo en forma oral. Este mecanismo es similar al de los bioflavonoides y distinto de los derivados de tirofostin como la leflunomida, que compite por el sitio de unión del sustrato del receptor de tirosina kinasa (51). Posee propiedades antiangiogénicas y antiproliferativas mediante el bloqueo de la autofosforilación del receptor de c-kit, VEGF, FGF y PDFG. Toxicidades leves a moderadas informadas fueron cefaleas, fatiga, disnea, nauseas, diarrea y discomfort abdominal. Esta droga causa también una descoloración amarilla brillante de la orina.
ZD 6474
Es un inhibidor nanomolecular de VEGF-R2 tirosin kinasa, biodisponible en forma oral. También ha mostrado alguna actividad contra la EGFR (erbB1) tirosin kinasa. Estudios pre-clínicos muestran que ZD 6474 produce regresión tumoral en varios grados sin importar el tamaño del tumor. Resultados iniciales de estudios fase I muestran toxicidad mínima (52).
Angiozima
El descubrimiento de que los ribosomas, RNAs que tienen actividad metaloenzimática pueden catalizar RNA splicing y corte, estimuló su desarrollo como agentes terapeúticos que pueden suprimir la expresión de proteínas no requeridas, catalizando el corte de los mRNAs. Angiozima es un ribosoma sintetizado químicamente, nucleasa resistente dirigido en contra de mRNA de flt-1(VEGF-R1). Puede ser administrado por via intravenosa o subcutánea. Ha demostrado superioridad a los ribosomas anti VEGF-R2 en su inhibición dosis dependiente de crecimiento tumoral primario y metástasis pulmonares en un modelo sinérgico murino de cáncer de pulmón altamente metastásico (53). Ha sido bien tolerado, como lo demuestran estudios fase I y II recientemente reportados.
Squalamina
Squalamina lactato (MSI-1256F), un extracto natural de aminosterol aislado de hígado de un tiburón Squalus achanticus, tiene similitudes estructurales a esteroides angioestáticos.
Se cree que inhibe el crecimiento de nuevos vasos sanguíneos inhibiendo en forma selectiva al intercambiador de Na+ H+ (NHE3), produciendo cambios en la forma celular endotelial que llevan a estrechamiento del lumen, oclusión del flujo sanguíneo e inhibición de la proliferación celular (54). Si bien squalamina no muestra actividad como agente único, la combinación con compuestos platinados resulta consistentemente en inhibición tumoral significativa comparado con el compuesto de platino por sí solo, mientras que la combinación con paclitaxel, gemcitabine, docetaxel o vinorelbina no muestra mejor efecto que en estudios pre-clínicos.
Inhibidores de angiogénesis endógenos
En algunos modelos experimentales, un tumor primario puede suprimir metástasis pulmonares o el crecimiento de otro tumor en un sitio remoto. Se piensa que esta inhibición se podría atribuir al factor antiangiogénico circulante producido por el tumor primario. En apoyo a este concepto está el descubrimiento de eventuales inhibidores circulantes de angiogénesis, angiostatina y endostatina, que son producidos por el tumor primario como resultado de degradación proteolítica de proteínas endógenas que tienen roles fisiológicos en sus formas intactas.
Angiostatina, un fragmento interno del plasminógeno, se une a la subunidad a/b de una ATP sintetiza unida a membrana en las células endoteliales (55). Endostatina, un fragmento carboxiterminal del colágeno XVIII es un inhibidor de vida media corta más potente que parece afectar los niveles intracelulares de proteínas antiapoptóticas como bcl-2 (56). La administración exógena de estos inhibidores ha demostrado inducir regresión de tumores macroscópicos sólidos. Se ha demostrado sinergia entre dos moléculas angiostáticas in vivo con la regresión sostenida e inactividad de carcinomas de pulmón. Resultados preliminares de estudios fase I muestran que estos agentes son bien tolerados, si bien los resultados obtenidos en animales están por verse.
La matriz extracelular como objetivo
Metaloproteinasas de matriz (MMPs) Las MMPs son una familia de enzimas responsables de la remodelación de la matriz extracelular en el proceso de crecimiento y morfogénesis, por lo que han sido implicadas en metástasis y angiogénesis. Hasta la fecha se han identificado 22 miembros. Se han desarrollado varios inhibidores de MMP (MMPI) contra varias isoformas. Los más estudiados de estos agentes son marimastat, el primer inhibidor sintético activo oralmente y prinomastat (AG3340). Se han observado toxicidades musculoesqueléticas, particularmente para marimastat. Análisis recientes de estudios fase III aleatorios placebo-control de estos agentes en SCLC y NSCLC, no mostraron beneficio en la sobrevida ni prolongación del tiempo de progresión de la enfermedad (57). Los resultados negativos de otro estudio de MMPI, BAY 12-9566, han disminuido el entusiasmo por esta clase de compuestos.
BMS- 275291: es un MMPI no peptídico biodisponible oralmente, que exhibe efectos antiangiogénicos en varios ensayos e in vivo inhibe el crecimiento tumoral y metástasis. Ha demostrado actividad inhibitoria potente contra MMP-2 y MMP-9 en estudios pre-clínicos. A diferencia de otros MMPIs, este compuesto no inhibe el corte del dominio extracelular del receptor del factor de necrosis tumoral, que se piensa que es responsable de algunos efectos musculoesqueléticos causados por MMPIs. Estudios fase I muestran buena tolerancia, y no se han visto toxicidades que limiten la dosis.
Col-3. La tetraciclina y sus derivados inhiben la actividad de la colagenasa mediante mecanismos incluyendo quelación del zinc en el sitio activo de MMP, down regulación, inhibición de la activación oxidativa o aumento de la degradación de la proenzima. Col-3 (metastat), una sanciclina 4-dedimetilamino, es un derivado lipofílico sintético de la tetraciclina, activo oralmente, con vida media larga que es modificado estructuralmente para eliminar la actividad antimicrobiana que aún retiene como MMPS( particularmente de MMP-2 y 9). Está siendo evaluado en estudios fase I en combinación con quimioterapia y en fase II como agente único. Este agente parece ser bien tolerado, siendo los efectos adversos más comunes la fotosensibilidad y la fatiga (58).
Neovastat (AE 941), obtenido de extracto de cartílago de tiburón, ha demostrado propiedades antitumorales y antimetastáticas en modelos experimentales (59). Se dirige a varios procesos de la angiogénesis, incluyendo la vía de señales de VEGF, MMPS e inducción de apoptosis de células endoteliales. Los efectos apoptóticos se correlacionan con un aumento de la actividad de caspasa-3 y 8. Neovastat también estimula la expresión de angiostatina en glioblastoma experimental. Un estudio fase II de cáncer de pulmón refractario reportó una promisoria evidencia de actividad, disminución en el consumo de analgésicos, en la baja de peso y la progresión tumoral. La sobrevida media fue mayor que la esperada de controles históricos. Entre 124 pacientes con cáncer de pulmón que recibieron tratamiento, un análisis de un subgrupo de 48 pacientes con NSCLC recurrente localmente o metastásico refractario, demostró mejoría en la sobrevida dosis dependiente.
Integrinas: Vitaxin
Otra area de intervención en el proceso angiogénico es a nivel de la adhesión de las células endoteliales a componentes de la matriz extracelular, proceso mediado por integrinas. Se ha visto que los receptores de integrinas anb3 están presentes en la superficie del endotelio angiogénico pero no en el endotelio quiescente. En estudios pre-clínicos antagonistas de anb3 como el anticuerpo específico, LM609, ha demostrado disminuir la angiogénesis, inducir regresión tumoral e inducir apoptosis en las células endoteliales angiogénicas (60). Vitaxin es un anticuerpo monoclonal humanizado derivado del ratón LM609, dirigido contra la integrina anb3. En estudios fase I no se ha observado toxicidad a ninguna de las dosis probadas y no ha habido ningún paciente que deba detener la terapia debido a algún efecto adverso. Los efectos adversos más comunes fueron fiebre, calofrios, nausea y flushing, efectos comunes a la infusión de anticuerpos.
EMD 121974 (cilengitide) es un inhibidor pentapeptídico sintético (administrado en forma intravenosa) cíclico de las integrinas anb3 y anb5, que son expresadas en vasos sanguíneos que están cursando con angiogénesis. Estudios in vivo mostraron inhibición de la angiogénesis y del crecimiento en tumores injertados. La toxicidad no hematológica fue leve y consistió en náuseas, anorexia, fatiga y astenia. No se ha reportado ninguna toxicidad hematológica, ni toxicidad limitante de dosis hasta ahora (61).
Antígenos asociados a tumores
Gangliósidos
Numerosos antígenos de superficie de células tumorales han sido identificados como objetivos potenciales de la inmunoterapia. En SCLC, estos incluyen a los gangliósidos GM2, GD2, GD3, 9-0 acetil GD3, y Fucosil GM1 (Fuc Gm1). Fuc- GM1 es el más restringido en su expresión en tejidos normales. La expresión de GD3 es limitada, encontrándose en el cerebro, tejido conectivo y el subtipo de células T. Sin embargo, las dos son expresadas en muchos de los SCLC (62). Respuestas clínicas observadas en pacientes con melanoma luego de inmunoterapia con anticuerpos monoclonales contra GM2, GD2 y GD3 demostraron la utilidad de los gangliósidos como objetivos. Además, inmunidad natural o inducida contra gangliósidos se ha asociado con mejor pronóstico. GD3 es poco inmunogénico en humanos, requiriendo un anticuerpo monoclonal antiidiotípico que lo imita, BEC2 (mitumomab) en adición al Bacilo Calmette Guerin (BCG) para tener actividad clínica. Fuc-Gm1 tiene una distribución en tejidos normales más restringida que GD3 y se cree más inmunogénico. En un estudio fase I, pacientes con SCLC en estadio límite que alcanzaron respuesta parcial o completa fueron vacunados con BEC-2 y BCG. Aquellos que desarrollaron anticuerpos anti GD3 tuvieron una sobrevida más prolongada en comparación a controles históricos. Los pacientes sin respuestas medibles de anticuerpos anti GD3 también tuvieron una sobrevida libre de recaída prolongada, reflejando las limitaciones de los ensayos inmunoabsorbentes unidos a enzimas (63).
Resultados similares se obtuvieron en otro estudio fase I que usó vacuna conjugada Fuc-GM1. Reacciones locales en piel fueron la toxicidad más común en ambos. En el último estudio se observó una neuropatía sensitiva leve, presumiblemente por la expresión de Fuc-GM1 en las neuronas.
Antígeno carcinoembrionario
CEA es otro antígeno de membrana asociado a tumores, pertenece a la superfamilia de los genes de inmunoglobulinas (64), cuya expresión puede ser reconocida por linfocitos T citotóxicos en el contexto de un complejo de MHC (Complejo mayor de histocompatibilidad) en la superficie de las células tumorales. Se puede encontrar en tejidos epiteliales normales como también en el 80% de NSCLC, especialmente adenocarcinomas y hasta 29% de SCLC, pero mínimamente en tejidos adultos. Su expresión ha sido relacionada con adhesión celular y posiblemente con metástasis.
Se están realizando numerosos estudios usando virus con defectos de replicación como vectores que contienen el gen CEA, con y sin coestimulación inmune.
Antígenos MAGE
La familia de genes humanos MAGE codifican productos que pueden ser reconocidos por las células T citotóxicas autólogas. Los genes MAGE son silentes en la mayoría de los tejidos normales (excepto testículos), pero se activan en una variedad de lesiones neoplásicas. Un ejemplo es el MAGE-A4, que se expresa en 51% de los carcinomas de pulmón (65). Los antígenos MAGE que son reconocidos por linfocitos T citotóxicos son compartidos por muchos tumores y son estrictamente tumores específicos. Por lo tanto, los antígenos MAGE representan objetivos ideales de la inmunoterapia.
Vacuna de tumor autólogo
La definición molecular de antígenos tumorales permite el desarrollo racional de vacunas para el cáncer basadas en péptidos (66). Sin embargo, la respuesta a estas vacunas es variable. Aun así, se pueden lograr respuestas inmunológicas eficaces si se administran en conjunto con adyuvantes inmunes. Un acercamiento más reciente es el uso de vacunas génicas modificadas en las que la secreción de citokinas puede ser introducida dentro de células tumorales in vitro para aumentar la inmunogenicidad de la vacuna. Los resultados de la vacunación con células tumorales autólogas que secretan citokinas, incluyendo el factor estimulante de colonias granulocito-macrófago (GM-CSF), son estimulantes en muchos modelos tumorales (67). La evidencia sugiere que GM-CSF es el estimulante más potente para mejorar la respuesta inmune antitumoral. Sin embargo, la terapia con vacunas raramente ha inducido remisión de tumores grandes y es poco probable que cualquier inmunoterapia sea útil en el tratamiento de tumores grandes.
A pesar de esto, la primera vacuna GM-CSF modificada génicamente, irradiada, paciente específica de células tumorales pulmonares (GVAX), en un estudio con NSCLC avanzado demostró actividad antitumoral mejorada. Dos pacientes permanecen libres de enfermedad por más de 3 años después del tratamiento. Resultados preliminares de un estudio reciente fase I/II de NSCLC temprano y avanzado mostró que, en 26 pacientes en etapa tardía, la mayoría de los cuales no había respondido a la quimioterapia o radioterapia, 3 de ellos mostraron respuesta completa sostenida por 9 a 16 meses. Además de estas respuestas, 7 pacientes lograron estabilizar la enfermedad con una duración media de 6 o más meses. Por último, 8 de 10 pacientes con enfermedad temprana que recibieron la vacuna de cáncer pulmonar GVAX ,luego de cirugía, actualmente permanecen libre de enfermedad con un seguimiento promedio de 12 meses.
Discusión
En los últimos años el conocimiento de las bases moleculares del cáncer ha permitido el desarrollo de nuevas terapias cuyo objetivo ha sido la modificación biológica del curso natural del cáncer. Avances en el entendimiento de cómo la célula tumoral pulmonar difiere de las células epiteliales bronquiales normales han llevado a nuevos blancos de terapias y prevención de cáncer pulmonar. Entre estos blancos están las proteínas involucradas en señales de cáncer de pulmón tales como: Ras y proteína kinasa C, proteínas involucradas en la apoptosis, antígeno de superficie celular involucrado en la vigilancia inmune y los genes supresores de tumores cuya función puede ser reemplazada por terapia génica, así como también señales para el control del ciclo celular y angiogénesis.
Sin embargo, los resultados obtenidos por cada una de estas terapias son diferentes, por ejemplo, en relación a la terapia de manipulación inmunogénica las respuestas han sido subóptimas.
Sobre la base de los estudios pre-clínicos y clínicos de la terapia génica, el uso de inyección localizada de Ad-p53 para sensibilización de la radiación en tumores locales resistentes a la radiación son de gran potencial. Por otro lado el sinergismo de la inducción de la apoptosis cuando la terapia génica está combinada con quimioterapia ofrece un gran potencial para el aumento de las terapias preexistentes, sin un aumento de la toxicidad. Se necesitan ahora estudios Fase III para determinar si el aumento del control locorregional por Adp53, solo o con quimioterapia convencional, lleva a mejorar la sobrevida y calidad de vida en pacientes con NSCLC.
En otro ámbito, las anormalidades genéticas de los genes supresores de tumor (TSGs) se ven en cáncer de pulmón, esto también puede ser detectado como cambios preneoplásicos en el epitelio bronquial normal de pacientes con cáncer de pulmón así como también en el pulmón de fumadores.
Además de las mutaciones de secuencias en el DNA, otro mecanismo observado es la adquisición de promotores de la metilación para la inactivación de los genes supresores de tumores. Este mecanismo epigénico de inactivación de expresión génica es reconocido como un mecanismo frecuente de pérdida de función de TSG en la patogénesis de cáncer de pulmón. El hallazgo de esta metilación aberrante en lesiones preneoplásicas puede hacer de estas secuencias metiladas un marcador ideal para la detección precoz de cáncer de pulmón, así como la evaluación del riesgo de cáncer de pulmón y monitorizar la quimioprevención. Por otro lado se han desarrollado fármacos contra esta metilación.
La mayoría de los pacientes con NSCLC expresan el receptor del factor de crecimiento epidermal (EGFR) y su ligando natural, el factor crecimiento transformante alfa (TGFa). Compuestos pueden bloquear el efecto de este receptor: inhibir el crecimiento, proliferación e invasión y aumento de apoptosis. Estos agentes pueden promover regresión objetiva y mejoría de síntomas en pacientes con NSCLC que son refractarios a la quimioterapia citotóxica. El éxito alcanzado en estos estudios pre-clínicos y clínicos en pacientes con cáncer de pulmón a través del bloqueo de EGFR y la interrupción de las señales intracelulares han llevado a establecer a estos agentes como la principal terapia blanco en cáncer de pulmón.
A pesar de estas múltiples áreas de investigación y con algunos resultados prometedores existen puntos aún no resueltos como es el hecho del uso de estas terapias en forma aislada, ya que se podría sospechar un efecto potenciador al ser asociados a quimioterapia o combinando distintos agentes que actúan a distintos niveles. Sin embargo el hecho de que no se conozcan aún completamente las vías de señales, los entrecruces, sobreposición o eventualmente antagonismo por los distintos agentes hace que estas terapias aún permanezcan con muchas interrogantes.
Un área de interés es el uso de estos agentes como terapias de mantención, pero también se ha estado estudiando su rol como quimioprofilaxis en enfermedad micrometastásica y enfermedad mínima residual. También el cambio de los diseños de los estudios actuales basados en respuesta tumoral es otro punto relevante para evaluar la eficacia de estas nuevas drogas. Obstáculos predecibles como el uso de end point tiempo de progresión tumoral, incluyen: estudios muy largos y costosos con grandes seguimientos para la evaluación estadística de los resultados, además de lo que significa la heterogeidad de los seguimientos. Así, se debería usar un método más uniforme para evaluar el tiempo de progresión tumoral, como por ejemplo: evaluar la proporción de pacientes que no han progresado en un determinado período, por ejemplo, cada seis meses. Finalmente, quedan aún muchas preguntas por responder, pero estas terapias más específicas parecen ser muy prometedoras y en el caso de cáncer de pulmón los inhibidores de las señales celulares parecen ser los agentes más promisorios. Los inhibidores de EGFR tirosin kinasa podrían ser los primeros en ser aceptados para este propósito, y también combinados en forma paralela con los agentes que actúan en las vías de traducción de señal.

