Cursos
← vista completaPublicado el 1 de junio de 2005 | http://doi.org/10.5867/medwave.2005.05.3550
Tratamiento de infecciones fúngicas nosocomiales en el paciente adulto
Treatment of nosocomial fungal infections in adult patients
Resumen
Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
Introducción
El término nosocomial es difícil de aplicar en las infecciones fúngicas, porque, con excepción de la candidiasis sistémica, especialmente la adquirida en la UCI a través del catéter, las demás no son nosocomiales propiamente tales; pero un paciente que esté inmunocomprometido en algún grado puede adquirirlas dentro del hospital, aunque no sean estrictamente del nosocomio.
Los hongos son estructuras uni o pluricelulares, microscópicas o macroscópicas. La mayoría de ellos están presentes en el medio ambiente, pero algunos, denominados endógenos, viven en el organismo humano, específicamente los del género Candida, que habitan en el tubo digestivo. A pesar de que causan enfermedades gravísimas, tienen un papel ecológico importante, ya que participan en la cadena de fijación del nitrógeno a la raíz de las plantas; por lo tanto, su presencia no es casual, pero sí es casual que provoquen enfermedades en el hombre, lo que ocurre cuando se dan algunas características.
Infecciones micóticas
Las infecciones micóticas se pueden agrupar en superficiales, que comprometen piel y fanerios y que en su mayoría son tratadas por el dermatólogo, y profundas o sistémicas, que comprometen distintos órganos. Desde el punto de vista epidemiológico, hay dos categorías de infecciones por hongos.
La primera corresponde a las micosis endémicas, que son las que están circunscritas a una zona geográfica o relacionadas con ella. Estas infecciones no existen en Chile, afortunadamente, porque pueden ser bastante graves y complejas (y porque no es necesario aprenderlas de memoria), pero se las puede adquirir en el extranjero, de modo que es importante saber reconocerlas; ejemplos de este tipo de micosis son la blastomicosis, la histoplasmosis y la coccidioidomicosis.
La otra categoría es la de las micosis oportunistas, que se ven en Chile y en todo el mundo y cuya causa son los hongos del medio ambiente o endógenos que, aprovechando una condición anómala del paciente, provocan una infección. Este comportamiento no es exclusivo de los hongos; hay muchas bacterias capaces de producir infecciones oportunistas.
Nuevas situaciones
La población de pacientes susceptibles ha aumentado y continúa aumentando, ya que cada día se realizan más trasplantes de distintos tipos de órganos y se utilizan terapias inmunosupresoras cada vez más eficaces, por lo que los pacientes sobreviven más tiempo y sufren mayor riesgo de infecciones. También contribuye a esta situación el numeroso grupo de los pacientes con VIH/SIDA; los pacientes oncohematológicos sobrevivientes de las quimioterapias; los pacientes con tumores sólidos; y los pacientes críticos de las UCI. Aunque este último grupo está muy relacionado con un solo tipo de infección fúngica, que es la candidiasis sistémica, la UCI se ha transformado en un escenario de especial importancia, no sólo desde el punto de vista micológico, sino también en términos de diagnóstico y dificultad terapéutica.
Ha ocurrido una emergencia de hongos inhabituales que están causando patologías graves. En la medida en que se ha avanzado en el control de los hongos habituales, ocupan esos nichos unos hongos emergentes, como Fusarium, Acremonium, Pseudallescheria boydii, Trichosporon asahii, Penicillium marneffei y Cladophialophora bantiana. Penicillium marneffei es un problema gravísimo, en este momento, en toda la zona asiática, porque es resistente a la mayoría de los antifúngicos. En cuanto a Cladophialophora, tuvimos la desgracia de conocerla hace un par de años en un paciente sin inmunodepresión, que llegó con un absceso cerebral y falleció, confirmando el hecho de que este hongo es capaz de producir patología en pacientes inmunocompetentes. Todos estos hongos traducen una mayor gravedad.
Han emergido cepas resistentes de hongos habituales, como Criptococcus, Mucor, Aspergillus, Candida albicans y Candida no albicans. El principal problema está en Candida albicans, que antes era muy sensible a todos los azoles, pero que ahora presenta un porcentaje poco sensible. La Candida no albicans también se ha convertido en un problema grave, ya que se observa un aumento significativo de las infecciones graves por este tipo de microorganismo en pacientes inmunocomprometidos, con VIH, SIDA, oncohematológicos y críticos, situación que origina muchos casos de candidiasis sistémica en UCI, que es un tema muy relevante. Ocupa entre el cuarto a quinto lugar entre los patógenos aislados en cuadros infecciosos en UCI, a la par con el Estafilococo meticilino resistente, el Acinetobacter, la Pseudomona, etc.
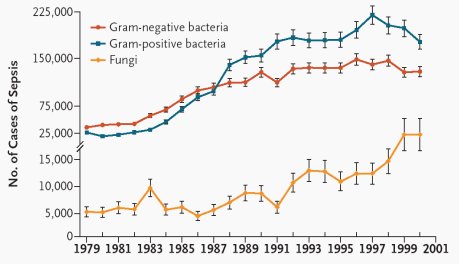
En la Figura 1 se resume los resultados de un estudio publicado por Martin en New England Journal of Medicine, en 2003, acerca de los microorganismos causantes de sepsis en los Estados Unidos en los veinte últimos años, en el que se observó que los grampositivos han aumentado más que los gramnegativos; pero lo más dramático es que las infecciones fúngicas han aumentado en forma exponencial. Entonces, en los pacientes críticos ya no sólo se debe pensar en una bacteria como causante de los cuadros sépticos, sino que también se debe tener presente la etiología fúngica.
 Tamaño completo
Tamaño completo Figura 1. Número de casos de sepsis en los Estados Unidos, según microorganismo causal, entre 1979 y 2000 (Martin G., NEJM 2003; 348:1546-1554).
De todas las infecciones fúngicas nosocomiales, en 80% de los casos corresponden a especies de Candida. Una de las más frecuentes es la candidiasis relacionada con el catéter urinario; en segundo lugar, la candidiasis adquirida por catéter venoso central; y, en tercer lugar, la candidiasis sistémica propiamente tal. El otro 20% corresponde a las infecciones micóticas de los pacientes oncohematológicos, como fusariosis, aspergilosis, mucormicosis, etc. La mortalidad de las infecciones sistémicas permanece elevada y depende de las características de los pacientes, tipo de hongos, etc., oscila entre 25% y 60%.
A continuación se revisará las micosis de impacto nosocomial, que son las que afectan a los pacientes hospitalizados, críticos o inmunocomprometidos, es decir, son de aparición reciente en pacientes oncohematológicos y neutropénicos. Los principales agentes causales son Mucor, Aspergillus, Fusarium y Candida.
Mucormicosis
El Mucor es un hongo filamentoso que está presente en el ambiente, sobre todo en la materia orgánica en descomposición. En general tiene baja virulencia, pero en pacientes susceptibles puede causar cuadros fulminantes, con 70% a 80% de mortalidad; incluso, en algunas series se ha comunicado tasas de 90% a 95%; es decir, es muy agresivo. Las especies más frecuentes son Rhizopus, Rhizo Mucor, Mucor y Absidia. En los estudios que se han hecho en Chile, la especie más frecuente es Rhizo Mucor y la menos frecuente es Rhizopus. Todos pertenecen al mismo género.
Entre los factores de riesgo cuya presencia debe despertar la sospecha de Mucormicosis, los más importantes son la diabetes mellitus y la insuficiencia renal crónica con acidosis. Después, los pacientes transplantados que reciben terapia antirrechazo, como bolos de corticoides, anticuerpos monoclonales. Por último, las neoplasias de origen hematológico, que comprometen la médula y provocan agranulocitosis por sí mismas, por invasión, y la neutropenia primaria o secundaria. En estos pacientes se debe sospechar, sobre todo en un cuadro clínico muy específico, la presencia de Mucor.
Las manifestaciones clínicas más conocidas son las siguientes. La primera es la manifestación craneal, que puede tener distintas formas: rino-óculo-cerebral, rino-sinusal-facial y otomeníngea. El hongo ingresa por las cavidades nasales, pasa a las cavidades sinusales, compromete la zona orbitaria e invade al cerebro; se caracteriza por ser angioinvasivo; es decir, se introduce dentro de los vasos sanguíneos, donde desarrolla sus filamentos, trombosa los vasos y provoca necrosis.
La segunda forma, igualmente agresiva, es la pulmonar, que puede ser invasiva o no invasiva; en esta última, se coloniza la vía aérea como ocurre con Aspergillus, que se desarrolla en cavidades tuberculosas antiguas, lo que también puede hacer el Mucor. La forma pulmonar invasiva, que invade los vasos sanguíneos y causa trombosis, infartos, necrosis, áreas hemorrágicas, embolías a distancia, etc., es un verdadero desastre.
En tercer lugar está la forma diseminada, en la que se presenta compromiso multiorgánico. La mucormicosis rinoorbitaria, que evoluciona con placas necróticas en las etapas avanzadas, se ve principalmente en pacientes diabéticos y se caracteriza por la aparición brusca de una zona inflamatoria facial, similar a una celulitis periorbitaria progresiva, a la que luego se agrega proptosis y una secreción nasal negruzca o hemorrágica. El estudio debe hacerse con el otorrinolaringólogo, quien tomará una biopsia y encontrará el Mucor.
El tratamiento es muy difícil de llevar a cabo; frente a un cuadro avanzado, con compromiso pulmonar, rinocerebral o facial, es indispensable hacer una cirugía agresiva extensa, que muchas veces significa una hemicarectomía, similar a la que se efectúa en el cáncer maxilar y de cuello, con vaciamiento de toda la zona, exanteración orbitaria, etc. El procedimiento es muy dramático, pero es la única manera de salvar a estos pacientes o, al menos, darles una oportunidad de sobrevivir.
El medicamento con el que se tiene mayor experiencia es la anfotericina B, pero hasta hoy los índices de mortalidad son muy elevados, sobre todo en los pacientes con diagnóstico tardío y en aquellos cuya condición basal no se ha podido manejar de manera adecuada, como los diabéticos muy descompensados, con acidosis graves; en esos casos, lo más probable es que el tratamiento con anfotericina fracase, a pesar de que se haga por tiempo prolongado y en dosis acumulativas altas (3 a 4 gramos), tal como está indicado. La alternativa es la anfotericina B liposomal, cuya indicación principal, en este momento, es la mucormicosis, ya que el uso prolongado y las dosis altas de anfotericina deoxicolato acarrean efectos tóxicos y compromiso renal, por lo que probablemente el paciente terminará en diálisis. La anfotericina B liposomal es mucho menos tóxica y permite lograr estos mismos objetivos con menos daño, por lo que sería la opción ideal.
Entre los nuevos antifúngicos que todavía están en estudio, el más prometedor es el posaconazol; el voriconazol, que está disponible en Chile, no tiene efectos sobre los Mucorales, como tampoco las equinocandinas; es muy probable que a futuro el posaconazol sea una muy buena alternativa, aunque la tendencia actual es la terapia combinada. Es probable que en pacientes de difícil manejo, que necesitan terapias de salvataje, el mejor resultado se conseguirá con una terapia combinada de anfotericina B liposomal más posaconazol.
Aspergilosis
El Aspergillus es un hongo filamentoso que vive en el medio ambiente; la aparición clásica es en los rincones de los baños y en la superficie del pan y de las naranjas. Sus reservorios son la tierra de plantas ornamentales, los basurales, las excavaciones y los ductos de aire acondicionado.
Cuando se realizan ampliaciones en hospitales y clínicas, las excavaciones o movimientos de tierra ponen en circulación miles de millones de esporas de Aspergillus, con lo que aumenta la probabilidad de que las aspiren pacientes inmunocomprometidos; no es raro entonces que, en dichas situaciones, ocurra un leve incremento de la tasa de infecciones por Aspergillus en la subpoblación de pacientes inmunocomprometidos, en especial en los pacientes oncohematológicos y neutropénicos. Las especies aisladas más importantes son A. fumigatus, A. niger, A. flavus y A. terreus.
La principal puerta de entrada es la respiratoria; de hecho, el ser humano está aspirando constantemente miles de esporas de Aspergillus, pero el organismo se encarga de filtrarlas y eliminarlas, cosa que no ocurre en un paciente inmunodeprimido; éste, evidentemente, va a sufrir una infección cuyo mecanismo de agresión, que comparte con el Mucor, es la invasión de los vasos sanguíneos, trombosis, necrosis y destrucción tisular.
En cuanto a los factores de riesgo, los pacientes neutropénicos, sobre todo los que permanecen en este estado durante largo tiempo, son susceptibles. Una característica común de todos los pacientes neutropénicos es que sus infecciones no se pueden tratar en forma aguda, mientras no se recuperen de la neutropenia. Es una lucha permanente, ya que los pacientes cuya neutropenia es prolongada y profunda, sobre todo si es secundaria a las quimioterapias más agresivas, habitualmente las de rescate, son los que con más frecuencia se infectan con Aspergillus. La terapia esteroidal en altas dosis, sobre todo en bolos, y también la inmunosupresión que se asocia con algunos trasplantes, en especial los pulmonares, pues exigen una inmunosupresión relativamente agresiva para evitar un rechazo, son factores que aumentan la susceptibilidad a la infección por este agente.
Las formas clínicas son variadas. El hongo puede causar una forma de alergia denominada aspergilosis broncopulmonar alérgica, para lo cual coloniza la vía aérea; no la daña ni invade, pero origina reacciones alérgicas y crisis de asma cuyo manejo suele ser relativamente difícil. Puede colonizar cavidades externas, como, por ejemplo, el conducto auditivo externo; e internas, como el clásico aspergiloma o bola fúngica que aparece en una cavidad antigua secundaria a tuberculosis y que es una verdadera bola de hongos.
La forma más llamativa ocurre cuando el hongo invade y puede causar compromiso de las cavidades sinusales, compromiso pulmonar, que es el cuadro más grave, y compromiso cerebral. La aparición de un nódulo con una zona reblandecida, causado por Aspergillus, en la radiografía de tórax, significa que el paciente tiene 99% de probabilidades de morir. La otra forma, menos frecuente, es la que se debe a toxinas, principalmente Aspergillus flavus, y que se ve clásicamete en personas que comen maní crudo, sin tostarlo, excelente medio de cultivo para este agente.
En el último tiempo se ha preconizado bastante la tomografía computada (TC) de tórax, especialmente en los pacientes neutropénicos, para hacer el diagnóstico precoz. En un paciente neutropénico febril, que no responde a los tratamientos antibióticos de primera línea, se debe sospechar la presencia de una micosis invasora, probablemente una aspergilosis pulmonar. En este caso, la TC es un arma muy útil que permite ver el signo del aro, con una zona un poco más clara alrededor de la lesión numular, y el signo de la medialuna o de la zona crescéntica, que demuestra que el hongo está destruyendo progresivamente el tejido pulmonar.
El diagnóstico precoz, indispensable para efectuar un tratamiento oportuno, depende de que se sospeche esta etiología en determinadas situaciones clínicas: por ejemplo, un paciente diabético con acidosis, que presenta una lesión en la zona orbitaria, en el que se debe plantear Mucor hasta que se demuestre lo contrario; o un paciente neutropénico febril que no responde a antibióticos, sino que más bien empeora y presenta compromiso respiratorio, en cuyo caso se debe plantear como primera probabilidad una aspergilosis pulmonar invasora.
Además de la TC, que es útil para hacer el diagnóstico precoz, también se puede determinar antigenemia mediante la técnica Platellia AspergillusTM, que detecta el antígeno galactomanano del Aspergillus. Esta técnica, que es una ELISA doble sandwich, es bastante sensible, específica y precoz y se correlaciona muy bien con el desarrollo de infección. La reacción de polimerasa en cadena (PCR) no demuestra las mismas características; es muy específica, pero no siempre se relaciona con el desarrollo de infección, porque permite ampliar material genético del Aspergillus, pero no necesariamente corresponde a una infección.
El tratamiento debe ser precoz. La droga de elección, que todavía es el patrón de comparación, es la anfotericina B en dosis altas y por tiempo prolongado; sin embargo, lamentablemente los resultados son malos, no por falta de eficacia de la droga, sino porque los pacientes están muy inmunosuprimidos y, si no se recuperan de la neutropenia, no van a evolucionar satisfactoriamente, a pesar del tratamiento. Aparte de esto, algunas especies de Aspergillus pueden ser resistentes a la anfotericina, como el Aspergillus terreus.
Una alternativa es la anfotericina B en forma lipídica; la liposomal es la que ha tenido mayor porcentaje de éxito y menor toxicidad. El itraconazol, un azol de administración oral, se utiliza habitualmente en aquellos pacientes que logran salir adelante y deben seguir terapia de supresión durante seis meses, un año o, en ciertos casos, de por vida, para que el hongo no vuelva a crecer. El fluconazol no tiene efecto; es un azol con un espectro de acción muy reducido. Otras alternativas buenas son las equinocandinas y el voriconazol.
En Chile está disponible desde hace tres años la caspofungina, que pertenece a una nueva línea de medicamentos antifúngicos; con ella se han obtenido resultados muy favorables en pacientes refractarios a otras terapias o bien, intolerantes, o sea, que han tenido reacciones adversas graves, sobre todo con anfotericina, que es el gold standard. En un estudio presentado en 2002, que todavía no se ha publicado, se demostró claramente que, en tratamientos de salvataje, es absolutamente equivalente a la anfotericina B, pero con pocos o ninguno de los efectos tóxicos de ésta. Así, presenta las ventajas de baja toxicidad y poca resistencia, por el mecanismo de acción (al menos hasta el momento, porque las bacterias, hongos, etc., después de un tiempo se vuelven resistentes); además, potencialmente, se puede utilizar en asociación con otros medicamentos, porque actúan en distintas zonas.
Otro fármaco disponible y eficaz contra la aspergilosis es el voriconazol, un triazol de última generación cuyos resultados son muy satisfactorios como terapia primaria de la aspergilosis invasora y es una buena alternativa para la anfotericina liposomal, como se demostró en un trabajo publicado en New England Journal of Medicine en 2002. La ventaja principal del voriconazol es su baja toxicidad; además, su biodisponibilidad es estupenda, de manera que se puede administrar tanto por vía tanto endovenosa como oral. Se puede partir por la vía endovenosa y terminar el tratamiento por vía oral; incluso, si hay dificultades económicas, se puede partir de inmediato por vía oral, con resultados prácticamente equivalentes. Se absorbe muy bien y también tiene potencial para uso asociado. Su inconveniente principal son las interacciones medicamentosas, ya que, como se metaboliza a nivel de citocromo p450, interactúa con muchos fármacos. Por tanto, en pacientes que utilizan paralelamente múltiples medicamentos, es necesario medir niveles y suspender algunos de ellos.
En una revisión sobre la respuesta de la aspergilosis invasora a diferentes antimicóticos, la conclusión común a todos ellos es la calidad desastrosa de los resultados, como se aprecia en los porcentajes de respuesta:
- anfotericina B de dispersión coloidal (ABCD), respuesta 49%
- anfotericina B complejo lipídico (ABLC), 40%
- anfotericina liposomal (Ambisome), 50%
- anfotericina B deoxicolato (Anfo-B), 23%
- itraconazol, 39%, y se debe considerar aquí que es un tratamiento de supresión
- posaconazol, 53%
- voriconazol, 51%
- caspofungina, 45%
Fusariosis
El Fusarium es cada vez más común, debido al aumento progresivo de los pacientes oncohematológicos con neutropenia. Es un hongo filamentoso, hialino, septado, que se encuentra como saprófito del suelo y como patógeno de plantas y bacterias; en general, se encuentra en todas partes. Hay 50 especies dentro del género, de las cuales las más comunes son Fusarium solani, F. oxysporum, F. moniliforme y F. verticillioides. El F. solani es el más frecuente y causa la mitad de los casos de fusariosis invasoras en seres humanos; además, es el más virulento y el más difícil de tratar.
La frecuencia de los Fusarium ha aumentado; en algunos centros es la segunda causa de infecciones por hongos filamentosos, después de Aspergillus. En 90% de los casos se adquiere por la vía respiratoria (material aerolizado), proveniente del ambiente externo o de fuentes de agua nosocomiales; un porcentaje menor, alrededor de 10%, se adquiere a través de la piel, pero es mínimo; generalmente, la puerta de entrada es una onicomicosis asociada con paroniquia.
Los factores de riesgo son muy similares a los de Aspergillus: neutropenia prolongada, uso de esteroides en altas dosis y enfermedad de injerto contra huésped (Graft-versus-host disease o GVHD).
En cuanto a las formas clínicas, en los inmunocompetentes las infecciones suelen ser más leves y son: queratitis (asociada o no con lentes de contacto); endoftalmitis en los casos graves; onicomicosis, que es bien particular, con paroniquia; artritis; osteomielitis; otitis, sinusitis; absceso cerebral y fungemia asociada con vía venosa central. También causa peritonitis asociada con diálisis peritoneal. De todos los hongos, en especial los filamentosos, éste es el más fácil de aislar en hemocultivos. En los inmunocomprometidos, 90% de los casos ocurren en neutropénicos con cáncer, sobre todo con leucemia, a la que corresponden 50% de los casos comunicados; es bastante menos frecuente y menos invasor en trasplantados de órganos sólidos. Es muy frecuente en los pacientes con neoplasias hematológicas o trasplantados de médula ósea con inmunosupresión agresiva.
Se presenta en cuatro formas: cuadro de fiebre persistente; infección diseminada; compromiso de las cavidades sinusales y pulmón o neumonía; e infección localizada. Como ocurre con todas estas infecciones, la letalidad es elevada, de 70% a 100%. La infección diseminada se suele presentar sólo como una fiebre refractaria a terapia antibacteriana y antifúngica, y el hongo puede comprometer cualquier órgano; los más importantes son: cavidades paranasales, pulmones (70%-80%) y piel (70%-90%). En algunos casos se llega al diagnóstico por la presencia de lesiones cutáneas, que son de 3 tipos: nódulos subcutáneos muy dolorosos, lesiones tipo ectima gangrenoso y lesiones tipo target, redondas, con un centro un poco más oscuro. También suele aparecer una miositis fulminante, con mialgias intensas, que, asociada con las lesiones cutáneas y subcutáneas, constituye un cuadro típico.
En la tabla I se compara los trasplantados de médula ósea con los trasplantados de órganos sólidos.
 Tamaño completo
Tamaño completo Tabla I. Características de la infección por Fusarium en los receptores de trasplante de médula ósea (TMO) y de órganos sólidos (TOS). (tx = trasplante).
Fusarium puede producir lesiones parecidas al ectima gangrenoso, pero más grandes y numerosas; Aspergillus también puede dar estas lesiones, pero de menor tamaño, poco numerosas y siempre localizadas. La toma de cultivo y la biopsia del tejido es muy importante; la piel da el dato.
En términos histopatológicos, puede ser difícil distinguir entre Fusarium y Aspergillus; de hecho, muchas veces se informa Aspergillus y termina siendo Fusarium. El cultivo entrega el diagnóstico definitivo, ya que permite hacer el análisis macro y microscópico; los hemocultivos generalmente son positivos (50% a 70%) y se puede hacer PCR de muestras histopatológicas, sangre y lavado bronquio alveolar; no obstante, habitualmente, el cultivo da la clave.
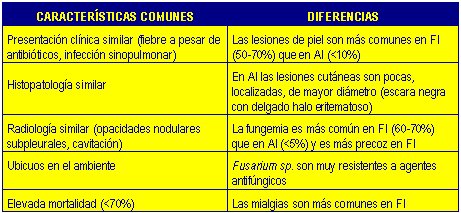
En la Tabla II se resumen las similitudes y diferencias entre la Aspergilosis invasiva y la Fusariosis invasiva.
 Tamaño completo
Tamaño completo Tabla II. Características comunes y diferencias entre aspergilosis invasiva (AI) y fusariosis invasiva (FI).
El tratamiento es difícil, porque es uno de los hongos más resistentes al arsenal de antifúngicos disponible; F. solani es la especie más resistente dentro del género. Tradicionalmente, se ha utilizado anfotericina B deoxicolato, con malos resultados; la susceptibilidad de Fusarium a este fármaco in vitro es mediocre y se necesita dosis altas, de 1 a 1,5 mg/kg/día; las formulaciones lipídicas serían algo mejores (10 a 20 mg/kg/día). Los nuevos triazoles muestran más actividad contra Fusarium; el mejor es el voriconazol, que hemos utilizado con éxito; asociado con anfotericina B liposomal y en dosis altas, sería el mejor tratamiento, además de la cirugía cuando sea necesario. Desde luego, se deben hacer todos los esfuerzos para acortar el período de neutropenia o disminuir la inmunosupresión, en el caso de los trasplantados.
Candidiasis
La Candida es un hongo levaduriforme, unicelular, que se reproduce por yemación. En material orgánico adopta diversas formas (hifas y pseudohifas). A diferencia de los anteriores, la Candida es un hongo que se puede encontrar en el ambiente, en el suelo, en algunos alimentos y en el ambiente hospitalario, pero el reservorio más importante es el organismo humano y animal, específicamente el tracto gastrointestinal y la piel. Se ha identificado 200 especies, pero sólo algunas son patógenas para el hombre; entre ellas C. albicans y las que antiguamente se llamaban no albicans, como C. tropicalis, C. pseudotropicalis, C. parapsilosis, C. krusei, C. lusitaniae, C. guillermondi, C. glabrata y C. famata.
Es muy importante definir de cuál grupo se trata, porque la mayoría de las C. no albicans tienden a ser cada vez más resistentes a los azoles. La C. albicans da la clásica colonia de aspecto algodonoso, en la prueba del tubo germinativo, que es relativamente sencilla, pero se debe tener experiencia. La Candida albicans da pequeñas germinaciones, como tallos, que las Candida no albicans no producen, factor que permite identificarlas rápidamente y orientar el manejo.
Los factores de riesgo para candidiasis son los siguientes:
- neutropenia primaria o secundaria;
- uso de antibióticos de amplio espectro;
- presencia de catéteres venosos centrales (sobre todo si el uso es prolongado); la Candida invade cuando hay pérdida de continuidad, por cirugías, lesiones de la piel, mucositis o permeación del tubo digestivo, y su invasividad aumenta en presencia de catéteres venosos, urinarios, etc., debido a su capacidad para producir una sustancia que le permite adherirse a la superficie de estos elementos;
- colonización previa por Candida, sobre todo en pacientes que tienen varias hospitalizaciones por quimioterapia;
- en gran cirugía, principalmente en la esfera digestiva, porque sobrepasan las barreras, se está abriendo piel, etc.;
- intervenciones múltiples y cirugías complicadas;
- estadía prolongada en UCI;
- múltiples terapias antibióticas;
- pacientes en hemodiálisis, con catéter que favorece la infección;
- nutrición parenteral;
- uso de esteroides o inmunosupresores;
- ventilación mecánica, elemento muy característico del paciente crítico de la UTI, escenario poco habitual para los otros hongos, los que se ven casi exclusivamente en pacientes inmunocomprometidos;
- diabetes mellitus;
- catéteres venosos (periféricos y urinarios).
Entre las formas clínicas, la más interesante es la forma invasora diseminada o forma sistémica, que aparece en pacientes que presentan los factores de riesgo mencionados. Puede haber compromiso de múltiples órganos, del sistema nervioso central, riñón, hígado, ocular, cutáneo, pulmonar, etc., pero lo más importante es que esta forma diseminada tiene como antecedente los factores ya mencionados. Las lesiones clásicas de la piel son pequeñas y diseminadas, completamente distintas a las que produce Fusarium.
La sospecha precoz es primordial. Son pacientes graves, de evolución tórpida, con los factores de riesgo descritos, que presentan compromiso multiorgánico significativo y un cuadro de inflamación sistémica activo, sin origen demostrado. Si después de utilizar tres o cuatro esquemas de tratamiento antibiótico el cuadro sigue activo, se debe sospechar una candidiasis sistémica. Lamentablemente, el diagnóstico es difícil; dentro de lo posible, lo ideal sería obtener cultivos de sangre o líquido estéril, o demostrar su presencia en los tejidos.
El tratamiento consiste en antifúngicos, con cirugía agregada cuando es necesario. Además, se debe manejar el estado basal del paciente, o sea, tratar el cuadro de base, por ejemplo, la diabetes y el compromiso multiorgánico, sin descuidar la terapia de sostén.
Medicamentos antifúngicos: anfotericina
La anfotericina B siempre ha sido el gold standard para el tratamiento de la candidiasis. Es un polieno de amplio espectro que inhibe la síntesis del ergosterol de la membrana citoplasmática, con efecto fungicida, pero es muy tóxico, puede tener efectos adversos agudos durante su administración endovenosa y produce un clásico daño renal glomerular y tubular, que puede llevar al paciente a la diálisis, con aumento de la morbimortalidad. También puede causar depresión medular.
Su administración exige la instalación de un catéter venoso central, lo que puede ser una dificultad. El trabajo clásico de Bates, CID 2001, 32: 686-93, demostró que cuando los pacientes con anfotericina tenían deficiencia renal, su mortalidad aumentaba de 16% a 54% y el costo subía en 30.000 dólares, en la medida en que necesitaban diálisis y se quedaban por un tiempo prolongado en la UTI. La incidencia de daño renal agudo asociado con anfotericina B (definido como aumento de creatinina en 50% del valor basal, con un peak de 2,0 mg/dl o más) es alta: 30%.
Las formulaciones lipídicas tienen menos efectos adversos, con mayor margen de dosificación, y tienden a acumularse en el SRE y no en el riñón. Su uso está aceptado en las micosis invasoras graves, ya que tienen mayor rendimiento que la fórmula clásica.
El principal inconveniente es que su costo es siempre muy alto. Estas formulaciones son ABCL (complejo lipídico), ABCD (dispersión coloidal) y Ambisome (anfotericina B liposomal).
Fluconazol
El fluconazol es un derivado azólico que causa una inhibición muy selectiva de la enzima Lanosterol C14-alfa-demetilasa, dependiente del citocromo p450, y altera la síntesis del ergosterol en la membrana citoplasmática fúngica. Su efecto descrito es fungistático. Tiene vida media larga, buena penetración de la barrera hematoencefálica y pocos efectos adversos, principalmente hepáticos. Está disponible en Chile desde 1985 ó 1986. Dada su excelente biodisponibilidad, se puede usar por vía endovenosa u oral; cuando la Candida albicans es sensible, responde relativamente bien.
En pacientes críticos no neutropénicos con candidemia se demostró una eficacia equivalente a anfotericina B. Aún se acepta su uso como primera indicación en pacientes estables con C. albicans documentada, lo que evita así el uso de anfotericina, pero no tiene efecto contra Aspergillus. En la actualidad, uno de las dificultades principales es la creciente resistencia que han desarrollado a este fármaco C. albicans, krusei, tropicalis y parapsilosis. C. glabrata casi siempre es resistente a los azoles.
Nuevos triazoles
En este grupo están voriconazol, posaconazol y ravuconazol, de los cuales, el más desarrollado es el voriconazol. Tienen el mismo mecanismo de acción que el fluconazol en la síntesis del ergosterol, pero, a diferencia de éste, son activos contra especies de Aspergillus y otros hongos filamentosos (Fusarium); en lo demás son exactamente iguales al fluconazol. El espectro es relativamente amplio: Aspergillus, incluso el terreus, Pseudoallescheria boydii (scedosporium apiospermum), Fusarium, Bipolaria, Alternaria, Curvularia, etc. No tienen actividad contra zygomicetes y Mucorales. Contra levaduras son fungistáticos, pero es suficiente.
El voriconazol es un compuesto antifúngico de amplio espectro, disponible en fórmula oral y endovenosa, con excelente biodisponibilidad. La forma parenteral está contraindicada con clearance de creatinina menor de 50 ml/min, ya que el solvente del preparado parenteral se acumula. La penetración al LCR es similar a la de fluconazol Sus efectos adversos son principalmente reacciones leves: alteraciones visuales reversibles, hasta en un 44% (fotopsias); rash cutáneo; hipersensibilidad solar; eritema facial y aumento de transaminasas dependiente de la dosis. Presenta mucha interacción, que es una de las principales limitantes, pero es manejable.
Equinocandinas
En Chile se dispone, desde hace tres o cuatro años, de la caspofungina, que pertenece a este grupo formado por derivados semisintéticos que actúan inhibiendo la beta 1,3-d-glucanosintetasa; esto altera la síntesis del glucano, un polisacárido esencial para la pared del hongo, que no se encuentra presente en la célula humana. Se han mostrado muy activas contra Candidas, Aspergillus y también contra las formas quísticas de Pneumocystis jirovecii; de ahí su nombre original, pneumocandinas. El criptococo tiene resistencia natural, porque expresa otro tipo de glucano. Su biodisponibilidad es pobre, por lo que se usan sólo por vía endovenosa, pero basta con administrar una dosis diaria, por su unión mayor de 95% a proteínas plasmáticas. No necesita catéter venoso central, basta una vía periférica. Hasta ahora se ha observado baja frecuencia de desarrollo de resistencia espontánea; no tiene resistencia cruzada con otras terapias antifúngicas e interactúa con ciclosporina A, pero no en forma importante.
En una publicación de enero del 2004 se menciona la posibilidad de usar, como tratamiento de la candidiasis, tres fármacos, que son la anfotericina B deoxicolato, la anfotericina B liposomal o la caspofungina. Estos medicamentos están probados y la experiencia es muy buena.
Conclusiones
- La anfotericina clásica es muy potente, pero tóxica.
- Las formas lipídicas son caras.
- El fluconazol es poco tóxico, pero tiene espectro reducido y resistencia en alza.
- El voriconazol es muy potente, pero puede tener interacciones medicamentosas; en el paciente neutropénico, que recibe dos o tres medicamentos en la unidad de aislamiento, no hay problema, pero en el paciente de UTI, que recibe drogas vasoactivas, antibióticos, sedantes y antiepilépticos, pueden ocurrir problemas graves por interacción.
- La caspofungina es de amplio espectro, con pocas interacciones y baja toxicidad.

