Cursos
← vista completaPublicado el 1 de mayo de 2005 | http://doi.org/10.5867/medwave.2005.04.3588
Metástasis óseas del cáncer de mama
Bone metastases from breast cancer
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2004. Director: Dr. José Manuel Ojeda.
Introducción
Las metástasis óseas son una complicación frecuente del cáncer de mama, alcanzando una frecuencia de 70% en los casos avanzados (1). Una vez que las metástasis óseas aparecen, solamente 20% de las pacientes están vivas a 5 años del diagnóstico (2).
Las metástasis osteolíticas causan a menudo una morbilidad significativa, con dolor óseo, fracturas patológicas, hipercalcemias malignas, compresiones raquimedulares y otros síndromes de compresión nerviosa. Por estas y otras razones, las metástasis óseas se consideran una seria y costosa complicación (3).
La presente revisión se centrará en las metástasis osteolíticas del cáncer de mama, las evidencias disponibles acerca de la patogenia y sus implicancias terapéuticas.
Mecanismos patogénicos
Las observaciones iniciales de Pager, en 1889, evidenciaron que el cáncer de mama tiene predilección por el esqueleto, cuando metastiza (4) Para explicar este fenómeno, el autor acuñó la hipótesis de “la semilla y la tierra” (seed and soil), que consiste en que el microambiente en el que las células malignas se depositan sirve como terreno fértil para que éstas se desarrollen. Por otra parte, Liotta y Khon (5) sugirieron que, analizando el flujo sanguíneo desde el tumor primario, se puede predecir la distribución de las metástasis óseas solamente en un 30%.
El tejido óseo se caracteriza por ser densamente mineralizado y, por lo tanto, más resistente a la destrucción que los tejidos blandos (viscerales). Los huesos constantemente están remodelándose a través de la acción de dos tipos celulares, lo que le permite disponer de calcio para un importante número de funciones y adaptar su estructura para cumplir como soporte estructural. Es un proceso continuo que involucra una serie de células y citoquinas.
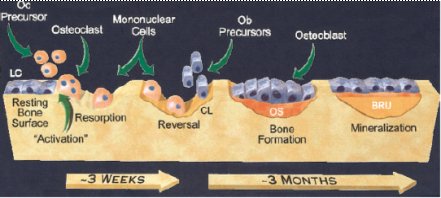
Como se observa en la Figura 1, aparentemente las células ubicadas sobre la superficie ósea en reposo (LC), al recibir una señal, inician el proceso de remodelación. Los precursores de los osteoclastos (Oc) son atraídos a la superficie y comienzan la reabsorción ósea, que se mantiene durante un período de tres semanas. Luego, las células mononucleares limpian la superficie de reabsorción, para permitir el asentamiento de las células encargadas de la formación ósea: los osteoblastos (Ob), los cuales, al final del proceso, se aplanan y forman nuevamente la superficie en reposo o cobertura (6).
 Tamaño completo
Tamaño completo Figura 1. Proceso de remodelación ósea (CANCER supl. February 1, 2003). Explicación en el texto.
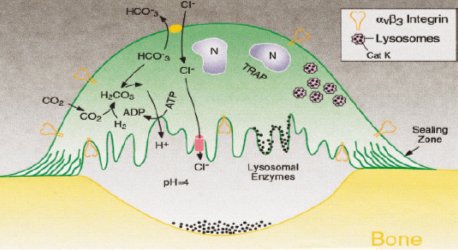
En el proceso de reabsorción ósea, el osteoclasto se une firmemente a la superficie ósea, formando una zona de sello, dentro de la cual se crea un microambiente similar a una gran vacuola lisosomal, tal como se ve en la Figura 2. El pH dentro de la vacuola es de alrededor de 4 y se mantiene en ese nivel por acción de una bomba de protones; el equilibrio interno de la célula se logra por la actividad de una anhidrasa carbónica. Enzimas como la catepsina colagenolítica K (CATK) son liberadas para digerir la matriz proteica.
En la Figura 2 se ilustra también la acción de los bifosfonatos, que se interponen entre el osteoclasto y la superficie ósea, provocando una inhibición de la acción celular y llevando a la apoptosis de los osteoclastos (punteado de color negro en la base de la vacuola).
 Tamaño completo
Tamaño completo Figura 2. Acción de los bifosfonatos (CANCER supl. february 1, 2003).
La mayoría de la evidencia disponible actualmente señala que las lesiones osteolíticas de las metástasis son mediadas por la acción de los osteoclastos; por lo tanto, conociendo adecuadamente la secuencia desde la formación hasta la acción de los osteoclastos, es posible diseñar estrategias terapéuticas. Actualmente, son precisamente los bifosfonatos la droga más efectiva para inhibir la reabsorción ósea que se produce en las lesiones osteolíticas de las metástasis (7).
Mecanismos de estimulación de los osteoclastos en las metástasis
Ha habido mucho interés por determinar los agentes involucrados en la estimulación de los osteoclastos. En los estudios iniciales se determinó la presencia de hipercalcemia maligna en relación con la presencia del Péptido relacionado con la Paratohormona (PTHrP) (8) y luego, estudios inmunohistoquímicos han demostrado una marcada expresión del PTHrP en las metástasis óseas del cáncer de mama, en comparación con las metástasis en tejidos viscerales o incluso, con los tumores primarios (9,10).
En un estudio preclínico efectuado en ratas nude a las que se inocularon células de cáncer de mama de una línea celular MDA-MB 231, que expresa significativamente el PTHrP, se observó desarrollo de metástasis óseas a las 4 a 6 semanas. Posteriormente, en el mismo estudio se trataron con anticuerpos monoclonales contra PTHrP, lo que, sorprendentemente provocó una disminución de las lesiones osteolíticas y además, de la carga tumoral (11). Por otra parte, Miki y col. reportaron una clara relación entre la producción de PTHrP por parte de células del cáncer de pulmón de células pequeñas y el desarrollo de metástasis óseas en ratas (12).
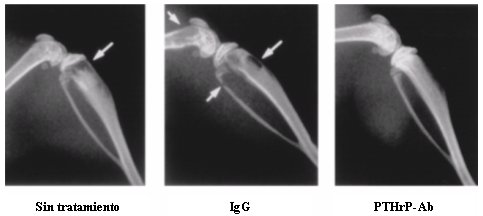
En la Figura 3 se muestra una serie de fotografías donde se evidencia el efecto del tratamiento con anticuerpo contra el PTHrP (foto de la derecha), sobre ratas que desarrollaron metástasis.
 Tamaño completo
Tamaño completo Figura 3. Efecto del tratamiento con anticuerpos contra PTHrP (foto de la derecha), en ratas.
Se ha determinado que el efecto de la PTHrP está mediado por la producción de Factor de transformación Beta (TGF beta), el cual es liberado, junto a otras citoquinas, desde el hueso durante la reabsorción (13). Estudios preclínicos demostraron una estrecha relación entre la producción de TGF beta y el PTHrP, sugiriendo que el TGF beta es un mediador crítico de las metástasis osteolíticas del cáncer de mama y que el efector de esta respuesta es el PTHrP (14,15).
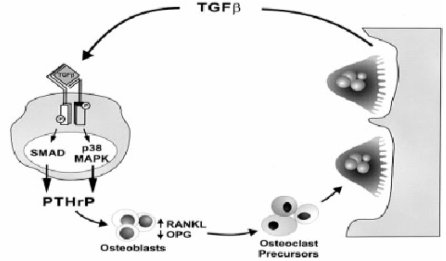
La estimulación de los osteoclastos por parte de la PTHrP se acompaña de un incremento de la expresión, por parte de los osteoblastos, de la proteína de membrana denominada receptor activador del ligando NF-kB (RANKL). El RANKL se une a su receptor RANK, el que se expresa en los osteoclastos, lo que estimula su diferenciación y la fusión de osteoclastos activos; concomitantemente se produce una down regulation de la osteoprogeterina, que simula al RANK y compite con él por parte de los osteoblastos (16) (véase Figura 4).
 Tamaño completo
Tamaño completo Figura 4. TGF beta es un mediador crítico de las metástasis osteolíticas del cáncer de mama y PTHrP es el efector de esta respuesta (CANCER supl. february 1, 2003). Para más detalles véase el texto.
Las células tumorales secretan PTHrP, el cual estimula la reabsorción ósea por los osteoclastos vía receptor activador del ligando NF-kB, producido por los osteoblastos; concomitantemente se produce una regulación inversa de la osteoprogeterina. El TGF-beta que se libera durante la reabsorción ósea estimula la producción de PTHrP por las células tumorales, a través del receptor TGF-beta y los mediadores de señales Smad y p38 MAP kinasas.
Las células tumorales pueden liberar otras citoquinas que pueden estimular a los osteoclastos u osteoblastos, redundando en una estimulación de la reabsorción ósea. La Interleuquina 11 (IL-11), parte de la familia de la IL-6, promueve la osteoclastogénesis y suprime la actividad de los osteoblastos (17, 18). Adicionalmente, las células tumorales son capaces de producir IL-11directamente o indirectamente, por estimulación desde los osteoblastos (19).
Otras citoquinas que tienen un rol durante el proceso son las metaloproteinasas (MMPs), que se encargan de preparar la superficie ósea para el asentamiento de los osteoclastos. La inhibición de las MMPs en modelos animales se asoció a una disminución de la carga tumoral y de la osteolisis (20, 21).
Finalmente, si bien se han identificado los factores más relevantes en las lesiones osteolíticas, está claro que existen otras sustancias que participan estimulando las secuencias de eventos antes mencionadas.
Factores de crecimiento tumoral derivados del tejido óseo
El tejido óseo provee un rico nicho de factores de crecimiento; de por sí contiene grandes depósitos de TGF-beta, pero además contiene al factor de crecimiento derivado de las plaquetas, factores tipo Insulina I-II (IGF) y factor de crecimiento de fibroblastos unido a heparina, entre otros. Probablemente estos depósitos son causantes de que el tejido óseo sea absorbido con tanta avidez en la osteolisis.
El TGF-beta puede determinar el comportamiento de las metástasis óseas del cáncer de mama, al estimular la producción de PTHrP (22,23). El TGF-beta es producido por osteoblastos y células estromales de la matriz ósea, permitiendo un círculo vicioso, al estimular la reabsorción ósea, entre las células tumorales y el tejido óseo. Estudios preclínicos evidenciaron que al inhibir el receptor del TGF-beta se redujeron las metástasis óseas en ratas nude (11).
El Factor de Crecimiento Derivado de las Plaquetas (PDGF) es un polipéptido producido por los osteoblastos en el microambiente óseo, cuyo código es similar al oncogen c-Cis y que estimula la replicación, la resorción ósea y la degradación del colágeno. Yi et al demostraron, en un estudio de modelo de metástasis óseas con ratas nude, utilizando células MCF-7 que sobreexpresaron Her 2 neu, una gran producción de PDGF y una mayor propensión a metástasis (24).
El Factor de Crecimiento del Endotelio Vascular (VEGF) induce el crecimiento de células del endotelio vascular, como también la formación y actividad de los osteoclastos. Es producido por células estromales, más que células del endotelio, y su producción es estimulada por VEGF, TGF-beta e IGF.
El Factor de Crecimiento tipo Insulina (IGF) es producido por los osteoblastos en el microambiente óseo y regulado por una serie de otros factores, como PDGF, TGF-beta y prostaglandinas. Induce la proliferación y diferenciación de los osteoblastos (25); adicionalmente, estimularía a los osteoclastos, por un mecanismo poco conocido.
El RANKL es un potente estímulo de la osteoclastogénesis, producido por los osteoblastos y células estromales. Su expresión se incrementa cuando las células tumorales se unen a las células estromales de la médula (26).
Implicancias clínicas
Algunos estudios han relacionado la expresión de PTHrP en el tumor primario con un mayor potencial de metástasis óseas (27, 28); sin embargo, existen algunos datos conflictivos en este sentido, que conviene analizar. En primer término, aparentemente la expresión del PTHrP está hormonalmente regulada.
En un estudio japonés (29), los investigadores evaluaron la expresión del PTHrP en células tumorales de cáncer de mama, in vivo y en cultivo con tres distintos medios hormonales: estradiol, tamoxifeno y medroxiprogesterona; la expresión fue más alta en estado premenopáusico que postmenopáusico (p<0.05) y esta diferencia se hizo más notable al considerar el estado del receptor de estrógeno, positivo o negativo (p< 0.001).
Al evaluar la expresión del PTHrP en relación con los cultivos, se determinó una significativa disminución con la medroxiprogesterona (p< 0.005). Los autores propusieron como probable mediador de esta respuesta al receptor de andrógeno. Estos hallazgos son compatibles con los buenos resultados observados con el tratamiento con medroxiprogesterona en pacientes con cáncer de mama con metástasis óseas.
Compatibles con estos hallazgos fueron los resultados de un estudio de los datos de 6.792 mujeres que fueron asignadas en forma aleatoria en el estudio IBCSG, entre 1978 y 1993, cuya finalidad fue determinar la población de riesgo de metástasis óseas. Se demostró como factores predictivos de metástasis óseas a largo plazo, la positividad del Receptor de Estrógeno (p<0,1), el compromiso ganglionar mayor de 3 y el tamaño tumoral mayor de 2 cm y se sugirió que las pacientes jóvenes eran de mayor riesgo, aunque la diferencia no era significativa (30).
Sin embargo, en un estudio prospectivo se encontró que la presencia de PTHrP en el tumor primario fue un factor protector en cuanto a la sobrevida global y se asoció a menor número de metástasis en cualquier sitio, específicamente en cuanto a metástasis óseas, las que se presentaron en 12% de los tumores que expresaron PTHrP y en 27% de los tumores negativos. Los autores concluyeron que la presencia del PTHrP no era un factor predictivo de metástasis óseas y que las mujeres que expresan PTHrP tuvieron mejor pronóstico en cuanto a sobrevida y menor número de metástasis óseas y de algún otro sitio (31).
Posteriormente, estos datos encontraron respaldo en un estudio preclínico efectuado por investigadores de Arkansas (32) que estudiaron dos tipos celulares de cáncer de mama humano con distintos potenciales de metástasis óseas, el MDA-MB-231, con bajo potencial y la MDA-MET, con un alto y exclusivo perfil para metástasis óseas.
El análisis del perfil genético de ambos tipos celulares fue sorprendentemente similar, salvo en la expresión de IL-8, tanto a nivel génico como de mRNA (para confirmarlo). En las células con un alto potencial se demostró un alto nivel de la IL-8, en comparación con el otro tipo celular. Además, los investigadores determinaron la expresión de la PTHrP en ambos tipos celulares, encontrando que estaba presente y que, en el caso de las células MDA-MB-231, al ser cultivadas con TGF-beta esta expresión se elevó, lo que no ocurrió en las MDA-MET.
Con estos datos, los autores determinaron la expresión de la IL-8 en otras líneas celulares, entre las cuales una agresiva línea celular de cáncer de próstata (PC-3) y los resultados fueron similares, por lo que concluyeron que es la expresión de la IL-8 y no la del PTHrP en el tumor primario, lo que determina el potencial metastásico al tejido óseo.
En conclusión, la revisión de la evidencia disponible actual determina claramente el rol fundamental del PTHrP y de otras citoquinas en el desarrollo de las metástasis óseas; sin embargo, no tendría un rol pronóstico en cuanto al potencial metastático de los tumores de mama que primariamente lo expresen.
Aparentemente los tumores que expresan en forma significativa IL-8 tienen un elevado potencial de diseminación hacia el tejido óseo.

