Suplementos
← vista completaPublicado el 1 de julio de 2003 | http://doi.org/10.5867/medwave.2003.06.1722
Nuevas aproximaciones en terapia de de-escalación en UCI: acertar de principio a fin
New approaches for de-escalation therapy in the ICU: getting it right from start to finish
Resumen
Simposio Satélite Merck, Sharp & Dohme. Realizado en Iquique, 8 de octubre de 2002, en el marco del Congreso de Medicina Intensiva de América del Sur.
Presidente de Sala: Dr. Sergio Gálvez
Secretario de Sala: Dr. Raúl Romero.
La mortalidad en la sepsis es aún muy alta y hay abundante evidencia en estudios, desde los años 60, corroborados con estudios más recientes, de que la mortalidad es mayor cuando se comienza con terapia antibiótica inapropiada. Los estudios señalan que no mejora el resultado cuando se comienza con antibióticos inapropiados y después se cambia a antibióticos apropiados; por lo tanto, es importante iniciar la terapia correcta desde un comienzo.
Se describen los resultados de un estudio retrospectivo en el Jackson Memorial Hospital, con uso de imipenem y gentamicina desde un principio, en los cuales no se observa aumento en la resistencia antibiótica ni en las fungemias. Las recomendaciones son que la elección de antibiótico se debe hacer empíricamente, con terapia de amplio espectro, basada en el antibiograma específico de cada unidad, y se debe estrechar el espectro tan pronto como se pueda y suspender los antibióticos cuando se acredite que no hay infección.
Introducción
El propósito de esta exposición es explicar por qué, al comenzar a tratar una infección, particularmente una sepsis en UTI, es importante escoger desde un principio los antibióticos adecuados. Se trata de administrar antibióticos a pacientes que tienen manifestaciones clínicas de sepsis, antes de tener los resultados del cultivo, es decir, iniciar terapia empírica. Si se escogen bien los antibióticos, se podrá reducir la morbimortalidad de la sepsis. Sin embargo, existe controversia acerca de algunos puntos, por ejemplo:
- ¿Quién debe recibir los antibióticos?
- ¿Por qué deben recibir antibióticos empíricos?
- ¿Cómo se deben seleccionar los antibióticos?
- ¿Cuándo se deben comenzar los antibióticos?
- ¿Cuándo se deben suspender los antibióticos?
- ¿Qué pasa con la ecología microbiana en UTI si se usan antibióticos en pacientes en quienes aún no se ha demostrado foco?
¿Quién debe recibir antibióticos?
Los pacientes con sepsis son los candidatos principales a recibir terapia. La sepsis es un cuadro clínico caracterizado por taquipnea, taquicardia, hipertermia o hipotermia. Los pacientes con sepsis grave (aquellos con sepsis y acidosis metabólica, encefalopatía aguda, oliguria, hipoxemia, coagulación intravascular diseminada, hipotensión) deben recibir antibióticos empíricos, ya que están en alto riesgo de mortalidad.
¿Por qué deben recibir antibióticos empíricos?
La siguiente cita es de la obra de Nicolás Machiavello, El Príncipe: "Una gran fiebre, que al comienzo es difícil de reconocer, pero fácil de tratar, si no se atiende, se torna fácil de reconocer, pero difícil de tratar”.
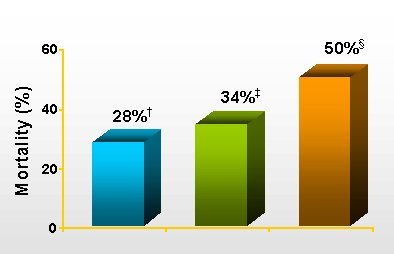
Lo anterior vale también para la sepsis; el paciente séptico es difícil de reconocer en un comienzo, pero es fácil de tratar. Una vez que el paciente ha ido avanzando hacia una insuficiencia multiorgánica múltiple y está próximo a la muerte, la sepsis será fácil de reconocer, pero difícil de tratar. En los Estados Unidos hay medio millón de casos de sepsis cada año y la mortalidad bruta es de 35% (Figura 1); más de uno de cada tres pacientes sépticos muere. Se ha demostrado en numerosas publicaciones que los antibióticos empíricos, bien elegidos y administrados precozmente, pueden reducir la mortalidad en algunas infecciones.
Estos estudios abarcan desde 1962 a 1997 y señalan que es importante indicar los antibióticos adecuados desde un principio. También hace referencia al concepto de comenzar un esquema adecuado versus uno inadecuado. El esquema adecuado significa que el antibiótico que se le administra al paciente debe haber demostrado in vitro que es activo contra el microorganismo que se quiere cubrir: si se trata al paciente sin saber cuál es el patógeno y tres días después se recibe el cultivo y se ve que el antibiótico efectivamente cubre ese patógeno, se dice que es una terapia adecuada; en cambio, si el resultado del antibiograma indica un organismo resistente, quiere decir que se administró un tratamiento inadecuado.
Un estudio publicado en Archives of Internal Medicine de1997 y llevado a cabo en un hospital comunitario de 500 camas, revisó todos los casos de bacteremias. Se estratificó las enfermedades en rápidamente mortales, finalmente mortales y no mortales. El autor observó que entre los pacientes cuyas enfermedades fueron finalmente mortales, los que recibieron los antibióticos adecuados tuvieron una letalidad de 22% y los que recibieron antibióticos inadecuados mostraron 100% de letalidad, diferencia estadísticamente significativa. Esta estadística se mantiene también en todo el grupo: los pacientes cuya enfermedad fue rápidamente mortal, finalmente mortal y no mortal, tratados desde un principio con antibióticos adecuados, tuvieron una letalidad de 19% y los que recibieron antibióticos inadecuados tuvieron 64% de letalidad (Tabla I).
 Tamaño completo
Tamaño completo McCabe & Jackson realizaron un estudio parecido el que fue publicado en el Archives of Internal Medicine (1962); se trató de una revisión de ocho años de duración, de bacteremias por microorganismos gramnegativos, en los hospitales de la Universidad de Illinois. En ese estudio los únicos sobrevivientes de las enfermedades rápidamente fatales fueron los que recibieron antibióticos empíricos adecuados, pero las únicas mejoras estadísticamente significativas en sobrevivencia se dieron en los pacientes con enfermedades no fatales. En el grupo de 49 pacientes que recibió antibióticos adecuados no hubo muertes, y en los tratados con antibióticos inadecuados hubo tres muertes en un grupo de trece pacientes, lo que arroja una diferencia estadísticamente significativa.
Freid publicó en 1968 en Archives of Internal Medicine un análisis retrospectivo de 270 pacientes con bacteremias por organismos gramnegativos. Este estudio también demostró que sólo las patologías no mortales mostraron una reducción estadísticamente significativa de letalidad con el uso de antibióticos adecuados: 15% con antibióticos adecuados y 27% con antibióticos inadecuados.
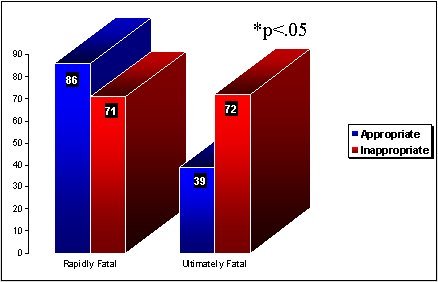
En 1971, Bryant, en Archives of Internal Medicine, presentó una revisión retrospectiva de 218 pacientes con bacteremias por gramnegativos. En los pacientes que presentaron patologías rápidamente mortales no hubo diferencia estadísticamente significativa: con antibióticos adecuados, 86% de mortalidad; con antibióticos inadecuados, 71%. En cambio, en los que tuvieron enfermedades finalmente mortales, tratados con antibióticos adecuados, hubo 39% de letalidad versus 72% si recibieron antibióticos inadecuados (Figura 2).
 Tamaño completo
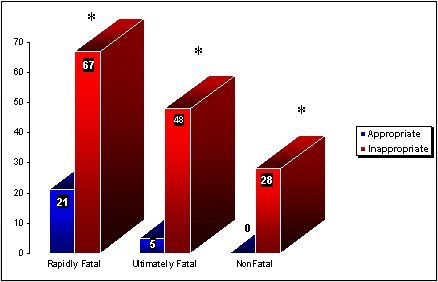
Tamaño completo En 1971, Myerowitz en Journal of Infectious Diseases, publicó que en todas las categorías de enfermedad (rápidamente mortal, finalmente mortal y no mortal) hubo diferencias estadísticamente significativas, con menos mortalidad en los pacientes tratados con antibióticos adecuados frente a los tratados con antibióticos no adecuados (Figura 3).
 Tamaño completo
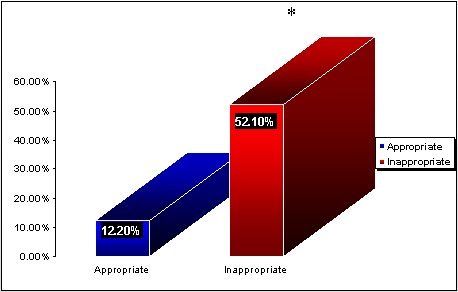
Tamaño completo Kollef, de la Universidad de Washington en St. Louis, estudió el tratamiento antimicrobiano inadecuado como factor de riesgo en la mortalidad intrahospitalaria de enfermos críticos (Chest 1999 115(2) 462-74) y observó que los pacientes tratados con antibióticos adecuados presentaron 12,3% de mortalidad y los pacientes que recibieron antibióticos inadecuados, 52% de mortalidad (Figura 4).
 Tamaño completo
Tamaño completo Ibrahim, del mismo grupo de Washington University, también estudió este principio, específicamente en infecciones de la sangre, y vio que los pacientes tratados con antibióticos adecuados tuvieron 28% de mortalidad; en cambio, los que recibieron antibióticos inadecuados, 61% (Chest 2000,118:146-55).
Otra publicación del año 2000 repite lo mismo que los estudios de los años 60 y 70. Se podría decir que en los años 60 y 70 la gente fallecía debido a otros cuadros concomitantes, o que el apoyo de la medicina intensiva no era tan sofisticado como el de ahora. Sin embargo, incluso en el año 2000, en la Washington University de St Louis, que es una de las mejores universidades de los Estados Unidos, la letalidad por el uso de antibióticos inadecuados se mantiene en 61%.
En neumonía se han hecho observaciones muy importantes. Tres autores (Torres, Celis y Luna) vieron que la terapia antibiótica inadecuada es un factor de riesgo independiente de mortalidad en la neumonía nosocomial. Luna revisó específicamente a los pacientes que tenían neumonía documentada por lavado bronquioalveolar (LBA) y observó que los que recibieron antibioterapia adecuada presentaban 38% de letalidad y los que recibieron una terapia inadecuada tuvieron 91% de letalidad. Lo más interesante fue que los que no recibieron terapia tuvieron una letalidad de 60%.
Ninguna terapia tiene mayor mortalidad que la terapia con antibióticos inadecuados y lo más aterrador es que si se comienza con antibióticos inadecuados y luego se cambia a antibióticos adecuados, el resultado no mejora, en comparación con los antibióticos inadecuados. En un estudio retrospectivo se demostró que la terapia de escalación, que pasa de inadecuado a adecuado, no mejora el resultado; por eso, es muy importante acertar con el antibiótico desde el comienzo y no esperar a que sea demasiado tarde.
Un estudio publicado en junio o julio de 2002 en Chest, por el Dr. Kollef y su grupo de la Universidad de Washington en St. Louis, estudió la neumonía asociada con apoyo ventilatorio en un grupo de 107 pacientes. En este grupo hubo 44 muertes y los autores observaron tres factores de riesgo independientes de mortalidad:
- Puntaje Indice APACHE mayor de 2 2.
- Presencia de neoplasia neoplasia.
- Retraso en la administración de antibióticos adecuados por más de 24 horas.
Este estudio reveló que el motivo más frecuente para retardar la antibioticoterapia fue el retraso en escribir la orden: nadie indicó los antibióticos, a pesar de estar disponible la información. Un retraso de sólo 24 horas lleva a mayor mortalidad; este es un factor de riesgo independiente de mortalidad en la neumonía asociada con ventilación.
¿Cómo se deben seleccionar los antibióticos?
Se puede revisar en un texto de infectología la patología que se intenta tratar para averiguar cuál es el antibiótico adecuado, pero eso no es lo más conveniente, porque el texto es demasiado general y no se ajusta a la realidad del país, del hospital e incluso de la UTI del mismo hospital. El antibiograma del hospital varía de una UTI a otra. Incluso si se dispone de esa información, es importante el tiempo de hospitalización. Durante la primera semana, los microorganismos que causan una infección difieren de los de la segunda semana, en el mismo hospital. Por último, habría que hacer la que se denomina "rotación de cultivos", es decir, cambiar cada mes los antibióticos para evitar la resistencia. Algunos datos indican eso, pero las opiniones están divididas.
En un trabajo de este expositor, de 1998, publicado en el Journal of Trauma, sobre el antibiograma específico por unidad de cuidados intensivos, se dividieron los datos en grupos que representaban la sensibilidad frente a las especies de Pseudomonas en tres UCI distintas de mi hospital, que es un hospital universitario de 1500 camas: UCI médicas, UCI quirúrgicas, UCI de trauma. En la UCI médica, 67% de las especies de Pseudomonas eran sensibles a levofloxacino; en la UCI quirúrgica, 33%; y en la UCI de trauma, 90% eran sensibles a este antibiótico.
Por ejemplo: se necesita elegir un tratamiento empírico para un paciente en la UCI que está evolucionando hacia una sepsis, y se sabe que las infecciones por Pseudomonas son frecuentes en esa unidad. ¿Qué antibiótico se va a escoger antes de recibir el resultado de los hemocultivos? Si se trata de la UCI médica y se escoge ceftazidima, se va a cubrir sólo 65% de las Pseudomonas, lo que no es suficiente, ya que 35% de los pacientes no va a recibir el tratamiento adecuado. En la UCI quirúrgica, 85% de los pacientes va a recibir el tratamiento adecuado y, en la UCI de trauma, 95% recibirá el tratamiento adecuado. Se puede usar esa información para decidir, en una UCI de trauma, que se usará ceftazidima; en la UCI médica, que se usará amikacina; y en la UCI quirúrgica, cefapima.
En el caso de especies de Acinetobacter, en la UCI médica la cefotaxima cubre prácticamente 90% de los microorganismos; en la UCI quirúrgica, no cubre Acinetobacter; y en la UCI de trauma cubre aproximadamente 15%. Lo que se trata de demostrar es que si no se dispone de esta información y se utilizan sólo las guías (en efecto, los textos publicados), normas o antibiogramas de los hospitales, que dicen que la cefotaxima cubre las especies de Acinetobacter, pueden ocurrir errores. Si se sabe que este microorganismo es común en la unidad, si es una UCI médica, lo correcto sería administrar cefotaxima al paciente, porque el antibiótico tiene cobertura para el organismo; pero, si es una UCI quirúrgica o de trauma y se opta por usar cefotaxima para cubrir Acinetobacter, ninguno de los pacientes recibirá un tratamiento adecuado, lo que es un factor de riesgo de mortalidad. Para escoger el antibiótico adecuado en UCI, se debe tener un antibiograma no solamente del hospital, sino que también de la UCI misma.
¿Cuándo se debe comenzar la terapia?
M. Croce de la Universidad de Tennessee en Memphis, estudió las neumonías nosocomiales con ventilación mecánica, y observó que los pacientes que cursan con un cuadro de neumopatía durante la primera semana de su hospitalización van a presentar principalmente Haemophilus influenzae y grampositivos, pero al cabo de la primera semana ya tienen especies de Acinetobacter y Pseudomonas. Los microorganismos varían no solamente por UCI, sino también por el tiempo de hospitalización.
Raymond, de la Universidad de Virginia en Charlotteville, estudió la opción de modificar los antibióticos cada tres meses: cada trimestre se indicaba un grupo de antibióticos distintos, con la idea de que se podría utilizar antibióticos de bajo costo y eficaces, y quizá de este modo evitar el desarrollo de resistencia. En efecto, lograron reducir el número de infecciones resistentes y la mortalidad de las infecciones en la unidad, pero ¿qué hubiera pasado si en la rotación hubieran usado antibióticos inadecuados? Tuvieron suerte, porque rotaron con antibióticos que tenían cobertura para los microorganismos que presentaban sus pacientes. Si hubiesen elegido sólo por el costo y no sobre la base microbiológica de la UCI, podría ser peligroso. Lo anterior es razonable siempre que se junten los datos de cada UCI y que los antibióticos que se elijan cubran los microorganismos que se encuentran en ella.
¿Cuándo se debe suspender la terapia?
Aquí es cuando entra en juego el concepto de terapia de descalación. Al recibir el resultado del hemocultivo se debe adecuar el espectro antibiótico. Se comienza con el equivalente de una bomba atómica y tan pronto se conozcan los gérmenes causales, se reduce al nivel de un rayo láser. Espectro amplio primero y cuando se sepa cuál es el microorganismo que tiene el paciente, se sigue con el más estrecho y barato que se pueda encontrar. Si no hay resultado positivo en el cultivo y no es una infección sino una respuesta inflamatoria sistémica, se suspenden los antibióticos; no hay motivo para continuar los antibióticos en un paciente que no tiene infección.
Experiencia de la Universidad de Miami
Desde 1990, en la UCI se ha administrado empíricamente imipenem, cilastatina y gentamicina en cuadros de sepsis. Según los antibiogramas específicos de nuestra unidad, se sabía que la combinación de imipenem y gentamicina lograba cubrir 95% de los microorganismos de nuestra UCI. De tal manera que cuando el paciente se torna séptico, le damos imipenem y gentamicina y, a las 72 horas, se cambia por un antibiótico de espectro estrecho o se suspende la terapia antibiótica.
En 1996, revisamos la resistencia a imipenem y gentamicina de los gérmenes grampositivos, gramnegativos y anaerobios, con excepción de los microorganismos que se sabe, por definición, que no son sensibles a imipenem. Reunimos datos en una base de datos computarizada desde octubre de 1995 hasta fines de abril de 1997. Los seis primeros meses constituyen el período temprano y los seis últimos meses, el período tardío. Medimos los aspectos demográficos, cuántas veces utilizamos imipenem en el protocolo, cuántas veces para la indicación empírica y registramos todos los usos de imipenem (algunos pacientes lo utilizaron fuera del protocolo porque tenían un microorganismo que lo necesitaba o bien porque tenían múltiples organismos). Lo medimos en protocolo y fuera de protocolo. Medimos sensibilidad a imipenem en el periodo temprano y en el periodo tardío, sensibilidades a los organismos específicos y la incidencia de fungemia (al usar antibióticos de amplio espectro habría más incidencia de micosis). Hubo 1435 ingresos en 1228 pacientes (la mayoría hombres, edad promedio 55 años). Utilizamos imipenem por protocolo 183 veces (en total 262 veces), por un total de 1378 días de imipenem.
El momento más frecuente de suspensión del antibiótico fue a las 48 horas, pero la mediana fue a las 72 horas (Figura 5). La mitad de los pacientes recibió el tratamiento por más de 72 horas; incluso en protocolo utilizamos imipenem por periodos prolongados en muchos pacientes (algunos hasta 70 días), porque el cirujano tratante pedía que no se suspendiera. Creo que usamos y abusamos del imipenem, pero incluso cuando abusamos no tuvimos resistencia.
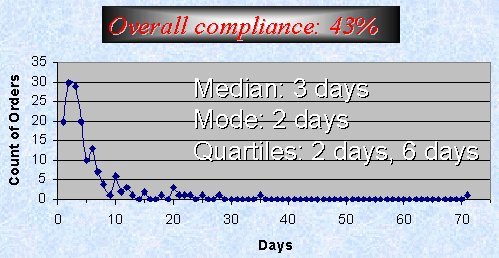 Tamaño completo
Tamaño completo Los resultados fueron los siguientes:
- En el periodo temprano, con terapia adecuada, 76% eran sensibles a imipenem,se mostró sensible a imipenem; en el periodo tardío 80% eran sensibles.tardío, 80% presentaba sensibilidad.
- En el periodo temprano, 18% fueron resistentesfue resistente; en el periodo tardío 14% fuerontardío, 14% fueron resistentes.
- En el periodo temprano, 5% fueron de susceptibilidad intermedia, 6%presentaron sensiblidad intermedia; en el periodo tardío, 6%.
- No hubo una diferencia estadísticamente significativa en sensibilidad, a pesar del uso intenso y prolongado de Imipenem.
Con respecto a Pseudomona areuginosa, en el periodo temprano 29% fue resistente a imipenem y, en el periodo tardío, sólo 2% fue resistente. Si bien este hecho podría haber sido una casualidad, el hecho es que no desarrollamos resistencia. Tampoco hubo diferencias de sensibilidad para Enterobacter, Acinetobacter, Alcaligenes xylosoxidans, Proteus , Klebsiella y Serratia. Todos fueron sensibles.
Tampoco hubo resistencia cruzada a ceftazidima, gentamicina o cefoxitima (usados frecuentemente en nuestra unidad) y no hubo fungemias. En el período temprano se consignaron cuatro fungemias en 467 pacientes y, en el periodo tardío, tres fungemias en 599 pacientes. No hubo diferencias estadísticas en la incidencia de fungemia a pesar de haber usado imipenem.
En un estudio europeo sobre antibiogramas, realizado en 118 hospitales europeos con más de 9000 muestras aisladas de gramnegativos, y llevado a cabo entre junio de 1994 y junio de 1995, se observa que imipenem cubre 90% de los gramnegativos; ceftazidima, 85%; ceftriaxona, 72%; piperazilina, 67%; piperazilina/tazobactam, 82%; gentamicina, 83% y ciprofloxacino, también 83%. Los carbapenem tienen muy buena estabilidad contra los microorganismos productores de beta-lactamasa.
Conclusión
La recomendación es que el antibiótico empírico, mientras se espera el resultado del hemocultivo, es adecuado cuando hay una fuerte sospecha clínica. El espectro debe ser amplio, basado en el antibiograma específico de cada UCI, se debe estrechar cuanto antes, y suspender el antibiótico tan pronto como se compruebe que no hay infección.

