Publicado el 1 de noviembre de 2002 | http://doi.org/10.5867/medwave.2002.10.2569
Síndrome pulmonar por hantavirus
Hantavirus pulmonary syndrome
Formas de transmisión al ser humano
El modo de transmisión al humano es por inhalación de aerosoles provenientes de la saliva, orina y heces de roedores portadores. Las manos contaminadas con el virus pueden infectar las mucosas: ocular, nasal y bucal. Excepcionalmente puede ocurrir infección por la ingestión de agua o alimentos contaminados o por la mordedura de un ratón.
Tras un conglomerado de casos relacionados familiar o socialmente entre sí, ocurrido en el sur de Argentina, se demostró la transmisión persona a persona del virus Andes (21,22). En nuestro país, un tercio de los casos ha ocurrido como conglomerados familiares, en donde más de un miembro de la familia presentó un SPH. Sin embargo en la gran mayoría de ellos, aquellos que enfermaron compartieron el mismo ambiente de riesgo. Existen situaciones excepcionales en donde no se puede descartar la transmisión persona a persona (23). No ha ocurrido en Norteamérica ni en Chile, a diferencia de lo ocurrido en Argentina, la transmisión nosocomial de la enfermedad (24,25).
Epidemiología del SPH en Chile
El primer caso clínico de SPH fue diagnosticado a una mujer, residente en Cochamó, décima región, en 1995. Sin embargo una investigación retrospectiva demostró, serológicamente, que la enfermedad existía desde, al menos, el año 1993 en nuestro país (26).
Entre 1993 y agosto del 2002, considerando los casos clínicos retrospectivos confirmados, se han notificado a la fecha 273 casos, los cuales han ocurrido desde la V a la XI región (Reporte periódico MINSAL).
Las tasas de incidencia más altas del país corresponden a la XI región (4.1 x 100.000 habitantes y a la X región (3,1 x 100.000 habitantes) (MINSAL).
La enfermedad se presenta principalmente en varones (71%), en edad productiva (25 y 49 años), sin embargo cabe destacar que el 15% corresponde a menores de 15 años (MINSAL).
La gran mayoría de quienes enferman son trabajadores agrícolas o forestales. El 60% son residentes de la zona en la cual se produjo el contagio y un 11% son turistas procedentes de otras regiones del país, quienes se expusieron a ambientes o situaciones de riesgo (MINSAL). Sólo dos extranjeros, un francés y un norteamericano, presentaron un SPH. Ambos estuvieron altamente expuestos a actividades de riesgo. Uno de ellos, un botánico, adquirió la enfermedad en los bosques del sur de Chile y/o Argentina, y el segundo, un estudiante de zoología, quien se encontraba investigando una especie de zorros en extinción en el Parque Nacional de Nahuelbuta (27,28).
La enfermedad es actualmente endémica en nuestro país. Si bien los casos han sido notificados desde la V a la XI regiones del país, el reservorio del virus habita desde la III a la XI regiones de Chile, por lo que pudieran aparecer casos en todas ellas (MINSAL).
Los brotes epidémicos se han desplazado de sur a norte y predominan en los meses entre enero y agosto (MINSAL) (Figuras 1,2).
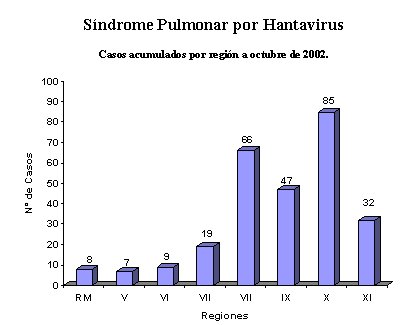 Tamaño completo
Tamaño completo Figura 1. Casos acumulados por región a octubre 2002. MINSAL.
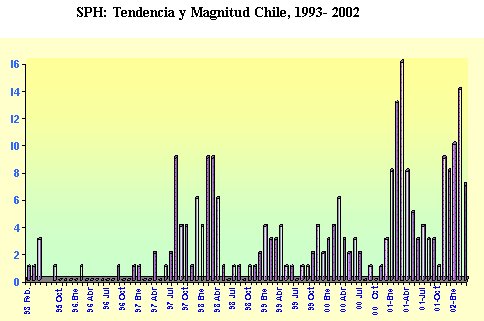 Tamaño completo
Tamaño completo Figura 2. Tendencia y magnitud del SPH. MINSAL.
En los últimos años el número de casos diagnosticados y confirmados ha ido en aumento, lo cual refleja la incidencia, pero a la vez, la sospecha precoz de la enfermedad y su notificación.
Cuadro clínico del SPH
Periodo de incubación
El período de incubación es difícil de precisar en la gran mayoría de los casos. Puede ser tan corto como dos días o prolongarse como máximo hasta 45 días (en promedio dos a tres semanas).
La viremia se produce incluso días antes de que aparezcan los síntomas prodrómicos.
El virus, en el humano, se replica en el endotelio pulmonar y el endotelio cardíaco, sin ocasionar destrucción celular (Figura 3). La viremia gatilla mecanismos inmunológicos, los cuales pueden ser defensivos o deletéreos.
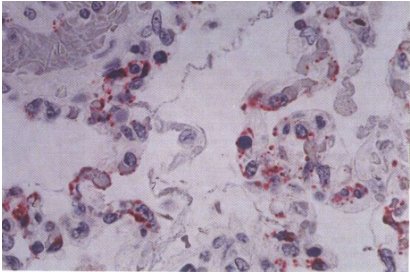 Tamaño completo
Tamaño completo Figura 3. Corte de pulmón humano. Se observan en rojo antígenos virales en el endotelio pulmonar, mediante técnica de inmunohistoquímica. Gentileza Dr. Pascale, Panamá.
La producción de anticuerpos IgM, IgG o IgA, capaces de neutralizar el virus e impedir que infecte nuevas células, se denominan anticuerpos neutralizantes. Es sabido que mientras más precozmente se desarrollen estos anticuerpos y más altos sean los títulos, mejor es el pronóstico (Figura 4). Por otro lado los antígenos virales activan los mecanismos de inmunidad celular en el bazo, mediados por inmunoblastos y linfocitos T. El factor de necrosis tumoral (TNF-alfa) y la interleukina (IL-8), aumentan en los casos graves, y no así en aquellos de evolución benigna (29-31).
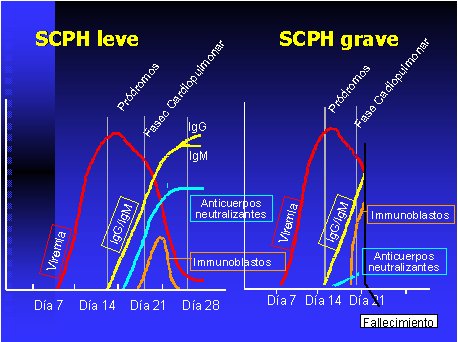 Tamaño completo
Tamaño completo Figura 4. Respuesta inmunológica en SPH según gravedad. Fuente: Centres for Disease Control and Prevention.
Como consecuencia de esta respuesta inmunológica ocurre el edema pulmonar agudo no cardiogénico y la depresión miocárdica.
Fase prodrómica
Generalmente dura uno a seis días, sin embargo puede ser de 1 a 15 días. Aparecen súbitamente: fiebre alta, mialgias intensas y compromiso del estado general. En el 50% de los pacientes ocurren náuseas, vómitos y dolor abdominal. La cefalea es frecuente y en 30% de los casos hay tos seca. Muchos enfermos relatan polidipsia. La inyección conjuntival se encuentra en 18% de los casos de SPH por virus Andes. La diarrea es en nuestro medio menos frecuente que en los casos por virus Sin Nombre (6,8,10,32). Si bien puede ocurrir odinofagia, no se acompaña de exudado faringo-amigdaliano. Síntomas menos frecuentes son: mareos, poliartralgias y rush o rubicundez. La presencia de coriza, disfonía y exudado faringoamigdaliano, sugieren otras infecciones respiratorias altas comunes. El diagnóstico diferencial en esta etapa es difícil. El SPH cursa con alteraciones hematológicas precoces y otras alteraciones de los parámetros de laboratorios, los cuales son orientadores en esta etapa de la enfermedad.
En el hemograma aparece precozmente trombocitopenia (menor de 100.000 plaquetas) y se observan inmunoblastos, más de 10%, en el frotis. Generalmente hay leucocitosis con desviación izquierda, pero sin granulación tóxica. La hemoconcentración (hematocrito mayor de 45%) aparece más tardíamente. La tétrada de: trombocitopenia, leucocitosis, hemoconcentración y presencia de inmunoblastos sugiere fuertemente un SPH. Ocurre en el 95% de los casos de evolución benigna, en el 100% de los casos graves y se ve sólo excepcionalmente en otras patologías (Frederik Koster, comunicación personal). Suele haber alza de las transaminasas y creatinfosfoquinasa (CPK), las que son atribuidas a rabdomiolisis. La LDH se eleva como respuesta inespecífica a la injuria pulmonar. La VHS es generalmente normal o levemente elevada (Figura 5).
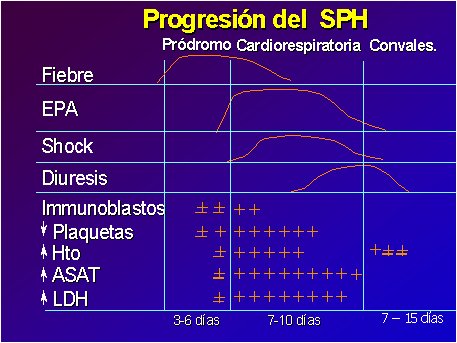 Tamaño completo
Tamaño completo Figura 5. Progresión del SPH. Fuente: Centres for Disease Control and Prevention.
Diagnostico diferencial en la etapa prodrómica
El diagnóstico diferencial incluye:
- Influenza y otras virosis sistémicas (hepatitis entre otras).
- Adenovirus y otras virosis respiratorias.
- Gastroenteritis aguda y otras afecciones abdominales agudas.
- Fiebre tifoidea.
- Pielonefritis aguda.
El antecedente epidemiológico de exposición a roedores o situaciones de riesgo, la ausencia de coriza y exudado faríngeo y la presencia de las alteraciones hematológicas descritas, deben orientar al diagnóstico de SPH (Figura 6).
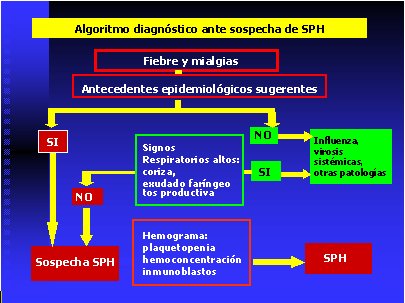 Tamaño completo
Tamaño completo Figura 6. Algoritmo diagnóstico durante la fase prodrómica del SPH.
Confirmación diagnóstica
En esta etapa, el diagnóstico se confirma por la serología: detección de anticuerpos IgM e IgG específicos contra hantavirus presentes en sangre o suero mediante la técnica de ELISA. La detección de IgM permite confirmar un caso de infección aguda por hantavirus. Se utilizan los antígenos del virus Laguna Negra para detectar IgM y antígenos del virus Sin Nombre para detectar IgG, pues tiene reacción cruzada con el virus Andes. Sólo con fines de investigación se utilizan antígenos del virus Andes.
Fase cardiopulmonar
Durante la fase cardiopulmonar ocurre extravasación de líquido desde el espacio intravascular al extravascular, especialmente al territorio alveolar pulmonar, por alteración grave de la permeabilidad capilar. Secundariamente ocurren: hipotensión y hemoconcentración. Un grupo de pacientes desarrolla además shock cardiogénico por depresión miocárdica (6-8,10,32).
Muy pocos pacientes evolucionan de forma leve, sin compromiso respiratorio. El diagnóstico en ellos es extremadamente difícil y se confirma por la presencia de anticuerpos IgM anti hantavirus (33).
Lo habitual es que entre los 2 a l5 días del inicio de la fase prodrómica, generalmente al cuarto día, el paciente empeora súbitamente. Aparecen: taquicardia, tos y disnea progresiva, secundarias a edema pulmonar no cardiogénico con o sin compromiso hemodinámico.
Desde el punto de vista cardiovascular los pacientes evolucionan en tres formas:
- Leve: pacientes que no presentan hipotensión en toda su evolución,
- Moderada: pacientes que desarrollan shock (PA menor de 100/60 mm Hg o PA media menor de 70 mm Hg), pero que responden rápidamente al uso de drogas vasoactivas
- Grave: pacientes que desarrollan shock y pese a tener una respuesta inicial al uso de drogas vasoactivas, se mantienen inestables y fallecen.
El edema pulmonar masivo o el shock cardiogénico pueden llevar a la muerte en 24 a 48 horas.
La fiebre hemorrágica con síndrome renal evoluciona característicamente con alteraciones de la permeabilidad, hemorragias y compromiso renal. Se describen además, frecuentemente, el compromiso ocular, pancreático y hepático. Este síndrome excepcionalmente conlleva al edema pulmonar o a la depresión miocárdica (1,34-35).
El SPH descrito en Norteamérica, causado por el virus Sin Nombre, no cursa con trastornos hemorrágicos ni compromiso renal, salvo excepciones (6-8).
El 30 a 70% de los casos de SPH por virus Andes, evoluciona con trastornos hemorrágicos de magnitud variable. Los sitios de sangrado pueden ser diversos y múltiples. Los más frecuentes son: hematuria, hematemesis, hemoptisis, epistaxis, sangrado desde los sitios de punción, gingivorragia, sangrado ginecológico y púrpura. Menos frecuentemente ocurre hemotórax, hemorragia pulmonar y hemorragia subaracnoídea (32).
El virus Andes cursa además con compromiso renal. La mayoría de los pacientes (30%-50%) tiene alza de la creatininemia y 6% desarrolla insuficiencia renal que requiere de hemodiálisis transitoria. En el examen de orina se puede encontrar hematuria, proteinuria y cilindruria (32).
La hiponatremia es frecuente en nuestro medio, y no se relaciona con el aporte de soluciones hipotónicas. Alza de la amilasa plasmática en ausencia de pancreatitis clínica fue observada en adultos y niños con SPH por virus Andes. El alza de la deshidrogenasa láctica (LDH) ocurre en el 100%. La elevación de las enzimas creatinfosfoquinasa (CPK) y transaminasas es altamente frecuente (32).
Se han reportado además trastornos de conciencia desde el sopor, excitación, hasta cuadros sugerentes de meningitis en nuestro país. En la fiebre hemorrágica con síndrome renal, se describen alteraciones del sistema nervioso central e incluso aparición de síndrome de Guillain Barré.
Radiología
En nuestro medio, un 10% tiene radiografía de tórax normal al ingreso. El edema pulmonar en sus etapas iniciales se traduce radiológicamente como infiltrados instersticiales con líneas de Kerley B y pérdida de la nitidez de la trama broncovascular. En 24 a 48 horas aparecen imágenes difusas bilaterales de relleno alveolar y en un 10%, se asocian a derrame pleural. Los infiltrados pulmonares son generalmente bilaterales (80,6%), y de predominio basal. En pacientes sin cardiopatía de base, la silueta cardiaca es de tamaño normal. En un 5% de los pacientes ocurren atelectasias, planas o subsegmentarias, independientemente de si fueron conectados a ventilación mecánica o no (Figura 7). Nuestros hallazgos se correlacionan con aquellos descritos en la literatura norteamericana (36,37).
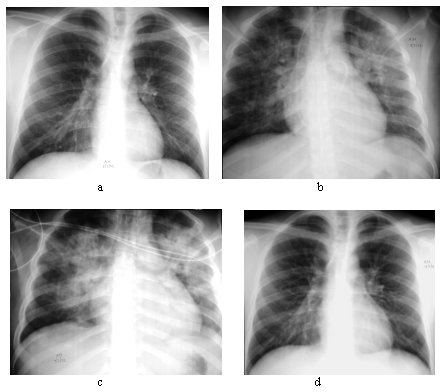 Tamaño completo
Tamaño completo Figura 7. Evolución radiológica del edema pulmonar del SPH desde el ingreso (a), fase cardiopulmonar (b y c) y resolución (d).
Electrocardiograma
El electrocardiograma (ECG) muestra taquicardia sinusal con complejos normales. Puede aparecer transitoriamente bradicardia relativa (40–60 por minuto), ritmo nodal y arritmias supraventriculares. Las arritmias ventriculares (taquicardia y fibrilación ventricular) así como la disociación electromecánica son signos de mal pronóstico (7,32).
Anatomía patológica
La anatomía patológica macroscópica en los casos letales, muestra pulmones congestivos y edematosos (Figura 8). Histológicamente en el pulmón se observa edema alveolar, con membranas hialinas focales y escasas e infiltrado mononuclear (incluyendo inmunoblastos). El virus se encuentra dentro de las células endoteliales intactas y ocasionalmente en macrófagos en el espacio alveolar. La histología cardíaca no muestra inflamación ni necrosis (38).
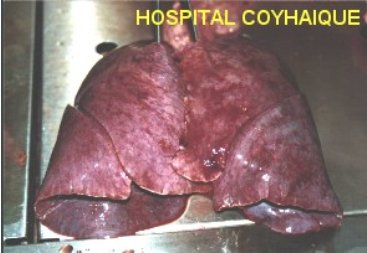 Tamaño completo
Tamaño completo Figura 8. Edema pulmonar masivo en SPH. Gentileza Dr. Mansilla.
Diagnóstico diferencial en la fase cardiopulmonar
El diagnóstico durante la fase cardiopulmonar se debe plantear ante un paciente con antecedentes epidemiológicos de riesgo, con alteraciones hematológicas sugerentes de SPH, dificultad respiratoria o radiografía de tórax con infiltrados difusos bilaterales. El diagnóstico diferencial incluye: neumonías adquiridas en la comunidad y síndrome de distrés respiratorio agudo (SDRA). La ausencia de las alteraciones hematológicas características del SPH orientan hacia neumonías o sepsis con SDRA. La presencia de infiltrados unilaterales no descarta la posibilidad de un SPH, especialmente si la tétrada hematológica característica se encuentra presente. La leptospirosis es otro de los diagnósticos diferenciales, cuando la enfermedad se presenta con compromiso pulmonar, sin embargo la forma grave (Enfermedad de Weil) se presenta con ictericia, lo que no ocurre en el SPH. Se debe tener presente que ambas enfermedades pueden coexistir (39) (Figura 9).
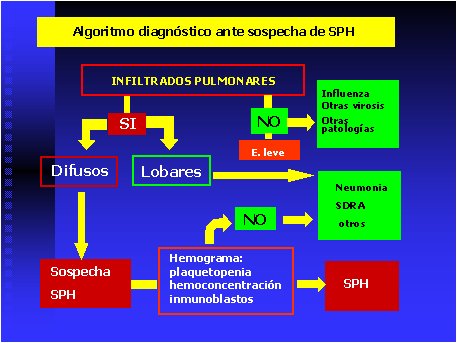 Tamaño completo
Tamaño completo Figura 9. Algoritmo diagnóstico durante la fase cardiopulmonar del SPH.
La confirmación diagnóstica en esta etapa se puede establecer mediante las siguientes técnicas:
- Serología, (la mejor muestra que se puede obtener de pacientes fallecidos, si no se ha sospechado el diagnóstico oportunamente, es la de sangre total por punción cardiaca, post mortem).
- Transcripción reversa acoplada con Reacción de Polimerasa en cadena (RT-PCR): detección del material genético viral en células infectadas presentes en coágulos y tejidos (pulmón, hígado, riñón y bazo). Sólo se reserva para casos sospechosos sin confirmación serológica o pacientes fallecidos.
- Inmunohistoquímica: detección de antígenos virales en células infectadas presentes en tejidos. Se usa en investigación y en el diagnóstico retrospectivo en donde sólo se dispone de tejido fijado en formalina (40).
Tratamiento
Se han utilizado fármacos antivirales, tales como la ribavirina, la cual es eficaz tanto in vitro como in vivo, en la FHSR. En la fase cardiopulmonar del SPH no se ha demostrado utilidad de los antivirales, posiblemente porque el curso es más rápido y son administrados tardíamente (41). Es posible que la ribavirina administrada precozmente durante la fase prodrómica sea también eficaz en el SPH, sin embargo debido a sus reacciones adversas, tales como anemia que requiere de transfusiones y pancreatitis, el uso empírico no es recomendable.
Como la gravedad del cuadro clínico es mediado por mecanismos inmunológicos existe cierta racionalidad para administrar corticoides sistémicos. Si bien se ha visto una mejor evolución en pacientes que han recibido terapia esteroidal, no existe actualmente evidencia suficiente acerca de su utilidad. Se encuentra en marcha un estudio multicéntrico, placebo–controlado, doble ciego, para evaluar la eficacia de la metilprednisolona en el SPH.
El uso de suero de supervivientes se ha empleado como medida heroica y anecdótica sin resultados satisfactorios. La identificación y producción de anticuerpos neutralizantes monoclonales de ratón se encuentra en etapas avanzadas en los Estados Unidos y en nuestro país, pero se deberá esperar los resultados de estudios clínicos. Por lo tanto el tratamiento actualmente, es sintomático y depende de la condición del paciente.
Los pacientes en fase prodrómica o con enfermedad leve deben ser hospitalizados para monitorizar la función respiratoria, hemodinámica, hemograma y laboratorio de rutina. Aquellos pacientes con plaquetopenia, inmunoblastos, con o sin elevación del hematocrito, (estos hallazgos preceden la aparición de edema pulmonar) así como aquellos que comienzan con compromiso respiratorio (dificultad respiratoria, baja saturación de oxígeno, infiltrados radiológicos) y/o hipotensión, deben ser trasladados a un centro que cuente con una Unidad de Cuidados Intensivos (UCI), debido a que la agravación del edema pulmonar suele ocurrir en menos de 24 horas y la hipotensión es rápidamente progresiva. Se debe evitar en lo posible el aporte de volumen, debido a que los fluidos, tanto cristaloides como coloides, contribuyen a aumentar la gravedad del edema pulmonar por la gran alteración de la permeabilidad capilar existente. Aquellos pacientes que desarrollan una insuficiencia respiratoria severa (PaO2/FiO2 <200) deben ser conectados a ventilación mecánica (VM) invasiva, con técnicas de VM protectora. Debido a la acidosis metabólica por lactacidemia grave, no se debe permitir la hipercarbia (10,32,42). Los pacientes con SPH rara vez tienen compromiso de conciencia manteniéndose alerta, sufriendo gran agitación. Su adaptación al VM es difícil y requieren de sedación y relajación. Como presentan taquicardia, se deben preferir fármacos relajantes y sedantes que no provoquen mayor hipotensión ni taquicardia, tales como besilato de altracurio y lorazepam en infusión contínua. Desde el punto de vista hemodinámico los pacientes con SCPH deben ser monitorizados con computadores de gasto cardíaco, sea mediante el catéter de Swan Ganz o sistemas menos invasivos como la termodilución transcardiopulmonar, utilizando el computador Pulse Contour Cardiac Output (PiCCO) (42,43).
Es recomendable usar precozmente fármacos vasoactivos tales como: adrenalina, noradrenalina, fenilefrina, dopamina y dobutamina. En muchos pacientes es necesario asociar más de dos drogas. Aquellos pacientes que desarrollan shock cardiogénico cursan con presiones de capilar pulmonar normales o bajas, índices de resistencia vascular sistémica elevados e índice cardíaco normal o bajo.
Los pacientes que desarrollan shock cardiogénico tienen una mortalidad de 100% a no ser que sean sometidos a circulación extracorpórea con oxigenador de membrana, recurso que ha demostrado ser útil en el shock cardiogénico por hantavirus refractario a drogas vasoactivas (42). Los pacientes que desarrollan una falla renal importante requieren de hemodiálisis o de hemodiafiltración, dependiendo de su condición hemodinámica.
Debido a que el diagnóstico diferencial con neumonías de la comunidad es extremadamente difícil, se sugiere administrar antibióticos recomendados para el tratamiento empírico de las neumonías graves de la comunidad y mantener los antibióticos hasta la confirmación diagnóstica de SPH. En caso de hemorragias graves se debe administrar hemoderivados: plaquetas, crioprecipitado, plasma fresco y/o glóbulos rojos.
Evolución y convalecencia
La mortalidad inicial del SPH en Chile fue de sobre 50% y ha disminuido al 26% en los últimos dos años, probablemente por el diagnóstico precoz, mayor conocimiento de la patogenia y mejor enfoque terapéutico en cada una de las etapas de la enfermedad.
Factores de mal pronóstico y asociados con 100% de mortalidad, son:
- PaO2/FiO2 < 50 mm Hg.
- Shock cardiogénico con índice cardiaco (IC) < 2,5 L/min/m2.
- Lactato en sangre > 4,0 mmol/L.
- Aparición de taquicardia o fibrilación ventricular y disociación electromecánica.
Aquel paciente en fase cardiopulmonar que se estabiliza luego de las primeras 48 horas, generalmente se recupera tan rápidamente como agravó, a menos que ocurran complicaciones propias de la enfermedad, tales como el shock cardiogénico y arritmias graves, infección nosocomial o complicaciones iatrogénicas.
La insuficiencia respiratoria mejora durante la primera semana, a la par con la radiografía de tórax. La normalización de los exámenes de laboratorio ocurre paulatinamente en un período no mayor a los 10 días. La fase de recuperación cursa con poliuria importante que puede durar hasta 15 días. La recuperación plena es la regla, sin embargo estudios de seguimiento demuestran que puede haber, fatigabilidad, bradipsiquia, disnea, obstrucción de la vía aérea periférica, trastornos congnitivos, hipoacusia sensorioneural y trastornos visuales hasta meses e incluso años después.
Prevención del SPH
Se puede prevenir la infección por hantavirus, evitando el contacto con ratones silvestres, sus excretas u orinas, así como usando medidas adecuadas de protección personal.
Evitar que los ratones ingresen al hábitat del hombre.
- Evitar que los ratones entren en la casa.
- Tomar precauciones al ingresar al hábitat del roedor.
- Ventilar las bodegas u otras construcciones campesinas deshabitadas antes de entrar.
- Seguir las normas recomendadas para acampar.
Tomar precauciones ante la posible transmisión nosocomial
- Cumplir las normas y precauciones universales de protección personal.
Con el objetivo de evitar que los ratones ingresen al hábitat del hombre, se deben tomar las medidas que disminuyen la posibilidad de anidación, reproducción y alimentación del ratón cerca del hombre. Se recomienda mantener el patio y los alrededores de la casa libres de basura, deshechos, escombros y leña. La basura doméstica debe ser acumulada en depósitos cerrados resistentes a ratones o puede ser enterrada, así como quemada en lugares alejados de la vivienda. Cortar los arbustos y/o maleza en un radio de 30 metros alrededor de la casa, así como sellar viviendas, galpones y bodegas tapando los agujeros con latas o virutillas de acero.
Antes de ingresar a cualquier edificación previamente deshabitada, se recomienda ventilar antes de entrar. Usar una mascarilla doble filtro HEPA, rociar con agua clorada (2 cucharadas soperas de cloro en 5 litros de agua) y dado que la solución con cloro no es instantánea, esperar 15 minutos antes de limpiar.
Evite acampar en lugares en donde se advierta la presencia de roedores. Acampe en lugares despejados libres de desperdicios y lejos de pastizales. Use carpas con piso y no duerma a ras de suelo. Mantenga los alimentos en envases herméticamente cerrados. Lave inmediatamente tras usar, los utensilios de cocina. Beba sólo agua potable, embotellada o hervida.
En el manejo clínico de todo sospechoso de hantavirus, se recomienda hospitalizar al paciente en habitación individual (aislamiento de gotitas). Durante la atención directa: utilizar mascarillas gruesas, protección ocular, guantes, delantal y pechera. En el laboratorio: usar mascarilla, protección ocular y manipular tubos con fluidos, usando una gasa al abrirlos.
Agradecimientos
Agradecemos a los investigadores del Proyecto Hantavirus: Ecología y Enfermedad:
Dr. Pablo Vial Claro, Investigador principal Proyecto Hantavirus: Ecología y Enfermedad, Santiago, Chile.
Dr. Gregory Mertz, University of New Mexico, Estados Unidos.
Dr. Frederick Koster, University of New Mexico, Estados Unidos.
Dr. Brian Hjelle, University of New Mexico, Estados Unidos
EU Viviana Sotomayor, Epidemióloga, MINSAL, Santiago, Chile.
Sr. T.M. Héctor Galeno, MS Sección Virología, Instituto de Salud Pública, Santiago, Chile.
Sra. Rita Mansilla, Médico Veterinario, Epidemióloga, Servicio Salud X Región, Valdivia, Chile.
Dr. Carlos Mansilla, anátomo patólogo, Hospital Coyhaique, XI Región, Chile.
Dr. Juan Pascale, Azuero, Panamá.

