Publicado el 1 de junio de 2005 | http://doi.org/10.5867/medwave.2005.05.2393
Vacuna influenza
Influenza vaccine
Resumen
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
Vacunación 2005
Existen varios tipos de vacuna; la que está disponible actualmente es a virus inactivado. La vacuna cambia año a año y su preparación se realiza según las normas del CDC y la OMS, la que depende del virus preponderante en la campaña invernal anterior en el hemisferio norte, o sea, Europa y Estados Unidos dan la pauta de qué virus viene y con ese patrón viral se prepara la vacuna que llega al hemisferio sur. El virus se cultiva en embrión de pollo y se necesitan miles de huevos empollándose con el virus, así que es necesario tener una gran cantidad de gallinas para producir estas vacunas; luego, el virus es inactivado mediante purificación del alantoides y remoción de algunas proteínas, y posteriormente se hace una estandarización para que cada jeringa prellenada contenga 15 microgramos de hemaglutinina de cada virus.
Esta vacuna incorpora dos subtipos de virus A, H1N1 y H3N2, y un subtipo de virus B. La vacuna programada para el año 2005 contiene las siguientes cepas:
- A/Wellington, que fue diagnosticada en enero de 2004 y es una cepa australiana H3N2, que tuvo un comportamiento bastante significativo en el hemisferio norte;
- A/Nueva Caledonia, que está desde 1999 circulando en la vacunación y es H1N1.
- La tercera cepa recomendada por la OMS puede ser la B/Jiangsu 2003, que es la que contiene la vacuna del ministerio, de nombre Influvac, o una símil Jiangsu, la B/Shangai 2002, que es la que contiene la vacuna Fluarix; ambas están aceptadas como antigénicamente similares, pero la recomendada por la OMS es la B Jiangsu.
El programa para el año 2005 contemplaba, por primera vez, la vacunación a niños de entre 6 y 12 meses de edad; sin embargo, en la partida adquirida con este fin se detectó que una de las tres cepas que contenía la vacuna tenía una menor concentración de antígeno que el estándar recomendado por la OMS. La afectada era la cepa Wellington 2004, que presentaba menor concentración de antígenos definidos en el estándar. Por eso, la vacunación a este grupo etario no se concretó.
Tipos de vacunas
Las primeras vacunadas utilizadas contra la influenza eran a virus entero, es decir, se preparaba y esterilizaba un virus inactivado y luego se administraba. Con el tiempo se sintetizaron las vacunas split o fragmentadas, en las cuales venían sólo sectores de la “corteza viral”, manteniendo la hemaglutinina y la neuraminidasa como antígenos. Finalmente se desarrollaron las vacunas de subunidades, que contienen sólo hemaglutinina y neuraminidasa purificadas (véase Figura 1).
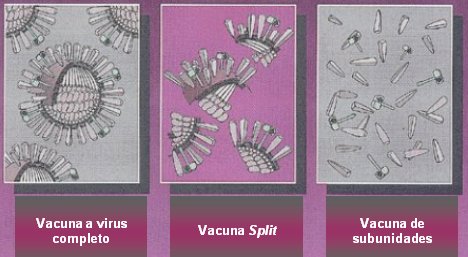 Tamaño completo
Tamaño completo Figura 1. Inmunización contra influenza. Tipos de vacunas inactivadas.
Las vacunas a virus fragmentados disponibles son Fluvarix, de la casa Glaxo Smithkline, y Vaxigrip, de la casa Pasteur. Influvac es una vacuna a subunidades de procedencia holandesa, que fue administrada en la campaña de invierno del 2004 y 2005; es una vacuna un poco más purificada.
Las vacunas a virus entero tienen antígenos internos y externos y contienen mucho lípido, de modo que son mucho más reactogénicas y producen más reacciones adversas, especialmente en los niños, como fiebre y compromiso del estado general. Las vacunas fragmentadas tienen antígenos internos y externos, pero están libres de lípidos, por lo tanto tienen menos reacciones adversas, con buena inmunogenicidad y muy baja reactogenicidad. En las vacunas a subunidades se remueven los antígenos internos, manteniéndose la inmunogenicidad, con menos reacciones adversas.
Las vacunas inactivadas, una vez administradas, inducen la producción de anticuerpos dirigidos contra la hemaglutinina y la neuraminidasa; los primeros neutralizan la infectividad del virus impidiendo que se adhiera al epitelio respiratorio y produzca enfermedad, mientras que los anticuerpos contra la neuraminidasa modifican la gravedad del cuadro de influenza. Primero se produce una respuesta local rápida, de IgM e IgA, que es pobre en los fluidos respiratorios altos y se puede detectar a los 14 días de la vacunación; después se produce una respuesta sistémica de IgG, IgM e IgA, que dura entre 6 y 10 meses, según los estudios; de ahí la importancia de efectuar una vacunación anual contra la influenza (J Infect Dis 1995; 171:198-203).
Se ha demostrado que los escolares sanos, (6 años para los norteamericanos, 8 años para los franceses) y los adultos jóvenes sanos tienen una respuesta sérica uniforme y adecuada a la vacunación con vacunas inactivadas (J Infect Dis 1977; 136:722-30 y NEJM 2000; 343:1778-87), mientras que los lactantes, preescolares, adultos mayores e individuos inmunocomprometidos desarrollan una respuesta de anticuerpos menor, muy variable y muchas veces no alcanzan los niveles de seroprotección adecuados. Este es el fundamento de que el lactante o preescolar que se vacunan por primera vez en su vida requieran dos dosis.
Eficacia
La eficacia de la vacunación está muy relacionada con la concordancia antigénica entre el patrón de vacuna que llega desde el hemisferio norte y la cepa que origina el brote epidémico en el hemisferio sur; si en el hemisferio norte predominó la Wellington y en Chile el brote es producido por un virus nuevo, no va a haber concordancia antigénica y la respuesta a la vacuna va a ser menor.
Cuando en la comunidad existe concordancia antigénica con la vacuna, la eficacia oscila entre 70 y 90%, en términos de prevenir la enfermedad en menores de 65 años (MMWR 1997; 46:1-25); a esta vacuna no se le exige la eficacia de las vacunas clásicas que se les administra a los niños, de 85 a 90% hacia arriba, sino que se le permite una eficacia menor. En ausencia de concordancia, la eficacia oscila entre 30 a 60% en adultos y en niños, según si hubo un drift o un shift (JAMA 1985; 253:1136-9; Ann Intern Med 1995; 123:518-27; J Infect Dis 1997; 176: Suppl 1:S38-44).
En un estudio realizado entre 1993 y 1996, en mayores de 65 años con enfermedad pulmonar crónica, a los cuales se les administró vacuna inactivada, se observó 52% de reducción de hospitalización por neumonía; 70% de reducción de las muertes y 36% de reducción de las consultas médicas por causa respiratoria (Ann Intern Med 1999; 130:397-403), lo que demuestra que es una vacuna eficaz en relación al costo, ya que disminuye la gravedad y la mortalidad de la enfermedad.
En otro trabajo, publicado en 2003, se observó que la vacuna reduce en 30 a 50% la mortalidad en adultos mayores de 65 años y previene 30% de los ingresos hospitalarios por enfermedad respiratoria (Vaccine 2003; 21:1769-75).
También se ha demostrado que, cuando el personal está inmunizado, disminuye la mortalidad de pacientes institucionalizados en centros de cuidado; de ahí la importancia de que el personal que cuida a gente mayor o pacientes en riesgo se vacune, ya que la letalidad de estos pacientes baja de 17 a 10% (J Infect Dis 1997;175:1-6).
Finalmente, la vacuna inactivada reduce la incidencia de otitis media aguda estacional en niños en 83% (Am J Dis Child 1991; 145:445-8) y reduce la incidencia de otitis media aguda en niños de 6 a 36 meses que asisten a salas cuna (Arch Pediatr Adolesc Med 1995; 149:1113-7).
Reacciones adversas
Respecto a reacciones adversas, hasta 25% de los adultos pueden presentar dolor local durante uno a dos días (Arch Intern Med 1996; 156:1546-50); aunque sea muy purificada, la vacuna de todas maneras presenta un alto porcentaje de reacciones locales. Se ha descrito fiebre muy alta en niños cuando reciben vacuna a virus entero, lo que no corresponde a la realidad actual (J Infect Dis 1977; 136:732-41). En cuanto a la temida hipersensibilidad a la proteína del huevo, la reacción en general es inmediata y grave, pero los reportes de casos son muy aislados (J Pediatr 1998; 133:624-8).
En 1976 se produjo una alerta médica importante, porque ese año la administración de la vacuna coincidió con un brote de Guillain–Barré en los Estados Unidos, lo que llevó a plantear como causante a esta vacuna, por un fenómeno inmunológico de desmielinización secundaria, del cual nunca se aclaró su patogenia (Am J Epidemol1979;110:105-23); sin embargo, estudios posteriores no han confirmado estos hallazgos y no se volvieron a producir brotes de este síndrome otros años, a pesar de la vacunación.
En un estudio prospectivo, multicéntrico, desarrollado entre 1992 y 1994, cuyo objetivo fue aclarar esta asociación, se encontró un riesgo relativo de 1,7, con un intervalo de confianza estadísticamente significativo, obteniéndose como conclusión que la vacunación contra la influenza representa alrededor de un caso adicional de Guillain–Barré por cada millón de vacunados (N Engl J Med 1998; 339:1797-802).
Sobre seguridad e inmunogenicidad, existen 22 estudios realizados en niños desde 1970, pero el número de niños de alto riesgo incluidos es, generalmente, muy bajo; por lo general participan preescolares o escolares sanos, de modo que hay escasa evidencia disponible de pacientes con cardiopatía, prematurez, displásicos, VIH, etc. Sin embargo, se ha demostrado que las vacunas fragmentadas o de subunidades presentan menos reacciones adversas, en forma significativa, en niños, por lo tanto, este tipo de vacunas son seguras e inmunogénicas en niños sanos, pero se requieren dos dosis en lactantes y preescolares para asegurar una seroconversión y nivel de anticuerpos protectores con la primera administración (CID 2004;38:678-88).
Con respecto a la eficacia en niños, existen 9 comunicaciones sobre administración de vacunas en niños, según las cuales, la eficacia con virus influenza A oscila entre 31 y 91%, o sea, es variable. La eficacia contra virus B siempre es menor, 45% en promedio en estos 9 reportes. Existe un trabajo que no demostró impacto en otitis en lactantes de 6 a 12 meses, cuando eran vacunados, pero como ya se mencionó, existen dos trabajos que sí demuestran impacto en la incidencia de otitis media aguda estacional en los pacientes pediátricos.
Uno de los hallazgos más destacados del último tiempo, en términos epidemiológicos, es que la vacunación en los escolares, aunque no constituyen un grupo de riesgo importante, reduce de manera significativa la influenza en personas mayores, tal como se observó en Japón desde 1980 en adelante, donde se vacunó a toda la población de escolares y hubo una reducción significativa de la influenza en los adultos mayores, con reducción de la mortalidad de 100% a 20%, mientras que cuando se dejó de vacunar, desde 1997 a 1998, hubo un repunte de los ingresos hospitalarios, consultas respiratorias y letalidad en los adultos mayores (CID 2004;38:678-88).
Indicaciones y contraindicaciones de la vacuna contra la influenza
La normativa del Ministerio de salud (Minsal) se ajusta a lo que dicta la OPS, el CDC (Centers for Disease Control and Prevention), la NCID (National Center for Infectious Diseases) y todas las instituciones internacionales que recomiendan la vacunación. Según esta norma, deben ser vacunados:
- Los mayores de 65 años. En Estados Unidos, desde 2003 se vacuna a la población mayor de 50 años, porque se considera que es una población de mayor riesgo.
- Las embarazadas con más de 13 semanas de gestación, porque la incidencia de influenza cada vez es mayor en ellas.
- El personal de salud hospitalario y de atención primaria, porque está demostrado que el vacunar a la gente que está en contacto con pacientes de riesgo disminuye la transmisión de influenza hacia los pacientes.
- La población de 6 meses a 18 años que está en tratamiento prolongado con aspirina (por ejemplo, por un Kawasaki).
- Los prematuros mayores de 6 meses con patología crónica respiratoria o cardíaca.
- La población de 6 meses a 64 años en control médico por patologías crónicas como: tratamiento antineoplásico o inmunosupresor; diabetes no insulinodependiente que haya tenido un ingreso hospitalario en 2004; todo paciente diabético insulinodependiente; pacientes con neumoconiosis, fibrosis quística, displasia pulmonar o asma comprobada; portadores de enfermedad bronquial obstructiva crónica, enfisema, tuberculosis pulmonar; enfermedad coronaria isquémica, enfermedad cardíaca crónica; insuficientes renales crónicos en diálisis; discrasias sanguíneas graves; y portadores de VIH/SIDA, según la etapa en la que estén, porque todavía es controvertido.
- Por primera vez en Chile se iba a vacunar a lactantes de 6 a 12 meses, pero, como se explicó, no pudo hacerse en 2005.
- Además, se deben vacunar los pacientes crónicos institucionalizados, de cualquier edad y las personas en contacto con pacientes de riesgo: integrantes del equipo de salud, personal de hogares de ancianos o instituciones de pacientes crónicos y convivientes con pacientes en riesgo.
La ACIP, que es el organismo preocupado de las inmunizaciones pediátricas en Estados Unidos, debido al aumento en el riesgo de enfermar, de hospitalizarse y de sufrir complicaciones por la influenza, promueve la vacunación para todo niño, independiente de la comorbilidad que tenga, de 6 meses a 2 años de edad. Esta recomendación fue publicada en 2004, pero la propuesta del ACIP se hizo a fines de 2003 (NEJM 2004; 350:218-20).
En países como Canadá, que tienen una amplia cobertura en vacunas, se ha aumentado la cobertura en período interpandémico, por el miedo que existe en la actualidad, dado el cruce entre animales y humanos, a que en cualquier momento se produzca un cambio antigénico mayor y se origine una pandemia de influenza que, si no existe una memoria inmunológica, podría causar la muerte de millones de habitantes. Previendo esta situación, Canadá está vacunando, desde el año 2000, a toda la población mayor de 6 meses de edad. Esta medida tiene un beneficio adicional, que es el efecto observado en Japón de protección del adulto mayor a través de la vacunación de los escolares (Can Med Assoc J 2001;164:36-7).
La producción mundial de vacuna no alcanza para vacunar a toda la población, por eso es necesario distinguir las poblaciones de riesgo; sin embargo, cada vez existen más recomendaciones internacionales y del CDC para crear laboratorios de emergencia para producir vacunas y para promover la inmunización lo más amplia posible de toda la población, sea cual sea su grado de riesgo, incluyendo a escolares y preescolares.
En Chile, a raíz del brote de SARS, en 2002 se creó la agrupación “Preparando la pandemia”, en la cual participan infectólogos y epidemiólogos en conjunto con el Ministerio de Salud. Esta agrupación está entregando constantemente información de casos y motivó que se instituyera una normativa en el aeropuerto Pudahuel de Santiago, según la cual, cada viajero con síntomas respiratorios debe pasar por un control antes de entrar al país. En febrero de 2005 se detectó un caso de malaria crónica.
Las contraindicaciones formales son las habituales de las vacunas: antecedente de anafilaxia con vacunas anteriores; cuadro febril actual; pacientes menores de 6 meses, porque no existen estudios en este grupo etario, debido a que ellos reciben la DPT y la antipolio y es difícil establecer la interferencia entre los anticuerpos; primer trimestre del embarazo, porque a pesar de que se han vacunado mujeres que desconocían su embarazo y no se ha producido teratogenicidad, no hay estudios controlados en embarazos precoces; finalmente, está contraindicada en pacientes con alergia reconocida y demostrada al huevo.
El calendario posológico chileno establece que:
- El niño de 6 a 35 meses se vacuna con 0,25 ml, la primera vez con dos dosis y después, con sólo una dosis.
- De 3 a 8 años, se administra una vacuna entera, 0,5 ml, si es primera vez dos dosis, si es segunda vez, una dosis.
- En mayores de 9 años se administra una dosis de adulto por una vez, sea o no la primera dosis que recibe en su vida.
Nuevos tipos de vacuna
Con el objetivo de aumentar la eficacia y evitar el dolor de la inoculación y las reacciones adversas, la industria ha ampliado la gama de inmunizaciones contra influenza desarrollando vacunas a virus vivos atenuados, fundamentalmente de subtipos A y B, trivalentes (llevan 2 A y un B), que se administran mediante aerosol por vía nasal. Esta vacuna induce síntomas respiratorios superiores, o sea, congestión alta, en 10 a 15% de los vacunados. En personas sanas, reduce en 85% los casos para virus H1N1 y sólo 58% para virus H3N2, con respuesta serológica y clínica y, aplicada en adultos sanos, reduce el ausentismo laboral y el costo directo que éste implica para el país, que es elevado (J Infect Dis1994;169:68-76; J Infect Dis 2000;181:725-8).
Las vacunas atenuadas nasales han sido probadas básicamente en población sana, pero existe un estudio en pacientes inmunocomprometidos por VIH, en etapas menores de compromiso inmunológico, en los que no produjo mayores complicaciones. En el único estudio que existe en niños, en una población de 5 a 7 años de edad, la vacuna fue bien tolerada y confirió una protección cercana a 92%. El diagnóstico de influenza se hizo mediante cultivo, por lo que se considera un muy buen trabajo desde el punto de vista de la certeza del diagnóstico. Además, la vacuna redujo la incidencia de otitis media aguda febril en 27% de los vacunados (NEJM 1998;338:1405-12). En grupos de edad menores no se ha demostrado beneficio.
Dentro de las vacunas atenuadas está FluMist, de MedImmune, que es una vacuna adaptada al frío; después de ser administrada, como es atenuada, el virus comienza a replicarse a 25 °C en la vía respiratoria alta, sin llegar a replicarse en el pulmón. Está licenciada y aprobada para pacientes de 5 a 49 años, que es la población sana en la que se ha estudiado y se puede administrar de forma simultánea con otras vacunas. No está indicada para pacientes ni contactos de pacientes de alto riesgo, porque no se ha estudiado en estos grupos. Tiene buena inmunogenicidad (MMWR 2003; 52:1-36).
Nasaflu es una vacuna virosomal inactivada (subunidades) nasal. En este caso, a una partícula de virosoma se le adhieren subunidades de hemaglutinina o neuraminidasa, mediante un adyuvante, que es una toxina termolábil de E. coli. Esta vacuna también es nasal, pero es con virosoma, no como la anterior. En Suecia se describió un aumento de las consultas por parálisis de Bell en la población general, en relación con esta vacuna, por lo que se llevó a cabo un estudio de casos y controles en el que se encontró un riesgo 19 veces mayor de presentar parálisis de Bell con esta vacuna, por lo que cayó en descrédito con rapidez (NEJM 2004; 350:896-903).
Hace 15 años que no se emplean las vacunas a virus enteros, que fueron reemplazadas por las fragmentadas; en 2004 llegó a Chile la vacuna a subunidades por primera vez y fue objeto de una campaña en su contra, con el argumento de que no estaban comprobadas su eficacia ni su inmunogenicidad, debido a un trabajo (Randomised placebo-controlled study of inmunogenicityand efficacy of live inactived influenza vaccines in elderly persons in Russia) realizado en Moscú, acerca de la eficacia e inmunogenicidad de distintas vacunas en 534 pacientes mayores de 65 años con comorbilidades tipo cardiopatía, diabetes descompensada y enfermedad pulmonar crónica. El diagnóstico de influenza fue confirmado por serología.
Los resultados indicaron que la vacuna Vaxigrip, de Aventis, tuvo una eficacia de 62,7% y la vacuna Fluarix, de Glaxo, de 53,9%; ambas son vacunas fragmentadas. La Influvac, de Solvay, tuvo 34,4% y por esto la eficacia de estas vacunas estuvo en discusión, pero éste es un trabajo científico, bien realizado y los resultados son poco generalizables, considerando que la población en estudio era mayor de 65 años y con comorbilidades.
En 1998 se publicó un metaanálisis de 22 publicaciones efectuadas entre 1975 y 1995, en las que se evaluó con serología la reactogenicidad de las vacunas de subunidades, enteras y split y no se encontraron diferencias significativas en cuanto a respuesta serológica, o sea, en grupos etarios similares, los distintos tipos de vacunas causaron respuestas similares, sin diferencias significativas (Comparison of serology and reactogenicity betwen influenza subunit vaccines and whole virus or split vaccines. Clin Drug Invest 1998,1:1-10).
Existen escasos datos en niños, ya que éstos son poco elegibles para estudiar las vacunas, pero en esta revisión se encontraron menos reacciones adversas sistémicas, como cefalea y decaimiento, con las vacunas a subunidades.
Otro trabajo, publicado en 1999, recopiló 15 años de experiencia con vacuna influenza a subunidades y abarcó 57 estudios efectuados entre 1982 y1996, en los que se siguieron 4.700 adultos en un período durante el cual se administraron 87,5 millones de dosis, comunicándose sólo 273 reacciones adversas, 121 de ellas serias, incluyendo 13 casos de Guillain–Barré. Las reacciones adversas fueron: desencadenar asma, en 0,27 casos por millón de dosis; muerte, en 0,8 por millón de dosis; alergia, en 0,96/millón de dosis y shock en 0,16/millón de dosis. Se demostró una protección serológica a toda edad para virus A H3N2, de 80%; para H1N1, de 74% y para B, de 67%. En la población mayor de 60 años, que es la menos respondedora, los porcentajes bajaron a 68, 60 y 60% respectivamente, o sea, la población mayor responde menos a esta vacunación (Fifteen years experience with a subunit influenza vaccine. J Clin Res 1999;2:111-39).
Finalmente, en un trabajo de 1992, también de años de experiencia, en el que se reclutó a 3.200 sujetos vacunados entre 1982 y 1991, se evaluó las reacciones adversas en 1.598 de ellos y se encontró que la vacuna a subunidades tuvo reacciones locales en 38% de los casos (eritema, dolor, induración) y síntomas sistémicos en 20% de ellos (cefalea 11%, decaimiento 7%, insomnio 4% y fiebre 3%) (Influenza sub unit vaccine. Ten years experience. Europ J Clin Res 1992; 3:117-35).
Después de revisar ampliamente los tipos de vacunas, se puede llegar a la conclusión de que la vacuna a subunidades es tan confiable como la vacuna fragmentada, quizás con un poco más de reacciones adversas de tipo local, pero menos reacciones sistémicas.

