Publicado el 1 de abril de 2007 | http://doi.org/10.5867/medwave.2007.03.2375
Impacto de la tecnología en diálisis sobre los factores de riesgo cardiovascular relacionados con la uremia
Impact of technology on dialysis on cardiovascular risk factors associated with uremia
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en Simposio organizado por Fresenius Medical Care.
Introducción
Los cuidados de salud del paciente en diálisis han mejorado notablemente durante los últimos treinta a cuarenta años, gracias a los avances en las ciencias biomédicas y la tecnología. En esta conferencia se analizará la relación entre la tecnología en diálisis y los factores de riesgo cardiovascular.
Si se seleccionan en forma adecuada ciertos aspectos de la tecnología en diálisis, es posible mejorar los resultados de los pacientes. Como se ha señalado en repetidas ocasiones, la uremia representa un factor de riesgo cardiovascular en sí mismo: cualquier paciente urémico tiene mayor riesgo de enfermedad cardiovascular, como se expresa claramente en las guías KDOQI (Kidney Disease Outcomes Quality Initiative), cuyo resumen ejecutivo señala que “aquellos pacientes con enfermedad renal crónica, sin importar el diagnóstico, tienen mayor riesgo de enfermedad cardiovascular”. A su vez, sugiere que “todos los pacientes urémicos deben ser incluidos en el grupo de mayor riesgo de enfermedad cardiovascular, sin importar la presencia o ausencia de otros factores de riesgo tradicionales”. Se sabe que, a medida que se deteriora la función renal y se reduce la tasa de filtración glomerular, aumenta la probabilidad de eventos cardiovasculares en los pacientes sometidos a diálisis, como se demostró en un trabajo publicado recientemente en New England Journal of Medicine, en el que se encontró una relación inversa entre función renal y riesgo cardiovascular. Asimismo, se ha demostrado que un paciente de 25 a 30 años en diálisis tiene el mismo riesgo de morir por enfermedad cardiovascular que una persona de 85 años de la población general, lo que ilustra la gravedad de la situación.
El eje central de los problemas cardiovasculares se relaciona con la disfunción endotelial; este tema es tan importante, que la revista Kidney Internacional dedicó un suplemento completo a la disfunción endotelial que ocurre en pacientes con enfermedad renal crónica. En este sentido, el trabajo de Harper y Bates es muy pertinente, ya que relaciona en forma directa la disfunción endotelial con el grado de uremia (Endothelial permeability in uremia Steven J Harper and David O Bates Kidney Int 63: S41-S44; doi:10.1046/j.1523-1755.63.s84.15.x). Es importante recordar que una de las funciones esenciales del endotelio es la selectividad de bomba, o habilidad para controlar el transporte de solutos desde la sangre hacia los tejidos y viceversa, y que esta función crítica se altera por la uremia; así, el transporte de moléculas a través del endotelio es, normalmente, muy bajo, mientras que en los pacientes urémicos aumenta en forma dramática, debido a que su endotelio es disfuncional. A su vez, la función de barrera, que es una función esencial del endotelio, se encuentra reducida en el paciente urémico, en comparación con los individuos normales.
La célula endotelial es el principal escenario en la patogenia de las enfermedades cardiovasculares, porque todas las señales que llevan al remodelamiento cardíaco y vascular, es decir, a ateroesclerosis e hipertrofia ventricular izquierda, derivan del endotelio y de la célula endotelial cardiaca, respectivamente; por eso, se debe pensar en la aterogénesis como un proceso inflamatorio que a largo plazo daña las células endoteliales. En esencia, cualquier estímulo proveniente de la sangre gatilla una cadena de reacciones que atraen a leucocitos y macrófagos, que penetran las capas endoteliales donde, posteriormente, incorporan y oxidan LDL, dando origen a las células espumosas, cuyos productos favorecen el proceso de adelgazamiento de los vasos sanguíneos.
La enfermedad cardiovascular se produce por disfunción endotelial y ésta, de alguna manera, es favorecida durante la hemodiálisis. Los factores de riesgo cardiovascular son citados con frecuencia en congresos y publicaciones. Un paciente en diálisis que tiene uremia tiene aumentado su riesgo cardiovascular; si además tiene los factores de riesgo tradicionales, como hipertensión, diabetes, dislipidemia, obesidad, tabaquismo, edad, sexo, la situación será más grave, por lo tanto estos factores deben estar lo más controlados posible y se debe evitar que empeoren cuando el paciente ingrese a diálisis, si bien cuando de habla de los factores de riesgo relacionados con el procedimiento de diálisis, se debe tener claro que la diálisis no es un factor de riesgo por sí misma.
A continuación se analizarán estos factores y se discutirá hasta qué grado mejoran o empeoran los parámetros. Se analizarán tres componentes: membrana de diálisis, que es la protagonista de todo el proceso, ya que en ella ocurre la detoxificación; modalidad de terapia, es decir, el tipo de terapia elegida, considerando que estos dos aspectos están asociados, porque no es posible lograr hemodiálisis de alta eficiencia sin una membrana adecuada; por último, calidad del agua, que es una de las grandes fuentes de inflamación crónica sistémica.
Membrana de Diálisis
Una buena membrana de diálisis se caracteriza por su alta calidad en cinco aspectos, que son: rendimiento en cuanto a remoción de toxinas; retención de endotoxinas; biocompatibilidad; esterilidad y citotoxicidad.- El rendimiento: siempre se ha hablado de que se deben remover solutos de bajo peso molecular, pero ahora existe una nueva escuela de pensamiento que propone que también se deben remover toxinas de mayor peso, manteniendo un balance entre la remoción de estas toxinas y la pérdida de sustancias importantes, como la albúmina.
- La retención de endotoxinas se refiere a la presencia de endotoxinas en el agua, que pueden dar grandes problemas.
- La biocompatibilidad ha sido un tema sobre el que se ha discutido mucho.
- La esterilidad se debe conseguir con el agente más favorable, que es el vapor de óxido de etileno, ya que ha habido problemas con la radiación gamma.
- El último aspecto esencial de una buena membrana es la citotoxicidad, que se refiere a que cada vez que se trata al paciente, desde la membrana salen sustancias que se van hacia los tejidos.
En lo que se refiere a rendimiento, lo primero es definir lo que se desea extraer, considerando que el riñón normal remueve sustancias de un amplio espectro de pesos moleculares que están involucradas en la uremia. Con base en estos antecedentes, sería razonable fijar como objetivo la remoción de moléculas de bajo y alto peso molecular; y además, hacerlo en forma tan eficiente como el riñón normal.
En cuanto a la toxina que se debería remover, el grupo EUTox, dirigido por Vanholder, en Bélgica, publicó en el 2003, en la revista Kidney Internacional, una lista de alrededor de cien solutos de retención urémicos, clasificados en tres grupos: solutos de bajo peso molecular hidrosolubles, solutos ligados a proteínas y moléculas de mediano peso molecular. En esta presentación se han reclasificado estas cien sustancias de acuerdo a su tamaño y el análisis se enfocará en algunas de ellas. La remoción de sustancias en la diálisis depende de los poros de la membrana, por lo que no es un procedimiento muy específico; por lo tanto, si se desea remover solutos de bajo peso molecular se debe utilizar membranas de bajo flujo, mientras que, si se quiere remover solutos de mayor peso molecular el ideal es utilizar membranas de alto flujo. En una clasificación muy arbitraria, se divide a las toxinas urémicas en tres grupos: bajo 500 Dalton, entre 500 y 12.000 D y sobre 12.000 D, siendo este valor cercano al peso molecular de la microglobulina (Tabla I).
 Tamaño completo
Tamaño completo La nueva ciencia de la proteómica, que estudia el conjunto completo de proteínas que se pueden obtener de un genoma mediante espectroscopía de masas, se ha utilizado para tratar de descifrar la fisiopatología de la uremia. Un grupo de investigadores comparó el ultrafiltrado de membranas de alto y bajo flujo y comprobó que en el ultrafiltrado de las membranas de alto flujo se encuentran más de 1300 “toxinas”, mucho más que en el ultrafiltrado de las membranas de bajo flujo; pero ¿cuál de ellas interesa remover? Estos resultados no son novedosos para aquellas personas con experiencia en diálisis, porque la electroforesis de proteínas demostró lo mismo en el pasado.
En resumen, el dilema en diálisis es, qué sustancia se debe remover. El grupo de EUTox propone que existen 100 sustancias, los estudios de proteómica muestran que existen 1400, los nefrólogos solicitan a la industria que desarrolle mejores membranas y ésta pide que se clarifique qué sustancia debería ser removida, pregunta difícil de responder, porque no existe evidencia de que las consecuencias de la uremia se deban a una única sustancia. Algunos han propuesto a la homocisteína, otros, al fosfato, P-cresol o microglobulina y no se ha llegado a un consenso; sin embargo, no se debe olvidar que el objetivo final es mejorar la supervivencia de los pacientes, aun cuando no se sepa con exactitud qué sustancias se debe remover o cuál es el objetivo.
Las guías de manejo del Grupo de Expertos en Hemodiálisis de Europa recomiendan en forma categórica remover las moléculas de peso molecular intermedio, utilizando membranas sintéticas de alto flujo, y utilizar un agente convectivo o aumentar el tiempo o frecuencia de la terapia, para retirar la máxima cantidad de toxinas de mayor tamaño (evidencia nivel B). Esto se logra utilizando membranas de alto flujo asociado a convección, es decir, hemodiafiltración. Esta terapia se está usando en Europa y, en menor medida, en Japón. Los estadounidenses, como es habitual, están reticentes, pero es probable que pronto se pongan al día.
Cuando se intenta remover sustancias de bajo peso molecular se debe evitar que al mismo tiempo se filtren sustancias necesarias de alto peso molecular. Básicamente, se puede alterar las características del tamizado de la membrana, es decir, el tamaño del poro. En la Fig. 1, si la molécula se encuentra en la parte plana de la curva pasará completamente a través de la membrana, porque es más pequeña que el tamaño del poro. Por lo tanto, no se desea que estas moléculas atraviesen la membrana, pero se necesita tener un control cuidadoso de las moléculas de peso intermedio y para ello, se requiere el tipo adecuado de membrana. La ultrafiltración es un fenómeno muy complejo en el que se obliga al fluido a atravesar la membrana y, cuando éste pasa, arrastra todo con él. Una analogía es la de un paisaje en que el agua rueda con mucha fuerza cerro abajo y contra los árboles; el espacio entre los árboles son los poros de la membrana, por lo que, a mayor fuerza, más fluido es forzado a cruzar este espacio; por lo tanto, el paso de ciertas moléculas dependerá de la fuerza del agua y del espacio entre los árboles. El transporte convectivo es, en esencia, el flujo de solventes, con sus solutos incluidos, a través de una gradiente de presión; es decir, se fuerza el paso de fluidos para limpiar mejor la sangre del paciente; mientras más ultrafiltración, mejor.
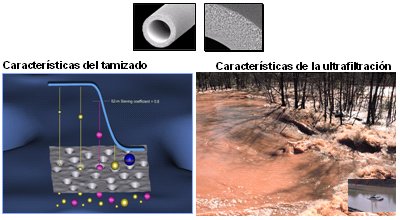 Tamaño completo
Tamaño completo La eficiencia de la eliminación de moléculas depende de la modalidad que se seleccione. Existen distintos tipos de diálisis, en las que se utilizan como parámetros el flujo sanguíneo, el flujo de diálisis y la filtración, que se relaciona con la pérdida de peso y el tiempo, entendiéndose que a mayor tiempo de diálisis, mejor es el tratamiento. En la Tabla II se comparan estas modalidades. La diálisis de bajo flujo es efectiva para moléculas pequeñas y algunas de mayor peso molecular; la hemofiltración, que no tiene flujo de diálisis, sino que es un procedimiento puramente convectivo, remueve sólo moléculas de mayor peso. La hemodiafiltración (HDF) es la mejor técnica disponible; consiste en una combinación de hemofiltración con hemodiálisis, es muy efectiva para la remoción de moléculas de bajo y alto peso molecular y hace exactamente lo recomendado por las guías europeas: remueve sustancias de todo el espectro de pesos moleculares.
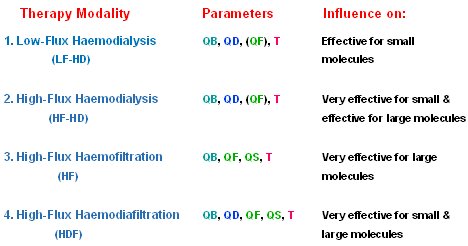 Tamaño completo
Tamaño completo La evidencia de esto existe desde 1985, poco tiempo después que la técnica fue inventada por Henderson. En el gráfico de la Fig. 2 se compara el clearance de sustancias de distinto tamaño (urea, beta-2 microglobulina y amilasa) para tres modalidades de diálisis: hemofiltración, hemodiálisis y hemodiafiltración. La hemofiltración no remueve sustancias pequeñas, porque no hay flujo de diálisis, es decir, no hay difusión; la HDF es muy efectiva, incluso para moléculas pequeñas, pero su mayor efectividad está en la remoción de moléculas de mayor peso, las llamadas toxinas urémicas o solutos de retención urémicos. En suma, la hemodiafiltración es una terapia híbrida, altamente eficiente para remover toxinas pequeñas y grandes y se debe aumentar la convección. Existe suficiente evidencia que sugiere que esta es la terapia de elección para nuestros pacientes.
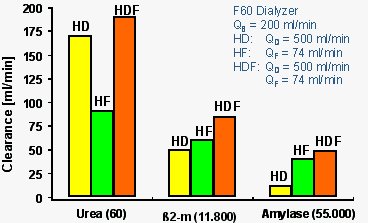 Tamaño completo
Tamaño completo Figura 2. Clearance de urea, beta-2 microglobulina y amilasa con tres modalidades de diálisis: hemofiltración, hemodiálisis y HDF(Wizemann V: Hemodiafiltration: an avenue to shorter dialysis? Contrib Nephrol 1985 44;49-56).
La eficiencia de la diálisis también depende del tipo de membrana que se utilice. En un estudio clínico realizado en Alemania del Norte se comparó la tasa de remoción de beta-2 microglobulina, que es un marcador de toxinas de peso molecular intermedio, con ocho tipos de membrana, todas ellas clasificadas como membranas de diálisis de alto flujo. Se encontró una gran diferencia entre la porosidad o capacidad de tamizaje de las membranas, ya que algunas removían hasta 76% de beta-2 microglobulina, mientras que otras removían sólo 50%. Por otra parte, es importante lograr la remoción eficiente de toxinas y minimizar la pérdida de sustancias útiles, en este caso, la albúmina; en este estudio, una de las membranas removió toxinas, pero causó una pérdida de 7 gramos de albúmina por tratamiento, equivalentes a más de 23 gramos por semana; otras membranas fueron muy ineficientes para remover moléculas de peso intermedio, pero causaron menor pérdida de albúmina; y otras consiguieron un buen equilibrio, con remoción de 72% de beta-2 microglobulina y pérdida de 2 gramos de albúmina. Por lo tanto, hay que elegir la membrana con cuidado.
Bonomini, en Italia, demostró el beneficio de remover sustancias de alto peso molecular, entre 10.000 y 20.000 Dalton. Este autor planteó la hipótesis de que la presencia de estas toxinas afecta a los glóbulos rojos, especialmente a la membrana celular, que contiene fosfatidilserina, la que, en presencia de estas toxinas, gira y queda expuesta en forma anormal en la cara externa de la membrana, lo que hace que el glóbulo rojo se adhiera al endotelio y promueva la aterogénesis o sea fagocitado por los macrófagos, produciendo anemia. Al comparar el ultrafiltrado por HDF que, como se ha señalado, es la forma más eficiente de diálisis, porque remueve sustancias de un espectro mayor que la hemodiálisis, se encontró mayor cantidad de las sustancias que causan las anormalidades en los glóbulos rojos. Bonomini demostró que con la HDF se producen menos alteraciones de los glóbulos rojos que con la hemodiálisis (Removal of uraemic plasma factor(s) using different dialysis modalities reduces phosphatidylserine exposure in red blood cells. Nephrol Dial Transplant 2004;19(1):68-74).
Existe una amplia evidencia de las ventajas de la HDF. En otro estudio se analizó la remoción de P-cresol, que funcionaría como un inhibidor de la proliferación de las células endoteliales y tendría un rol en la reparación de heridas; además viaja unido a proteínas, por lo que, en la práctica, es un soluto de mayor tamaño. Su remoción fue más eficiente con HDF que con la hemodiálisis estándar. Finalmente, mientras mayor sea el volumen de fluido de sustitución que se utilice, más eficiente será la detoxificación. No es posible revisar en poco tiempo la gran cantidad de evidencia disponible, pero se puede concluir que la HDF on-line tiene ventajas y que existiría una cierta mejoría en la tasa de supervivencia de los pacientes tratados con esta técnica, aunque falta que esto se verifique en estudios clínicos prospectivos.
Calidad del fluido de diálisis
En primer lugar, es necesario recordar en qué medida el paciente en diálisis está expuesto a este fluido. El ser humano está expuesto a 14 a 15 litros de fluidos cada semana, mientras que el paciente en diálisis está expuesto a 500 litros de fluidos en ese lapso, debido al intercambio en el procedimiento de diálisis, lo que depende de la modalidad que se emplee. Este fluido no se puede procesar en forma apropiada si hay cualquier contaminante, como lo haría el riñón natural, porque no hay una función renal normal. El líquido de diálisis puede tener una serie de contaminantes, como sustancias inorgánicas, orgánicas (relacionadas con la anemia) y contaminantes microbiológicos, que es nuestra principal preocupación, incluyendo componentes bacterianos y sustancias pirógenas, que inducen inflamación.Se podría pensar que la mala calidad del agua es un problema que se ve en países subdesarrollados, donde existen escasos recursos para tratar el agua, o en países con climas muy templados, donde las bacterias crecen fácilmente; pero en un estudio realizado en treinta unidades de diálisis en Alemania se encontró que el grado de contaminación bacteriana del fluido de diálisis era significativo y que los niveles de endotoxinas a las dos horas de diálisis eran muy elevados, llegando a 100 unidades en 20 a 25% de los centros de diálisis. Este es un tema importante para los centros de todo el mundo, por lo que cada uno de ellos tiene sus normas sobre la calidad del fluido de diálisis, con ciertas variantes; en general, se recomienda disminuir los niveles de endotoxinas a 0,03, con lo que se reduce la inflamación. Las guías europeas recomiendan a los centros de diálisis funcionar con agua ultrapura en forma rutinaria, no sólo para diálisis de alto flujo o hemodiafiltración, sino para todas las modalidades de diálisis.
Las endotoxinas, que proliferan dondequiera que haya fluidos o agua y crecen con gran facilidad en el biofilm, provienen de la pared de las bacterias gramnegativas, que contiene lipopolisacáridos que, como su nombre lo indica, tienen un componente lipídico y otro de hidratos de carbono; la potencia de la reacción del paciente dependerá de la composición química del lípido y del largo de la cadena de polisacáridos; posteriormente se produce una transferencia desde el exterior de leucocitos, que generan citoquinas proinflamatorias, como interleuquina (IL) 1 y 6 y TNF, que gatillan reacciones microinflamatorias. La transferencia desde el exterior se produce a través de la membrana y esto ocurre con gran facilidad. La presencia de lipopolisacáridos en al agua de diálisis puede producir dos fenómenos: activación leucocitaria y estrés oxidativo. El primero se relaciona con la síntesis de IL-6, que estimula la producción de proteína C reactiva en el hígado, uno de los marcadores más sensibles de inflamación; en el caso del estrés oxidativo, en vez de inflamación se generan especies reactivas de oxígeno y radicales libres, que pueden modificar a los lípidos y proteínas y acelerar la formación de productos de la oxidación de las proteínas o de la cascada de la coagulación. En conclusión, se puede producir inflamación y estrés oxidativo, ambos causantes de disfunción endotelial, que es lo que se debe evitar durante la diálisis.
En un estudio se demostró que la presencia de estrés oxidativo, manifestado por el aumento de los productos de la coagulación, se asocia a aumento de la inflamación, evaluado por un aumento del TNF; si se añade una pequeña dosis de lipopolisacáridos se produce una respuesta inflamatoria masiva y si se añade otra dosis, se produce un nuevo incremento. Por lo tanto, la suma de estrés oxidativo e inflamación produce un efecto conjunto mayor que cada uno por sí solo y es necesario disminuirlos durante el tratamiento del paciente en diálisis.
La diálisis debería remover solutos de mayor tamaño, pero las endotoxinas son del mismo tamaño que las toxinas que se desea remover y, dado que la membrana funciona en forma bidireccional, las sustancias pueden atraversarla fácilmente. Además existe otro fenómeno asociado a membranas de alto flujo, llamado “contratransporte”, que consiste en que en las membranas de bajo flujo, la presión del lado sanguíneo es siempre mayor que en el lado de la diálisis, por lo que las sustancias atraviesan hacia el dializador, mientras que en las membranas de alto flujo la presión en el lado de diálisis es mayor que en el lado sanguíneo, produciéndose filtración inversa, con paso de sustancias desde el dializador hacia la sangre en forma activa, debido a que los poros de la membrana permiten el paso de sustancias.
En los centros de diálisis se realiza una gran inversión para purificar el agua, pero no se hace en forma eficiente la remoción de endotoxinas, lipopolisacáridos y sustancias inflamatorias. Los análisis de los componentes del agua siempre demuestran la presencia de endotoxinas o bacterias, por lo que el tratamiento del agua es insuficiente y siempre se debe agregar otro mecanismo de defensa. Si realmente se desea reducir la inflamación sistémica crónica, es necesario utilizar ultrafiltrado y elegir cuidadosamente la membrana de diálisis, la que debe proteger al paciente cada vez que se realiza el procedimiento mediante una alta capacidad de absorción de endotoxinas. Actualmente existe un tipo de membrana que cumple en forma adecuada esta función.
En un estudio en el que se evaluaron cuatro membranas expuestas a material fuertemente contaminado, se encontró que algunas de ellas sólo permitían el paso de 2000 unidades de endotoxinas, mientras que en otras se filtraban 46.000 unidades hacia el compartimiento sanguíneo. Cada empresa fabrica las membranas con sus propias fórmulas y, aunque empleen el mismo polímero, los resultados son diferentes. Se sabe que entre las posibles fuentes de inflamación crónica sistémica están: el uso de membranas bioincompatibles, los altos niveles de estrés oxidativo y de productos inflamatorios y la introducción de elementos microbianos, de modo que estos factores se deben considerar para reducir el impacto en el paciente.
Estrategias de protección endotelial del paciente en diálisis
En el caso de pacientes en etapa 2 a 4, se ha demostrado que la terapia farmacológica es beneficiosa. Si el paciente se encuentra en hemodiálisis, se recomienda usar en forma juiciosa la tecnología de diálisis: tratar el agua en forma muy cuidadosa; preferir ciertos tipos de ultrafiltrados que tienen una alta capacidad de absorción de endotoxinas; utilizar membranas de diálisis eficientes para la remoción de un gran espectro de toxinas urémicas; y elegir bien la modalidad de terapia. Si se seleccionan estos factores en forma cuidadosa se podrían modificar los factores de riesgo previamente mencionados, aunque aún no existe evidencia categórica al respecto, en especial en lo que se refiere a la inflamación y el estrés oxidativo.La comunidad científica, la industria y los nefrólogos no cuestionan los avances en la tecnología de la diálisis, pero les preocupa el hecho de que no se han observado mejorías reales en la mortalidad de los pacientes. Para conseguir esto es necesario seleccionar los tratamientos correctos, es decir, los que van a eliminar en forma más eficiente las toxinas urémicas, y controlar los factores de riesgo asociados a la uremia, con lo que se podría conseguir una diálisis más eficiente y segura y al mismo tiempo, más confiable, mejorando el pronóstico de los pacientes en diálisis a largo plazo.

