Artículo de revisión
← vista completaPublicado el 1 de agosto de 2011 | http://doi.org/10.5867/medwave.2011.08.5111
Sistema de farmacovigilancia en el Hospital Clínico de la Universidad de Chile
Pharmacological surveillance system in the Hospital of the University of Chile
Resumen
En este artículo de revisión, se reporta la experiencia del sistema de farmacovigilancia en el Hospital Clínico de la Universidad de Chile, y se analizan los desafíos de este sistema en Chile.
Introducción
Las reacciones adversas de medicamentos (RAM) no son algo deseado, pero es habitual encontrarlas en la práctica diaria. Hay efectos adversos que pueden ser nocivos para el paciente y otros que pueden costarle la vida, y en esos efectos hay que centrarse al hablar de farmacovigilancia.
La importancia de este tema viene dado porque el mercado hoy ofrece una cantidad importante de medicamentos (originales o copias), y muchos de éstos no cuentan con todos los estudios necesarios para evaluar la seguridad de los mismos, o las poblaciones de los estudios son demasiado estandarizadas. Por lo tanto, hay una cantidad importante de personas y de culturas en las cuales no queda claro cuál es la probabilidad de sufrir una de estas reacciones adversas, o cuáles son las reacciones adversas reales que nos vamos a enfrentar en el grupo de pacientes que atendemos.
Historia de la farmacovigilancia
En el año 1961, con un famoso caso de la talidomida, se dio puntapié inicial a todos los esfuerzos mundiales de poder abordar la seguridad de los medicamentos y se vio la real necesidad de una reglamentación y evaluación adecuada de los medicamentos una vez comercializados. La talidomida era un medicamento que hasta ese momento era muy seguro, y nadie sospechaba el efecto que había detrás por la teratogenicidad del producto.
Así, en el año 1961 en Estados Unidos comenzaron a hacer obligatorio el reporte de todas las reacciones adversas que se observaban en el uso de los medicamentos. Y en el año 1964, se comenzó con la implementación del “reporte con la tarjeta amarilla”, la que hasta unos años atrás era ícono dentro de la farmacovigilancia, pero luego se ha ido incorporando la informatización del reporte a través de computadoras. En el año 1968 la Organización Mundial de la Salud partió con un proyecto piloto que más tarde generó lo que se conoce hoy en día como el centro de monitoreo de Uppsala (The Uppsala Monitoring Center)10 11 que es el centro internacional colaborador de la Organización Mundial de la Salud (OMS) encargado de almacenar todos los reportes de reacciones adversas a nivel mundial.
Como vemos en la figura 1 partió con un piloto de 10 países miembros, llegando hasta 70 países en el 2002; Chile oficializó su ingreso en el año 1996. Hoy en día el centro de monitoreo de Uppsala abarca casi toda la red mundial, con un total de 93 países miembros.
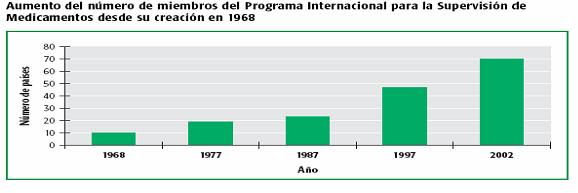
Figura 1: Evolución del número de integrantes del programa para la supervisión de medicamentos de la OMS.
Epidemiología
La figura 2 muestra varios ejemplos de las últimas reacciones adversas que se han reportado y que han llevado a tomar medidas regulatorias. Cabe destacar que, en su mayoría, han sido reportes espontáneos que han sido claves en la evidencia de la reacción adversa.
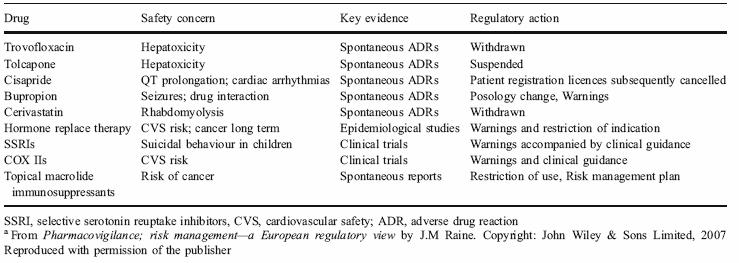
Figura 2: Efectos adversos que han llevado a medidas de regulación en el uso de los medicamentos.
En un estudio realizado por Lazarou J. y cols se encontró que las reacciones adversas a medicamentos presentan un 6,7% de incidencia en pacientes hospitalizados, de las cuales un 0,32% son fatales. Dicha incidencia varía entre 3,2 y 15,7% dependiendo del tipo de estudio. Por su parte, el aumento del costo por una RAM se ha estimado en un 19,86%.
Los adultos mayores tienen cuatro veces mayor riesgo de presentar reacciones adversas, principalmente por todos los cambios farmacocinéticos y por la polifarmacia, que en ellos se da comúnmente.
Definición
Al hablar de la farmacovigilancia, hay que tener en cuenta los organismos involucrados. A nivel internacional es la Organización Mundial de la Salud, y en Chile el Instituto de Salud Pública (ISP). Las notificaciones que llegan al ISP deberían salir desde todos los centros asistenciales y desde todos los profesionales de la salud. Es importante lograr que todos sean parte activa de la comunicación de reacciones adversas.
Como definición de farmacovigilancia encontramos varias, dependiendo de quién la defina. La Organización Mundial de la Salud la define como “actividades relacionadas con la detección, evaluación y prevención de reacciones adversas a medicamentos” con el objetivo de encontrar tempranamente RAM hasta ahora desconocidas, detectar un aumento en la frecuencia de RAM conocidas, identificar factores de riesgo y posibles mecanismos, estimación riesgo-beneficio e información para mejorar la prescripción, el uso racional y seguro de medicamentos y la educación e información al paciente. Todo esto se presenta como un trabajo sistemático a nivel mundial. Sin embargo, para organizarse necesita de los reportes de reacciones adversas como insumo primario.
Al igual que ocurre con la definición de farmacovigilancia, encontramos varias definiciones de reacción adversa en la literatura, y de hecho hay muchos cuestionamientos hacia lo que es y no es una reacción adversa. Pero siempre hay que quedarse con una definición. Así, la reacción adversa se puede definir como “cualquier respuesta nociva y no intencionada de un medicamento, la que ocurre a dosis normalmente utilizadas en el hombre”. O sea, una reacción que cause daño o que potencialmente pueda causarle daño al paciente, y una respuesta que no es lo que esperamos de nuestro paciente. Nunca una reacción adversa va a ser considerada un error, y ocurre generalmente a dosis normalmente utilizadas.
De las antiguas clasificaciones tipo A, y tipo B (dosis dependiente y dosis independiente, respectivamente) han aparecido otras como las dosis tiempo dependiente, las relacionadas al tiempo de administración, al suspender el uso de un medicamento y, últimamente, la falla por una terapia (figura 3; Edwards IR, Aronson J. Lancet 2000:356; 1255-59)4.
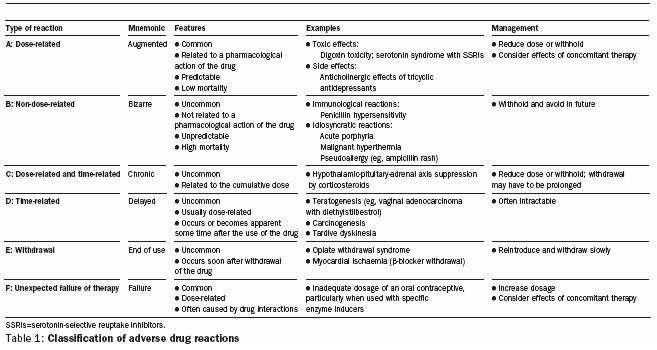
Figura 3: Clasificación de efectos adversos (Edwards IR, Aronson J)4
Tipos de metodologías para la detección de reacciones adversas
Como metodología para la obtención de reacciones adversas a medicamentos, encontramos que existen diversas. Una de las metodologías más simples que se ha documentado, y que tiene una verdadera efectividad en farmacovigilancia, es el reporte voluntario. Es a lo que estamos todos llamados en nuestros centros locales. Los estudios clínicos, por su parte, son estudios demasiado costosos y otras técnicas requieren un poco más de experticia. En la figura 4 se resumen las distintas metodologías con sus respectivas ventajas y desventajas.
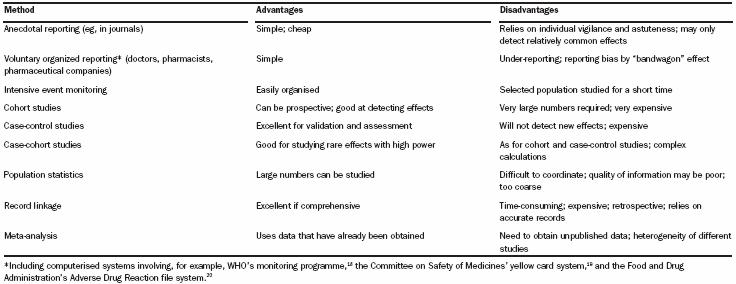
Figura 4: Metodología usada en farmacovigilancia (Edwards IR, Aronson J)4
Ahora bien, lo que se debe reportar son sospechas de reacciones adversas, por lo que viene una segunda parte que es buscar si esa sospecha se relaciona o no con el medicamento. Para esto hay distintos algoritmos de causalidad descritos, que van a buscar una relación entre la reacción adversa y el fármaco. Entonces se enfocan en la relación temporal entre el efecto y el fármaco, una respuesta a la suspensión del fármaco, una respuesta a la readministración del fármaco y la ausencia de otros componentes causales.
Se han diseñado distintas escalas, la OMS las evalúa como: cierta, probable, posible, no clasificable -o inclasificable-. Y se han creado otros algoritmos mucho más simples como el algoritmo de Naranjo y cols que le da un cierto puntaje a ciertas características de las reacciones adversas. Dicho algoritmo es fácil de aplicar y el puntaje define si la reacción es probada, probable, posible o dudosa, según corresponda.
Con respecto a las reacciones adversas lo que se trata de detectar son señales que nos den cuenta de que efectivamente un fármaco está provocando un acontecimiento adverso y que tiende a ser desconocido o documentado de manera incompleta, y esto nos va a dar nuevos datos y nueva evidencia para poder manejar mejor a los pacientes en la práctica clínica.
Sin embargo esta búsqueda de señales viene dada por notificaciones. Esta notificación puede ser una señal por sí sola, o puede ser que miles de notificaciones nos den una alerta hacia un mismo fármaco. Por lo tanto la notificación aquí se vuelve necesaria, ya que generalmente hace falta recibir millones de notificaciones sobre un fármaco para encontrar una relación que nos lleve a dar una alerta real hacia el medicamento.
Programa de farmacovigilancia del Hospital Clínico de la Universidad de Chile
En el Hospital Clínico de la Universidad de Chile, el programa de Farmacovigilancia no es un programa nuevo. Comenzó en el año 1998, unos años después de que Chile se uniera a la red de farmacovigilancia mundial. Este proyecto fue creciendo poco a poco hasta el año 2005, donde se vio la real necesidad de normar este procedimiento, y además dar un procedimiento general. Estos documentos están datados desde ese año y, sin embargo, debido a la acreditación de los centros asistenciales, en que también se obliga a la Farmacia a tener estos documentos, en el año 2005 se hizo una revisión del proceso de farmacovigilancia, para actualizar estos documentos y poder masificarlo a todo el Hospital.
A principios del año 2005 se empezó con un piloto de 3 servicios. Al hacer una reevaluación de ese proceso en 2009, se encontraron algunos problemas que se generaban en las notificaciones de las reacciones adversas. Dicha evaluación fue realizada por médicos, enfermeras y otros profesionales del servicio clínico de hematoncología y de la unidad de trasplante y se encontró que ellos requerían de un reporte que lleve menor tiempo ya que la ficha de reacciones adversas era demasiado extensa, y que era necesario que la información generara una base de datos para poder tener libre acceso a todas las notificaciones que se estén realizando, y así haya una mejor comunicación con el farmacéutico que estaba en ese tiempo encargado de recopilar la información.
En el año 2009 se generó un nuevo procedimiento, que es más detallado y mejora las posibilidades de notificación, ya que ahora puede realizarse mediante dos vías -notificación y prenotificación-. Se designó a un químico farmacéutico encargado de recolectar los datos, notificar y dar indicadores, además de realizar evaluación de la causalidad en los casos de reacciones graves. La responsabilidad de la notificación sigue siendo de todos los profesionales. Las notificaciones o prenotificaciones deben ser realizadas a Farmacia, donde se centraliza esta información. La tarea de Farmacia es completar datos de la notificación cuando éstos son incompletos o faltantes. Además, en el caso de ser una prenotificación -que es un documento mucho más corto y más amigable-, Farmacia debe generar la notificación de las reacciones adversas. Luego debe enviar el reporte de reacciones adversas al subdepartamento de Farmacovigilancia del Instituto de Salud Pública de Chile (ISP).
Se tiene un plazo máximo de 24 horas para notificar al ISP, desde la recepción de la documentación. Una vez realizada la misma se realizará causalidad de aquellas reacciones adversas de tipo grave o de tipo letal. Esta causalidad también debe ser informada al programa de seguridad clínica del Hospital.
¿Qué tenemos que notificar? Lo ideal es que se pueda notificar todo, tratar de no hacer un filtro de acuerdo a si se cree que es “leve, grave o moderado”. Sin embargo, la notificación es voluntaria para las leves y moderadas que no presentan un mayor problema; y para las notificaciones graves y letales, la notificación es obligatoria.
Para notificar existen dos formularios: el documento de prenotificación y el documento de notificación. El documento de prenotificación que se creó en el Hospital es un documento bastante simple, tiene los datos del paciente, la reacción adversa sospechada, el fármaco sospechoso y quién lo informa. A través de este documento, que se hace llegar a Farmacia, el encargado recopila todos los datos necesarios para completar el formulario del Instituto de Salud Pública, forma oficial de notificación.
El documento de notificación es el formulario oficial del ISP. Éste está dividido en cuatro partes:
- Datos del paciente
- Datos básicos de la reacción adversa
- Datos para poder establecer algún tipo de causalidad (por ejemplo, si se recuperó o no el paciente, si se readministró el fármaco, y si tenía antecedentes previos a esta reacción)
- Datos de quien notifica.
Otras responsabilidades que quedan establecidas son: que la comunicación al Comité de Farmacia y Terapéutica debe ser semestral, así como al programa de seguridad clínica. También que Farmacia se encarga de abastecer los formularios de prenotificación y notificación.
Tareas realizadas por el programa de farmacovigilancia durante 2009
Durante el período 2009-2010 se generó el formulario que está disponible en la página web del Hospital. Además se realizó un estudio de incidencia y caracterización de reacciones adversas en un servicio clínico por medio de farmacovigilancia intensiva. Esto significa que se asignó una persona para revisar día a día todas las terapias que se aplicaban a los pacientes De esta manera, se revisaron 170 pacientes con 21,8% de prevalencia de reacciones adversas, muchas de ellas leves, ninguna letal. Hubo tres casos que fueron graves y se determinó que un 5,9% de pacientes se hospitalizó debido a una reacción adversa a medicamento.
Desafíos del programa de farmacovigilancia
Algunos de los desafíos planteados al programa de Farmacovigilancia son, en primer lugar, generar los formularios online, para que desde cada computador pueda llegar la información directamente a Farmacia, y esto va muy de la mano con la implementación de la ficha clínica electrónica para poder tener datos de manera más rápida y centralizada. Además, capacitar a los profesionales de la salud en el proceso de farmacovigilancia también es una tarea pendiente. La idea en este tema es poder capacitar a todos los servicios clínicos para que tengan conocimiento de este programa, y así ellos hagan llegar la notificación en forma oportuna. Por otro lado, se hace necesario crear un equipo de farmacovigilancia que sea partícipe de manera activa de este programa, y poder analizar aquellas reacciones adversas graves y fatales dentro de un equipo multidisciplinario. Por último, también sería importante poder crear mecanismos de incentivos para la notificación de reacciones adversas.

