Editorial
← vista completaPublicado el 20 de mayo de 2014 | http://doi.org/10.5867/medwave.2014.04.5953
Sigue la saga del Tamiflu: ¿cambiará nuestra conducta después de la publicación de la última revisión sistemática sobre beneficios y daños del oseltamivir?
The Tamiflu saga continues: will our conduct change after the publication of the latest systematic review on benefits and harms of oseltamivir?
Resumen
En 2013 escribimos acerca del perjuicio, desperdicio y engaño generado a partir de las conductas de la industria farmacéutica, al ocultar los datos brutos y los Clinical Study Reports (CSR) de los ojos de las autoridades cuando solicitan la patente de comercialización. Describimos el caso de Tamiflu (Roche), medicamento que ha sido ampliamente usado en nuestra población y profusamente indicado por prescriptores. También ha sido comprado por autoridades sanitarias, acarreando un gran costo a los países de la región. En esta editorial haremos una cronología sobre cómo se fue instalando la idea de usar inhibidores de la neuroaminidasa para la profilaxis y después (...)
En 2013 escribimos acerca del perjuicio, desperdicio y engaño generado a partir de las conductas de la industria farmacéutica, al ocultar los datos brutos y los Clinical Study Reports (CSR) de los ojos de las autoridades cuando solicitan la patente de comercialización [1].Describimos el caso de Tamiflu (Roche), medicamento que ha sido ampliamente usado en nuestra población y profusamente indicado por prescriptores. También ha sido comprado por autoridades sanitarias, acarreando un gran costo a los países de la región.
En esta editorial haremos una cronología sobre cómo se fue instalando la idea de usar inhibidores de la neuroaminidasa para la profilaxis y tratamiento de la influenza, desde las primeras recomendaciones entusiastas hasta llegar a la revisión sistemática publicada el mes pasado en BMJ. Revisión que fue realizada sobre los datos brutos de los pacientes, tal como fueron entregados por Roche y la European Medicines Agency (EMA), a los investigadores encabezados por Tom Jefferson. Esta revisión sistemática cierra el tema al concluir que oseltamivir no sirve para la profilaxis y el tratamiento de la influenza [2]. También abordaremos las implicancias que esto tiene respecto de la naturaleza de la base de evidencia, sobre la cual se toman decisiones que afectan a los pacientes y cómo se abren nuevos desafíos en cuanto a la forma en que se conducen las revisiones sistemáticas.
La cronología es elocuente al dejar en evidencia cómo se puede implantar un curso terapéutico en el ámbito de la atención en salud que, si bien no estaba fundado en evidencia científica sólida, se convirtió en un verdadero mantra de la práctica clínica. Después de más de diez años de gasto y riesgo inútiles, la recomendación de usar inhibidores de la neuroaminidasa como profilaxis (ciclos de seis a ocho semanas) y como tratamiento de la influenza estacional sintomática (tratamientos de una semana), ha quedado definitivamente desacreditada. Esta historia ha de servir para motivarnos a afinar nuestra capacidad de análisis crítico y de sano escepticismo, que siempre deben estar disponibles para mejorar el cuidado de nuestros pacientes, principal norte del accionar médico. Los estados de resultados de las grandes corporaciones farmacéuticas no deben ni guiar ni influenciar nuestra conducta terapéutica.
Tamiflu fue desarrollado durante la década de los noventa y fue autorizado por la Food and Drug Administration (FDA) en 1999. Pero no fue sino hasta 2009 cuando se masificó su uso a raíz de la pandemia H1N1. Se llegó a tal nivel de convencimiento colectivo acerca de su supuesta efectividad para reducir los días de afectación por gripe, así como las complicaciones respiratorias y los días de estadía hospitalaria, que se consideró casi una negligencia el no indicar Tamiflu y no tomar Tamiflu como profilaxis.
Aquí presentamos una pincelada de esta historia, partiendo donde lo dejó el tristemente célebre estudio de Kaiser [3]: un análisis agrupado de diez ensayos clínicos, sólo dos de los cuales habían sido publicados, todos financiados por Roche. Este estudio constituyó la base de evidencia, distorsionada como ya sabemos, de todo lo que se describe a continuación.
En 2003 se publicó una revisión sistemática sobre el uso de oseltamivir y zanamivir [4]. Este estudio concluía que el tratamiento disminuía la duración de los síntomas entre 0,4 y un día en la población con intención de tratar, y se asociaba a una reducción relativa en la probabilidad de complicación con indicación de antibióticos de 29% a 43% si se administraba antes de las primeras 48 horas del inicio del cuadro. No se encontró evidencia de efectividad en complicaciones mayores que requirieran hospitalización. En el desenlace primario “prevención” para oseltamivir, la revisión incluyó nueve ensayos clínicos aleatorizados y para el desenlace “tratamiento”, cuatro. La revisión no analizó la existencia de sesgo de publicación (cuando se publican más los estudios con resultados favorables que los no favorables), ni las fuentes de financiamiento de los ensayos incluidos. Entre los autores figura un profesor de infectología con fuertes lazos con la industria farmacéutica, especialmente con GlaxoSmithKline (fabricante de Relenza, zanamivir) y Roche (fabricante de Tamiflu).
En los años siguientes, un consenso sueco y otro alemán recomendaron los inhibidores de la neuroaminidasa como primera línea de tratamiento en la influenza [5],[6]. De ahí en adelante fueron apareciendo artículos de revisión narrativa que hacían mención a las recomendaciones del National Institute for Health and Care Excellence (NICE) y a la efectividad del uso de estos medicamentos como profilaxis y tratamiento [7]. Sin embargo, los análisis económicos eran contradictorios [8],[9]. A pesar de no existir evidencia publicada alguna hasta ese momento sobre efectividad de oseltamivir y zanamivir en personas de edad avanzada o niños, la recomendación de su uso fue incorporada en diferentes directrices clínicas y documentos de consenso en Europa y Estados Unidos [10],[11]. En el contexto de la gripe aviar H5N1 se llegó al punto de decir que los inhibidores de la neuroaminidasa serían “altamente efectivos” [12] y la discusión giraba en torno a dosificaciones y combinaciones [13] sin cuestionar efectividad y seguridad, lo que se daba por descontado.
El 11 de junio de 2009 la Organización Mundial de la Salud decretó alerta seis para la gripe por influenzavirus A subtipo H1N1. Ese mismo año aparece una revisión sistemática y evaluación económica sobre oseltamivir y zanamivir del NICE [14], en donde se afirma que el primero es efectivo en prevenir influenza sintomática con confirmación de laboratorio, particularmente en personas de edad avanzada y de mayor riesgo (RR 0,08; IC 95%: 0,01-0,63); seis estudios fueron incluidos para fundamentar esta conclusión. En cuanto a profilaxis postexposición en hogares, también se decía que eran efectivos (RR 0,19; IC 95%: 0,08-0,45). El estudio concluyó que había “evidencia limitada” para establecer la efectividad de la intervención en prevenir complicaciones, hospitalización y en acortar la duración del cuadro. No pudo concluir nada respecto de costo-efectividad de la intervención por escasez de evidencia de buena calidad.
No obstante, ese fue el año en que las grandes guías clínicas le dijeron al mundo que había que incluir oseltamivir dentro del listado de medicamentos esenciales. Esto llevó a muchos gobiernos a gastar sumas siderales en la compra de Tamiflu, fármaco que llegó a desabastecerse producto de la verdadera histeria colectiva que se desató después de la declaración de pandemia por influenza A.
Sobre la base de una metodología de consenso por expertos altamente cuestionada, la Organización Mundial de la Salud emitió su directriz para el manejo farmacológico de la influenza pandémica H1N1 en que -según criterios GRADE (Grading of Recommendations Assessment, Development and Evaluation) - para el tratamiento de pacientes con sospecha o confirmación de infección por influenza pandémica (H1N1) con presentación clínica severa o progresiva, se recomendaba tratar estos pacientes con oseltamivir [15]. Calificaron esta recomendación como fuerte (strong), con evidencia de baja calidad. En virtud de este tipo de recomendación, la conducta clínica debe ser iniciación del tratamiento tan pronto sea posible. La directriz indicó que la recomendación debía ser aplicada a todos los grupos de pacientes, incluyendo mujeres embarazadas, niños pequeños menores de cinco años de edad y recién nacidos.
Después de esta afirmación tan categórica proveniente de la más alta autoridad sanitaria mundial, resultaría improbable discrepar. Siguieron las publicaciones más o menos en la misma línea [16],[17],[18],[19] y guías clínicas como la de Centers for Disease Control (CDC) y otros [20],[21], que continuaban con el mismo mantra, grados más, grados menos.
En este contexto, ¿quién osaría contradecir lo que literalmente todo el mundo estaba diciendo? Pues, el Grupo de Infecciones Respiratorias Agudas de Cochrane (Cochrane’s Acute Respiratory Infections Group). En 2006 aparece la primera revisión sistemática que concluye “debido a su baja efectividad, no se deberían usar los inhibidores de la neuroaminidasa para el manejo de la influenza estacional, y en epidemia o pandemia, se deberían asociar a otras medidas de salud pública” [22]. En 2009 los mismos autores concluyen que “los inhibidores de la neuroaminidasa presentan una efectividad modesta frente a los síntomas de influenza…” [16] y fue este estudio el que desencadenó un proceso que duró cinco años hasta llegar a fecha presente, en que ese mismo grupo de investigadores lideró una verdadera cruzada para conseguir los datos brutos de los pacientes de los estudios Roche, tanto los publicados como los no publicados.
¿Y qué dicen las recomendaciones actuales o más recientes?
Se sigue insistiendo en que el tratamiento antiviral rápidamente instituido reduce morbilidad y mortalidad [23]. Del mismo modo, los estudios observacionales sugieren que oseltamivir podría reducir la mortalidad, la hospitalización y la duración de los síntomas comparado con ningún otro tratamiento [24]. El Ministerio de Salud de Chile, hasta hace pocos días, también decía que en influenza “se pueden usar antivirales”, pero la página en que estaba publicada esta recomendación se encuentra retirada al momento de escribir esta editorial.
Y así llegamos a abril de 2014, cuando aparece la última revisión Cochrane sobre oseltamivir, pero esta vez sobre datos brutos [2]. El objetivo del estudio fue evaluar los potenciales beneficios o perjuicios de oseltamivir sobre la base de una revisión exhaustiva de todos los CSR de los ensayos clínicos aleatorizados y de los comentarios de las entidades regulatorias. El diseño es una revisión sistemática de información regulatoria. Los desenlaces estudiados fueron los siguientes: tiempo de alivio de síntomas; desenlaces relacionados con influenza; complicaciones; ingresos hospitalarios; y eventos adversos en la población con intención de tratar. Las fuentes de datos correspondieron a información entregada por Roche (después de una larga disputa pública, enteramente difundida por el BMJ) y por la EMA, con lo que los investigadores lograron los datos de 83 ensayos clínicos y más de 150.000 fojas. Los resultados se presentan en las Tablas I y II.
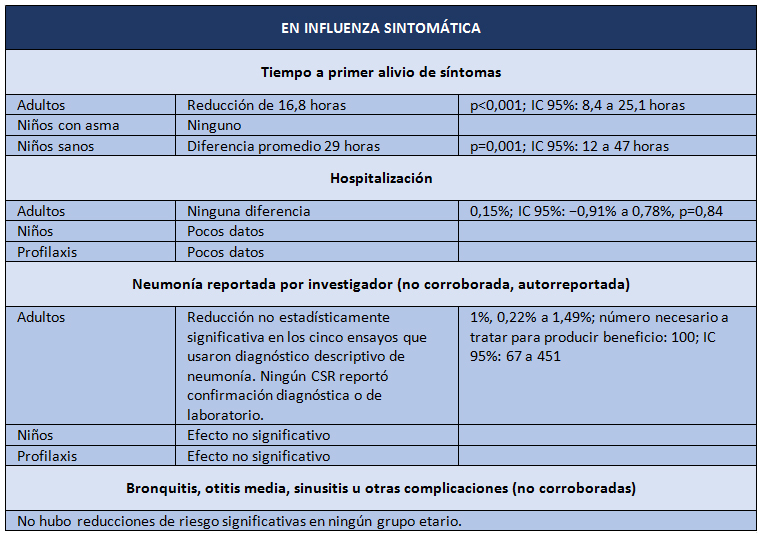 Tamaño completo
Tamaño completo 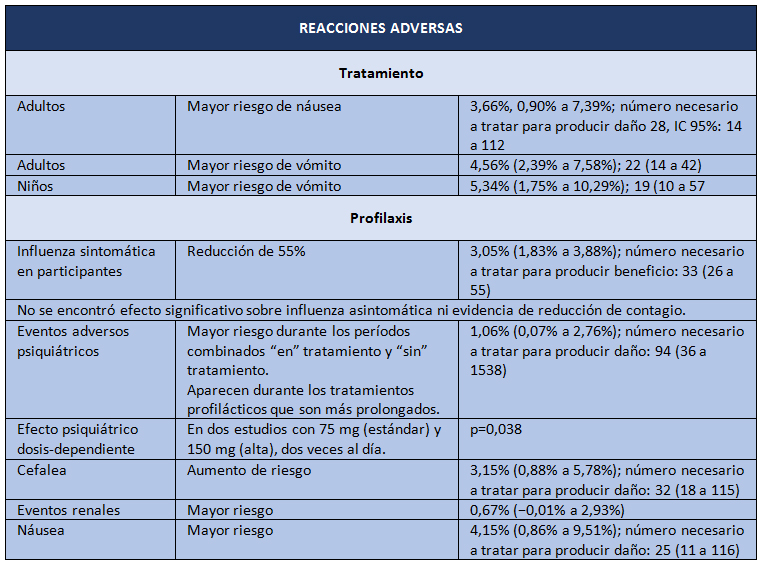 Tamaño completo
Tamaño completo La conclusión es que oseltamivir reduce la proporción de influenza sintomática en profilaxis, pero con la contrapartida del mayor riesgo de síndromes psiquiátricos, entre otros. En el tratamiento de la influenza sintomática (5 a 7 días), oseltamivir produce una modesta reducción del tiempo para alivio de los síntomas, pero también acompañado de efectos secundarios como náuseas, vómitos, y síndromes renales y psiquiátricos.
¿Por qué antes se decía una cosa y ahora otra? ¿Qué es lo que falló en el camino?
En primer lugar, la existencia de sesgo de publicación. En 2003 aparece el estudio Kaiser, que hace referencia a diez estudios, dos publicados y el resto no publicados. ¿Por qué no están publicados todos los ensayos clínicos que llevó a cabo el fabricante? La respuesta es simple: porque no quiere, porque no le conviene. Los datos pertenecen a las empresas que desarrollan los productos farmacéuticos y los ensayos son conducidos por ellos mismos. Es perfectamente legal y nadie los puede obligar a divulgar sus datos a terceras partes, aunque esto está ad portas de cambiar en Europa gracias a la promulgación de legislación que hará exigible la publicación de todos los resultados de los estudios hechos. El resultado de ello es que la literatura publicada no refleja lo que realmente se ha investigado, con la consecuencia de que se ha llegado a decir que hay un 30% de sobreestimación de beneficio en los estudios financiados por la industria y 80% de reacciones adversas que no son reportadas en la literatura.
En segundo lugar, la falla multisistémica de las autoridades regulatorias norteamericanas y europeas. Los reguladores han llegado a diferentes opiniones acerca de la eficacia y seguridad de drogas como Tamiflu, puesto que la documentación presentada a las autoridades sistemáticamente exagera la eficacia y minimiza los riesgos. Por de pronto, los reguladores ni siquiera exigen que uno de los dos estudios “pivotales” exigidos para la obtención de patente de comercialización sea independiente. Dos importantes agencias como la FDA y la EMA, cuyas decisiones son copiadas sin discusión por decenas de otras agencias nacionales de medicamentos como las de nuestros propios países, no se comunican entre sí y, para peor, a veces hasta discrepan abiertamente. No se le puede pedir a la industria farmacéutica que actúe en el mejor interés del público ya que son empresas con arreglo al lucro, pero sí debemos exigirlo de parte de las agencias estatales y públicas.
En tercer lugar, cambió lo que se entiende como evidencia. La exclamación “el Rey está desnudo” resultó en un profundo autocuestionamiento por parte del grupo liderado por Jefferson sobre la metodología aplicada a las revisiones sistemáticas Cochrane sobre los inhibidores de la neuroaminidasa en influenza. ¿Es posible fundar conclusiones con repercusiones en decisiones de salud pública sobre pocos estudios, financiados y conducidos por los mismos fabricantes? ¿Qué hay debajo de esta punta del témpano que representan los estudios publicados? Así comenzó una batalla sin tregua de este grupo de investigadores que al cabo de cinco años ha redundado en esta revisión sistemática que ha sido la más abierta y transparente jamás realizada. Por primera vez se tiene acceso a los datos brutos de pacientes individuales, contenidos en los CSR. Se incluyeron veinte ensayos no publicados y 9.623 participantes. Esta es la primera vez que la Colaboración Cochrane, en alianza con el BMJ, hace una revisión sobre datos brutos y no sobre artículos publicados.
Es de esperar que esta historia haga reflexionar a los gobiernos y legisladores del mundo sobre estas profundas fallas en la evaluación de seguridad y eficacia de las drogas, cuya comercialización se autoriza. Es necesario reflexionar también sobre la ausencia de ensayos independientes sobre los medicamentos llamados innovadores. El caso de Tamiflu, en que se sobreestimó su efectividad y omitieron los reportes sobre sus daños, no es un caso aislado. Si quienes hacen las revisiones sistemáticas deberán ahora revisar la metodología y la unidad de análisis que emplean, junto con reconsiderar lo que entendemos por base de evidencia, también quienes tienen injerencia en los arreglos institucionales y regulatorios que nos rigen deberán comenzar a revisar las políticas públicas que sobre esta materia hemos tenido. Ha llegado la hora de las reformas.
Notas
Declaración de conflictos de intereses
VCB declara no tener conflictos de intereses con la materia del presente editorial. Declara que en los últimos cinco años la Revista recibió ingresos por concepto de publicidad de algunas empresas farmacéuticas.
Puede seguir a Vivienne Bachelet en Twitter: @V_Bachelet

