Atención primaria
← vista completaPublicado el 1 de diciembre de 2006 | http://doi.org/10.5867/medwave.2006.11.1896
Patología infecciosa y AUGE
Communicable diseases and AUGE
Presentación
El AUGE es un instrumento de regulación sanitaria que considera acceso universal para prestaciones integrales y garantías explícitas asociadas con la atención de prioridades, en el cual las garantías se refieren a las enfermedades. Este proceso se inició en 2002 incorporando tres enfermedades; a 2005 se habían incluido 25 patologías y hoy se garantizan 40. En la ley relativa al AUGE está estipulado que tanto FONASA como las ISAPRES deben asegurar en forma obligatoria estas 40 garantías a sus beneficiarios.
Entre las enfermedades AUGE que habían en 2005 figuran sólo dos de causa infecciosa: el VIH/SIDA y la neumonía adquirida en la comunidad, de tratamiento ambulatorio y en pacientes mayores de 65 años. La lista de patologías AUGE 2005 es la siguiente:
- Endoprotesis total de caderas en personas de 65 años y más
- Cáncer de testículo en personas de 15 años y más
- Epilepsia no refractaria en personas desde 1 año y menores de 15 años de edad
- Primer episodio esquizofrenia
- Examen de medicina preventiva
- Fisura labiopalatina
- Diabetes mellitus tipo 1
- Diabetes mellitus tipo 2
- Linfoma en personas de 15 años y más
- Prevención del parto prematuro
- Retinopatía del prematuro
- Salud oral integral en niños de 6 años
- Trastorno de generación del impulso cardiaco y conducción en personas de 15 años y más, que requieren marcapaso
- Síndrome de inmunodeficiencia adquirida VIH/SIDA
- Alivio del dolor por cáncer avanzado y cuidados paliativos
- Cáncer de mama en personas de 15 años y más
- Leucemia en menores de 15 años
- Linfomas y tumores sólidos en menores de 15 años
- Hipertensión arterial primaria o esencial en personas de 15 años y más
- Hipoacusia neurosensorial bilateral del prematuro
- Displasia broncopulmonar del prematuro
- Cáncer cervicouterino
- Tratamiento quirúrgico de cataratas congénitas y adquiridas
- Insuficiencia renal crónica terminal
- Cardiopatías congénitas operables en menores de 15 años
- Tratamiento quirúrgico de escoliosis en menores de 25 años
- Diagnóstico y tratamiento disrrafias espinales
- Infarto agudo del miocardio y manejo del dolor torácido en unidades de emergencia
- Infección respiratoria aguda baja de manejo ambulatorio en menores de 5 años
- Neumonía adquirida en la comunidad de manejo ambulatorio en personas de 65 años y más
SIDA
El primer caso en Chile fue notificado en 1984 y la incidencia ha ido en franco aumento, llegando a 12.574 casos en 2003, con 4.074 fallecidos. Anualmente se infectan 2.154 personas, 33.314 personas vivirían con el virus y la prevalencia sería de 0,2%. En general, la tendencia es hacia la feminización, con una relación que pasó de ser de una mujer por nueve hombres a la actual, de una mujer por cuatro hombres. La enfermedad tiende a afectar a grupos de recursos inferiores y en general, se centra en personas entre los 20 y 49 años.
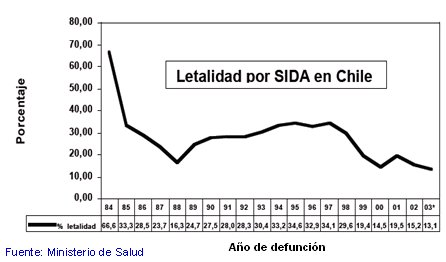
La terapia contra el SIDA, conocida como terapia antiretroviral (TAR), comenzó en Chile en 1993 como monoterapia. Luego apareció la biterapia, con la cual hubo una reducción transitoria de la mortalidad, y en 1999 se comenzó en el sistema público con la triterapia. En 2001 se inició el acceso ampliado a la triterapia y en 2003 había una cobertura de 100% para los pacientes del sistema público, lo que disminuyó en gran medida la mortalidad e incidencia del SIDA, pero no la infección por VIH (Virus de Inmnunodeficiencia Humana). Desde que se implementó la triterapia ha disminuido la mortalidad (Fig.1), pero esta curva sólo se ve en los países en que hay acceso a la terapia; en África, por ejemplo, no se aprecia esta curva.
 Tamaño completo
Tamaño completo Figura 1. Letalidad por SIDA en Chile
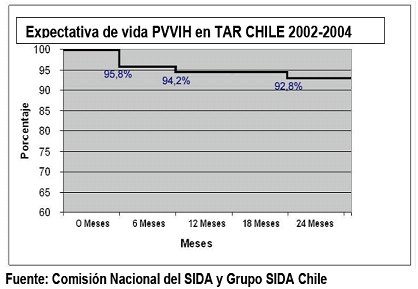
La expectativa de vida de los pacientes en triterapia es superior a 90% a los dos años, situación que no se aprecia en todos los lugares en que se cuenta con la terapia (Fig. 2).
 Tamaño completo
Tamaño completo Figura 2. Expectativa de vida por infección VIH en triterapia. Chile: 2002-2004
La eficacia virológica, tanto en 400 como en menos de 50 copias, está cerca de 80%, nivel muy bueno. Si se busca en la literatura resultados de la eficacia de la terapia en distintos trabajos controlados, con el médico al lado del paciente, insistiendo en que éste tome las pastillas, la eficacia alcanza a 80%; en cambio, en centros donde no hay control día a día de los pacientes, la eficacia no llega a 60%.
La mortalidad se asocia con la etapa clínica. Hay tres etapas A (asintomáticas), B (enfermedades no asociadas con SIDA) y C (enfermedades asociadas con SIDA). Mientras se avanza en inmunosupresión, la mortalidad puede ser de 12%, como ocurre con los pacientes en etapa C. Lo mismo ocurre cuando se centra la atención en los linfocitos CD4: en los pacientes cuyos recuentos son superiores a 200, la mortalidad es de 2%. Se ha visto que en el caso de los linfocitos CD4 no hay tanta variación en mortalidad entre los pacientes cuyos recuentos están entre 100 y 199, en quienes la mortalidad es de 2,8%, y los pacientes cuyos recuentos son mayores de 200, cuya mortalidad es de 2,3%; en cambio, la mortalidad aumenta notablemente entre los pacientes cuyos recuentos son inferiores a 100 CD4, en los que alcanza casi 11%.
Los objetivos de la guía clínica en el manejo de los pacientes con VIH son: detener la progresión de la enfermedad; disminuir la morbimortalidad por SIDA; y mejorar la calidad de vida de los portadores VIH, mediante el acceso oportuno a la TAR. Los mismos objetivos rigen para los niños. La idea es disminuir la transmisión vertical del VIH, mediante la detección universal de VIH en embarazadas y la aplicación de medidas farmacológicas y no farmacológicas de eficacia demostrada. La base del modelo de atención es dar un enfoque multidisciplinario y un alto nivel de capacitación, con aumento de recursos tecnológicos. La atención se debe otorgar en centros de atención de VIH que cumplan con los recursos necesarios de infraestructura, personal, frecuencia de controles, tiempos de atención, presencia de subespecialistas como infectólogos y capacitación de no especialistas. Se debe contar con la asesoría de un panel de expertos, tanto infectólogos como inmunólogos, para las personas que trabajan con pacientes VIH. La guía clínica se desarrolló a partir de la revisión de gran número de otras guías clínicas de 2004 y 2005, sumada a la experiencia acumulada en Chile con el seguimiento de los pacientes.
En relación con la confirmación diagnóstica, se debe dar asesoría previa al examen; se solicita serología, ELISA para VIH, se confirma en el Instituto de Salud Pública (ISP) y después se confirma, con asesoría posterior al examen. Una vez confirmado el diagnóstico se debe etapificar al paciente mediante evaluación clínica, inmunológica y virológica, es decir, anamnesis, examen físico, recuento de linfocitos CD4 y carga viral. Una vez realizada la evaluación y confirmada la necesidad de triterapia, se envía la solicitud a CONASIDA (Corporación Nacional del SIDA) y en un plazo máximo de 40 días el paciente debe comenzar su terapia.
El inicio de tratamiento se indica cuando hay antecedentes de enfermedad oportunista etapa C, con excepción, en Chile, de la tuberculosis pulmonar, ya que ésta tiene indicación de terapia independiente de la carga viral y del recuento CD4. Si se tiene un paciente asintomático o con síntomas B (fiebre, baja de peso o diarrea) se debe solicitar recuento CD4 y, si está bajo 200, se indica terapia. Otra situación en la que se indica terapia es la de un paciente con recuento CD4 entre 200 y 250 en quien se asocia candidiasis orofaríngea, diarrea crónica, fiebre prolongada, baja de peso o declinación de CD4 sobre 20/mm3 por mes o carga viral sobre 100.000 copias. Es preciso tener en cuenta que la terapia sólo se inicia si el paciente lo quiere.
Los pacientes cuyo recuento de CD4 es menor de 100 tienen mayor riesgo de progresión y muerte, por lo que en este grupo la terapia se debe administrar antes de los siete días y desde el comienzo se debe hacer con tres drogas en combinación. Los esquemas propuestos para el tratamiento son la combinación de un análogo nucleósido de la transcriptasa reversa (ANTR) con dos análogos no nucleósidos de la transcriptasa reversa (ANNTR), que es la combinación más frecuente. Otro esquema es la combinación de dos ANTR más un inhibidor de proteasa (IP). Antes se planteó la combinación de tres ANTR, pero no hay evidencia que respalde esta alternativa.
La combinación más común es Combivir, que es la unión entre la zidovudina (AZT) más epivir (3TC). Los ANNTR son en general tres: efavirenz, neviparina y delavirdina, pero ésta última se está suspendiendo. En cuanto a los IP, la que más se utiliza es la combinación de lopinavir con ritonavir (Kaletra). En general, la mayoría de los pacientes recibe la combinación de Combivir más Stocrin-EFV, que es el efavirenz. Si esta combinación fracasa, se cambia en muchos casos por Kaletra (lopinavir-ritonavir). En las guías estadounidenses, Kaletra está al mismo nivel que efavirenz; en cambio, en Chile se tiende a partir por efavirenz y se deja Kaletra en segundo lugar. Se comienza con Kaletra cuando un paciente está muy inmunocomprometido y tiene por ejemplo, sarcoma de Kaposi, cuya causa se sabe que es el virus Herpes 8, ya que a este fármaco se le ha atribuido la cualidad de actuar sobre este virus.
Cuando comenzó la triterapia los pacientes tomaban entre 16 y 20 pastillas diarias, pero con las pastillas actuales toman sólo tres, lo que ha facilitado la adhesión al tratamiento, el que puede causar muchos problemas a los usuarios; por ejemplo, algunos desarrollan anemia con AZT. En la guía se recomienda que en esta situación, o en presencia de neutropenia, se cambie AZT por didanosina (DDI). El Stocrin-Efavirenz (EFV) causa una serie de alteraciones neuropsiquiátricas, por lo que en pacientes con estas alteraciones se debe usar neviparina; la misma indicación se da en mujeres en edad fértil sin métodos anticonceptivos, ya que EFV tiene efectos teratogénicos. En muchas situaciones se debe cambiar la terapia por sus efectos tóxicos, los que a veces no se toleran; para esto se consulta, en primer lugar, al comité de expertos.
Los controles son seriados: los dos primeros meses de TAR el control es mensual, luego cada dos meses hasta los seis meses y luego cada tres meses. Se han descrito reacciones adversas con todos los fármacos; en Chile, 16% de los pacientes necesitan cambio de algún fármaco por sus efectos tóxicos. Ejemplos de esta situación son el AZT, que causa anemia y neutropenia; el D4T, que origina neuropatía periférica; el DDI es causa de pancreatitis; hay nefrolitiasis debida a indinavir; y cuadros de hipersensibilidad por abacavir (ABC), caracterizados por coriza, tos y rinitis. Una vez suspendido ABC no se puede reiniciar, porque el paciente puede hacer un cuadro muy grave e incluso fallecer. Efavirenz es de alta neurotoxicidad; algunos ANNTR pueden causar alergia cutánea y compromiso de la función hepática; los ANTR originan toxicidad mitocondrial y síndromes con aumento del ácido láctico. Se han descrito casos de mujeres obesas que han tomado estos fármacos y han presentado insuficiencia hepática aguda, con acidosis láctica muy grave. Los inhibidores de proteasas son causa de una serie de trastornos metabólicos, como hiperglicemia, dislipidemia y aumento de la grasa corporal.
Lo importante es controlar: si los pacientes progresan o no en la evolución de la enfermedad; si aparecen enfermedades oportunistas; si hay signos de reconstitución inmune, lo que muchas veces puede ser un problema, porque el organismo puede reaccionar frente a un patógeno que estaba alojado en el huésped y originar un cuadro de adenopatías, etc.; y controlar la evolución de los CD4.
Muchos pacientes fracasan en el tratamiento. Se considera fracaso cuando el tratamiento no logra suprimir la replicación viral a niveles indetectables después de seis meses de tratamiento; o bien, habiéndolo logrado, la replicación reaparece en niveles significativos. Entre las causas de fracaso se cuenta la resistencia, porque este virus muta y genera resistencia al tratamiento; otra causa es la falta de adhesión al tratamiento. Si el paciente ha sido cumplidor y aun así fracasa, está el test de resistencia, que muestra la genotipificación, con el objeto de determinar si hay mutaciones en el gen de la transcriptasa reversa o de la proteasa y, de esta manera, detectar a qué es resistente o sensible el virus. Siempre conviene que el paciente consuma las drogas a las cuales el virus es resistente, es decir, que se mantenga tomando ese esquema mientras se realiza la genotipificación. Si se suspende la terapia actúa el virus silvestre, que es el que no presenta mutaciones, aparece al suspender la terapia y su capacidad replicativa es mucho mayor que los virus mutantes. Después de eso se cambia a la terapia que convenga.
En cuanto a la transmisión vertical, en los primeros años era de 40% a 50% en Chile, pero ha disminuido a 2% gracias a la detección precoz mediante ELISA y al tratamiento de otras enfermedades de transmisión sexual (ETS). Antes se administraba AZT sólo al final del embarazo; ahora, en la paciente infectada, aunque no tenga los criterios de inicio de tratamiento, se comienza el tratamiento con tres fármacos antes de la semana 24 de embarazo; además, en el momento del parto se utiliza AZT endovenosa y se administra al recién nacido durante seis semanas por vía oral. Se debe realizar cesárea electiva y se contraindica la lactancia.
Neumonía
La neumonía es un proceso inflamatorio del parénquima pulmonar, de origen infeccioso; lo que sigue se refiere a las adquiridas en el medio comunitario (NAC).
Desde 1998 el Ministerio de Salud (MINSAL) sostiene un programa del adulto mayor, cuyo objetivo sanitario es lograr la reducción de la mortalidad por infección respiratoria baja en este grupo etario, en el año 2.010. Entre todos los cuadros respiratorios se eligió la neumonía como enfermedad prioritaria para actuar sobre ella y disminuir la mortalidad asociada, porque, según la evidencia que aporta la literatura, en la medida en que se use el antibiótico apropiado, iniciado en el momento apropiado, con las dosis apropiadas y por el tiempo apropiado, decidiendo en forma oportuna si el paciente necesita o no hospitalizarse, se logrará un impacto significativo en la mortalidad.
Los datos epidemiológicos indican que la tasa de mortalidad en el hemisferio norte es de 12 casos por 1.000 personas/año; y a medida que aumenta la edad aumenta la prevalencia, hasta 50 casos por 1.000 personas en el rango de 71 a 85 años. En Chile, 30% de los egresos hospitalarios son por neumonía en mayores de 65 años, con casi 24.000 casos de neumonía al año en 2001 y una tasa de mortalidad de 112/1.000 habitantes entre los 65 y 79 años, hasta llegar a una tasa de 1.050/1.000 en pacientes sobre los 80 años, siendo la tercera y sexta causa de muerte respectivamente. La incidencia estimada de neumonía en Chile es de 7,3% en el adulto mayor, con mortalidad de 5% entre los pacientes tratados en forma ambulatoria. En pacientes hospitalizados la mortalidad aumenta significativamente, con cifras de 10 a 20% en pacientes de sala y hasta 50% en pacientes hospitalizados en unidades de cuidados intensivos.
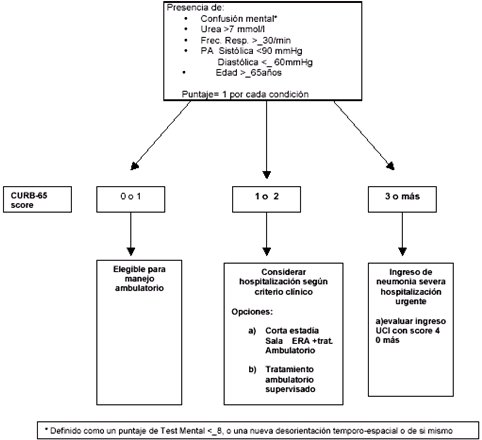
La guía de neumonía plantea un índice para discriminar si un paciente se debe hospitalizar o si se atenderá de manera ambulatoria; se trata del índice de severidad (gravedad) de neumonía (ISN) y se basa en factores demográficos, comorbilidades, examen físico, radiografía de tórax y algunos exámenes de laboratorio. Todas las guías de neumonía, ya sea la chilena, la británica, la estadounidense, etc., utilizan el sistema PORT para discriminar o clasificar a los pacientes de alto riesgo o de bajo riesgo, sistema que asigna un puntaje que determina cierto nivel con el cual se decide si se hospitaliza o se hace tratamiento ambulatorio. La clasificación se basa en un sistema cuantitativo o semicuantitativo. La guía chilena se basa en la del Reino Unido, la BTS, que utiliza el score CURB 65, sigla que significa: Confusión mental, Urea, frecuencia Respiratoria, presión arterial (Blood pressure) y 65 años de edad o mayor. Con esta evaluación se decide si el paciente se hospitaliza o no, según el algoritmo que se muestra en la Fig. 3.
 Tamaño completo
Tamaño completo Figura 3. Citerios de severidad de NAC para el manejo ambulatorio, según la British Thoracic Society (adaptado, MacFarlane, Boswell 2004)
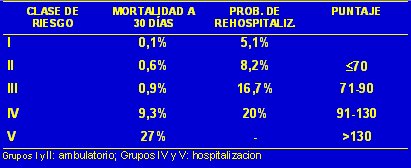
El puntaje PORT es más complejo y mide desde 70 hasta 130 puntos, sobre la base de una serie de criterios clínicos más complejos (véase Tabla I). En general, los grupos I y II se manejan de manera ambulatoria y los grupos III, IV y V se hospitalizan.
 Tamaño completo
Tamaño completo Tabla I. Clases de riesgo predictivos de hospitalización y mortalidad a 30 días en NAC en adultos (PORT)
Extracto decreto ley garantías explícitas de salud
Las patologías que incorpora esta guía son todas las bronconeumonías y neumonías de manejo ambulatorio y abarca a los pacientes que están institucionalizados, es decir, en hogares de ancianos y casas de reposo. Tienen acceso los pacientes de 65 años y más que presenten síntomas respiratorios agudos, quienes tienen acceso a diagnóstico; los pacientes con sospecha de NAC, quienes tienen acceso a confirmación diagnóstica y a tratamiento en las primeras 48 horas; y los pacientes que tengan confirmación diagnóstica tendrán acceso a continuar el tratamiento.
La garantía de oportunidad establece que la confirmación diagnóstica se realiza dentro de las 48 primeras horas desde la primera consulta y el tratamiento se inicia desde la primera consulta, si así amerita. El diagnóstico es fundamentalmente clínico, pero si hay duda se tiene derecho a solicitar radiografía de tórax para certificar el diagnóstico; además, este examen con frecuencia sirve para evaluar gravedad. En cuanto a los exámenes de laboratorio, la guía plantea que se debe realizar hemograma,VHS y nitrógeno ureico.
El agente causal más frecuente en todo tipo de neumonía es el neumococo, pero también se debe tener presente la posibilidad de Mycoplasma pneumoniae y virus como el Influenza. Un problema que va en aumento es la resistencia, que se ve tanto a nivel hospitalario como ambulatorio, por el uso excesivo de antibióticos. En consecuencia, es imprescindible conocer el tipo y nivel de resistencia para indicar la mejor terapia antibiótica empírica. En Chile, la resistencia de neumococo a penicilina mayor de 2 ug/ml alcanza a 9%.
Para el tratamiento antibiótico se recomienda un uso juicioso, el que contempla empezar la terapia con amoxicilina 500 mg más ácido clavulánico125mg, cada 8 horas por dos días y luego de estas 48 horas se debe realizar la primera evaluación diagnóstica. Si se confirma neumonía, se continúa el tratamiento hasta completar 10 días. En los pacientes alérgicos a beta-lactámicos la guía plantea utilizar claritromicina, 500 mg cada 12 horas. En pacientes institucionalizados se plantea añadir claritromicina a la combinación amoxicilina-clavulánico. Se recomienda también llevar un registro de temperaturas y realizar asesoría y cuidados a domicilio, con control a las 48 horas. Se evalúa gravedad y necesidad de hospitalización, cumplimiento y tolerancia del tratamiento; además conviene llevar un registro de temperatura y una evaluación de la radiografía de tórax. Si se confirma el diagnóstico de neumonía se debe prescribir antibióticos durante 8 días más y, si el paciente lo necesita, se indicará kinesioterapia y broncodilatadores, se controlará a los 8 días y se evaluará el alta o el seguimiento (Fig. 4).
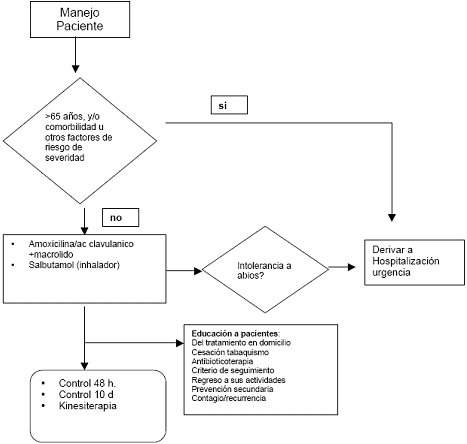 Tamaño completo
Tamaño completo Figura 4.
En cuanto a la prevención, es importante considerar las vacunas. En general, la vacuna antiinfluenza está disponible para todos los pacientes sobre los 65 años, estén adscritos al sistema ISAPRE o al sistema público (FONASA). La vacuna antineumocócica está más restringida y se podría indicar a los pacientes sobre los 65 años, pero con enfermedades concurrentes específicas.

