Congresos
← vista completaPublicado el 1 de marzo de 2006 | http://doi.org/10.5867/medwave.2006.02.1019
Historia natural y manejo de la hepatitis C en el peritrasplante
Natural history and management of hepatitis C in the peri-transplant period
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
Introducción
La historia natural de la hepatitis C postrasplante es conocida. Se sabe que la recurrencia después del trasplante hepático es universal, es decir, se presenta en todos los casos (Garcia-Retortillo et al. Hepatology 2002) y que la tercera parte de los trasplantados hepáticos infectados por virus hepatitis C van a desarrollar cirrosis en pocos años (Prieto et al, Hepatology 1999), lo que es muy importante, porque afecta la sobrevida del injerto y del paciente (Forman 2002). A continuación se intentará demostrar los puntos anteriores, por medio de algunas publicaciones.
Cinética de la infección del injerto hepático
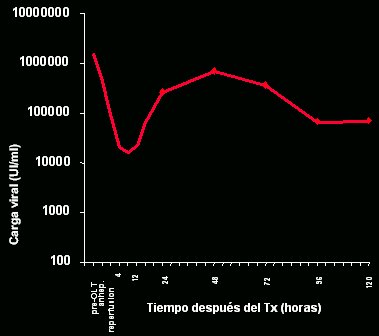
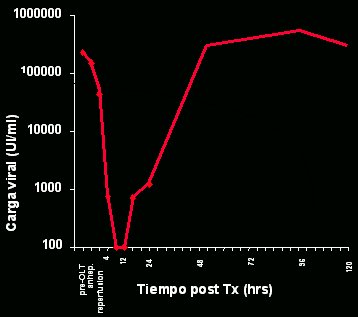
En un estudio efectuado en nuestra unidad hace algunos años, en el que se estudió en forma muy fina la cinética de la infección del injerto, se comprobó que ésta ocurría muy rápidamente. Si se correlaciona la carga viral, en escala logarítmica, con el tiempo postrasplante en horas (Figs. 1 y 2), se puede observar que, en algunos pacientes, la carga viral alcanza niveles similares a los previos al trasplante unas pocas horas después de éste. Lo observado es universal: en todo paciente, la carga viral pretrasplante se relaciona con la reinfección. Se ha demostrado que la reinfección se debe a viriones circulantes, pero no siempre es esa la causa; algunos indicios apuntan a que también podría provenir de compartimentos extrahepáticos.
 Tamaño completo
Tamaño completo Figura 1. Cinética de la infección del injerto hepático (García-Retortillo et al, Hepatology 2002).
 Tamaño completo
Tamaño completo Figura 2. Cinética de la infección del injerto hepático (García-Retortillo et al, Hepatology 2002).
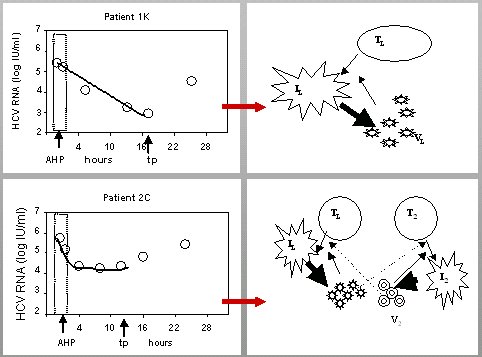
En este estudio se analizó en forma detallada la cinética (Fig. 3). Si la infección se produjera desde un solo compartimento, tendría una curva mono compartimental, es decir, una curva de descenso; pero se observó que en algunos pacientes la curva alcanza un plateau y el virus empieza a replicar varias horas después del trasplante, lo que plantea que quizás haya producción de viriones a partir de un compartimiento extrahepático. Si se quita el hígado, como ocurre durante la intervención quirúrgica, que es la fuente principal de producción de virus, la curva de caída llega a cero y ahí permanece hasta que se inicia la replicación en el injerto. En algunos pacientes, desde que se quita el hígado hasta que en el nuevo injerto empieza la replicación, ocurre un plateau; esto, aunque contribuye poco a la carga viral, posiblemente sea consecuencia de la producción de viriones en un segundo compartimento.
 Tamaño completo
Tamaño completo Figura 3. Infección del injerto a partir de un segundo compartimento (García-Retortillo et al Hepatology 2002, Dahari et al. J Hepatol 2005).
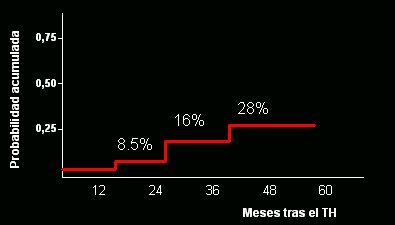
El impacto que este fenómeno tiene sobre la sobrevida del injerto y del paciente es muy relevante. En un estudio clásico de Martín Prieto, publicado hace algunos años, efectuado en 81 receptores de trasplante infectados por el VHC entre 1991 y 1996, se demostró la importancia de la recurrencia del virus C postrasplante, ya que en casi 30% de los casos se desarrolló cirrosis a los 5 años del trasplante (Fig. 4).
 Tamaño completo
Tamaño completo Figura 4. Desarrollo de cirrosis en 81 receptores de injerto infectados por el VHC entre 1991 y 1996 (Prieto et al., Hepatology 1999).
De la misma manera, Forman describió la sobrevida del injerto y del paciente, en comparación con pacientes trasplantados por causas distintas al virus C y observó que a los 5 años había una diferencia significativa en ambos aspectos (Forman et al, 2002).
Historia natural de la hepatitis C post trasplante
La evolución de la cirrosis compensada en el paciente trasplantado por hepatitis C es mucho más rápida que en el paciente inmunocompetente, como lo demostró Berenguer en un estudio efectuado en 39 pacientes con cirrosis clínicamente compensada tras el trasplante hepático, en quienes se hizo seguimiento durante 1 año, en promedio (15 días a 3,5 años). El genotipo era 1b. Hubo descompensación en 18 de los 39 casos y las variables relacionadas con este fenómeno fueron albúmina baja y un intervalo corto entre el trasplante hepático y la cirrosis. Aunque la muestra es pequeña, en la curva de seguimiento (Fig. 5), se puede observar la velocidad con que aparece la descompensación, que ocurre en pocos días; en un año, la mitad de los pacientes se han descompensado y, en dos años, la mitad han muerto; es decir, la evolución de la cirrosis postrasplante es mucho más rápida. Esa es la relevancia de la reinfección C postrasplante.
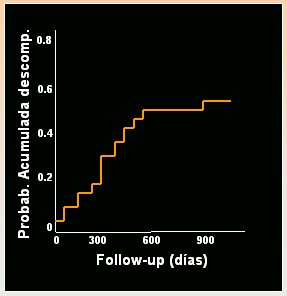 Tamaño completo
Tamaño completo Figura 5. Hepatitis C tras el trasplante. Historia natural de la cirrosis compensada (Berenguer et al, Hepatology 2000).
En cuanto a las variables que influyen en la evolución de la recidiva, muchos factores pueden afectar la historia natural de la recurrencia C postrasplante. Entre ellos están los factores virales, como la carga viral pretrasplante, el genotipo y las cuasiespecies; los factores quirúrgicos, como el tiempo de isquemia; los relacionados con el donante, como la edad y el grado de esteatosis del injerto; y los relacionadas con el receptor, como el tipo de inmunosupresión (corticoesteroides en dosis altas, OKT-3), los episodios de rechazo (bolos de corticoides) y la infección por CMV. Muchos de los estudios son retrospectivos y la definición de recurrencia grave es muy heterogénea: algunos se basan sólo en las transaminasas y otros, en biopsias no protocolizadas, es decir, que se han tomado a diferentes tiempos. Son pocos los estudios con biopsias protocolizadas, que permitan evaluar la recurrencia grave de manera realmente fiable.
Una de las variables clásicas es la influencia de la cuasiespecie viral en la recurrencia del trasplante. Los datos del estudio de la Clínica Mayo (Fig. 6 A) plantean que la complejidad viral, es decir, el número de cepas distintas que hay en un individuo, podría afectar la recurrencia, de tal manera que cuanto mayor sea la complejidad, menor será la gravedad de la recurrencia. En un estudio que publicamos hace años, en el que también analizamos la complejidad y la diversidad genética en los pacientes con recurrencia leve y grave, esta última definida como cirrosis en 3 a 5 años postrasplante, comprobamos que la secuencia de la región hipervariable del virus era mucho más variada en pacientes con recurrencia leve, lo que plantea que la composición viral podría desempeñar un papel en el resultado del injerto (Fig. 6 B).
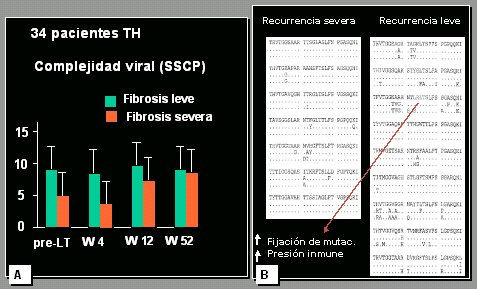 Tamaño completo
Tamaño completo Figura 6. Cuasiespecies del VHC. A: Arenas et al, 2003; B: (Sanchez-Fueyo et al, 2001).
Sin embargo, en el período postrasplante pueden actuar muchas variables; hay que analizarlas con prudencia. Quizás la variable que más llama la atención y sobre la que más se ha publicado es la edad del donante. Más de seis estudios han demostrado que cuanto mayor es la edad del donante, peor es el pronóstico y la evolución postrasplante, entre ellos un estudio de Berenguer, de Valencia, en que el autor demostró que los pacientes que recibieron hígado de un donante añoso tuvieron peor evolución (Berenguer et al, Hepatology 2002).
En otro estudio, Rifai analizó el hígado de 270 pacientes trasplantados hepáticos de más de 10 años de evolución (por virus C y no C) y observó que los cambios histológicos más frecuentes eran fibrosis (54%) y ductopenia (29%) y que ésta se asociaba con la edad del donante; en cambio, la presencia y gravedad de la fibrosis se asociaba con la edad del donante y con la infección por virus C. En ambos casos, la infección C era de peor pronóstico, es decir, los pacientes con recurrencia C tenían más fibrosis y, además, los que recibieron trasplante de pacientes de edad avanzada tuvieron mayor incidencia de recurrencia grave (Rifai et al. 2004).
La diferencia entre donante vivo y cadáver, en relación con la recurrencia, es motivo de controversia; algunos estudios, entre ellos el nuestro, plantean que hay diferencia, pero es probable que en otros estudios se apunte a que no la hay. Evidentemente, el donante vivo tendría que influir de modo positivo en la sobrevida del trasplante en la hepatitis C, ya que tiene varios elementos favorables: no hay esteatosis del injerto, el donante joven (en general son de hijos a padres) y el tiempo de isquemia es corto. Los elementos desfavorables serían el HLA matching frecuente, las complicaciones biliares (colestasis), la baja capacidad de metabolizar inmunosupresores y la regeneración hepática; no obstante, la curva de sobrevida sin cirrosis es similar, como se observó en nuestro estudio, realizado en 117 pacientes, en el que se observaron dos factores que predecían recurrencia grave, es decir, cirrosis diagnosticada con histología: la inflamación relevante a los tres meses, definida por la presencia de inflamación lobulillar en biopsia o por aumento de las transaminasas, y el donante vivo (Garcia-Retortillo et al. Hepatology 2004).
Es difícil explicar por qué un donante vivo podría afectar negativamente la evolución de la enfermedad. Una hipótesis, que no está demostrada, es que pueden influir dos variables. Una sería la mayor incidencia de complicaciones biliares, lo que es irrefutable, ya que el donante vivo las presenta con más frecuencia y se sabe que la colestasis crónica es un factor fibrogénico: de hecho, la ligadura de colédoco es el modelo experimental más conocido de cirrosis en ratas. La segunda variable sería la regeneración, ya que la replicación viral es muy importante en los primeros días y semanas postrasplante, y eso va a coincidir con un hígado que se regenera con mayor velocidad en la primera y segunda semanas postrasplante; la conjunción entre replicación hepática y replicación viral podría favorecer la activación de células estrelladas. En suma, no se conoce el mecanismo, pero hay algún indicio en el sentido de que la cinética es distinta con donante vivo que con donante cadáver.
Otro factor que tiene mucha repercusión, pero que está mal estudiado, es el tipo de inmunosupresión. Numerosos estudios han intentado analizar la influencia de los diferentes inmunosupresores sobre la gravedad de la recurrencia VHC, pero muchos de esos estudios no han tenido un número significativo de enfermos o han sido retrospectivos, a lo que se agrega que hay un exceso de variabilidad en las pautas inmunosupresoras. El estudio de Valencia demuestra que la recurrencia de la infección C es peor cuanto más cercano es el año del trasplante; es decir, los trasplantados en los primeros años de la década de 1990 evolucionaron mejor que los trasplantados en los últimos años de la misma década (Berenguer et al 2002), lo que se explicaría porque la inmunosupresión es más potente hoy en día. Los estudios retrospectivos plantean que la inmunosupresión podría influir negativamente en la evolución de la recurrencia C.
Manejo terapéutico de la hepatitis C postrasplante
Es importante evitar la recurrencia de la hepatitis C, porque ésta tiene efectos importantes en la sobrevida del injerto y del paciente. Además, en los programas de trasplante europeos, americanos y japoneses, es el principal problema en la lista de espera: 60% de las indicaciones de trasplante son dadas por el virus C. El manejo tiene tres enfoques:
- Tratamiento antiviral pretrasplante.
- Inmunoprofilaxis, sobre la cual, desgraciadamente, no hay nada todavía.
- Tratamiento antiviral postrasplante, que puede ser precoz o tardío.
El tratamiento antiviral pretrasplante consiste en tratar a los pacientes en lista de espera con interferón y ribavirina, desde alrededor de cuatro meses antes y hasta el mismo día del trasplante, con el objetivo de lograr, no una respuesta mantenida sino una respuesta intra tratamiento, de modo de quitar el hígado y colocar el homoinjerto cuando no hubiera carga viral positiva. En cuatro pacientes tipo (Fig.7), la carga viral se representa (en escala logarítmica) en el eje de las ordenadas; en el eje de las abscisas está el tiempo (en semanas); y la línea vertical es el momento del trasplante. El primer paciente fue no respondedor, con carga viral inalterada, bajó postrasplante y subió rápidamente; el segundo paciente fue respondedor parcial; el tercero tuvo respuesta persistente tras el trasplante y el cuarto representa los casos en que el paciente tenía carga viral indetectable previo al trasplante; se transplantaba sin virus detectable, pero a las semanas de trasplante el virus reaparecía. Con esta pauta de tratamiento pretrasplante se logró erradicar la infección en 20% a 25% de los pacientes.
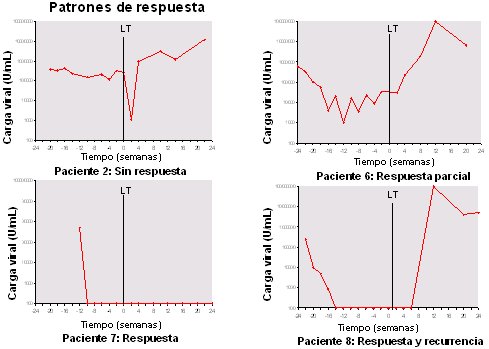 Tamaño completo
Tamaño completo Figura 7. Tratamiento en lista de espera: eficacia 25% (Forns et al, J Hepatol 2003).
El tratamiento pretrasplante no se puede aplicar a todos los pacientes, sino sólo a 50% de ellos, porque puede producir plaquetopenia, leucopenia, descompensación y disfunción hepática grave; es decir, hay pacientes en que no se puede aplicar el tratamiento debido a efectos adversos graves, de modo que es necesario efectuar un seguimiento muy estricto. En la evolución de un paciente tratado en lista de espera (Fig. 8) con interferón alfa pegilado 2b (100 ug/kg) y ribavirina (400 mg/12 h), la carga viral era de 500.000 y el genotipo, 1b. Con el inicio del tratamiento, como era de esperar, los neutrófilos bajaron mucho y, en vista de que la carga viral bajó a 3.000, es decir, que hubo un descenso de dos logaritmos, decidimos administrar factores estimulantes, con lo que se recuperaron rápidamente las cifras de granulocitos. A mitad del tratamiento el paciente presentó una anemia que requirió factores estimulantes, pero la carga viral fue indetectable a las 10 semanas, por lo que en ese momento se efectuó el trasplante. El paciente no ha presentado recidivas después de más de 6 meses de seguimiento.
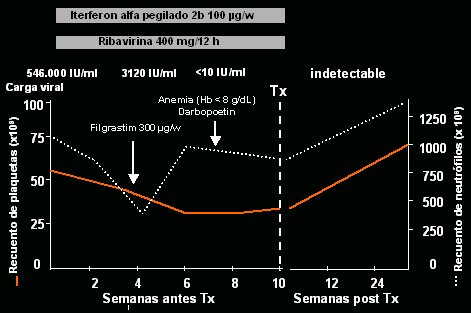 Tamaño completo
Tamaño completo Figura 8. Tratamiento en lista de espera: caso clínico.
La profilaxis con anticuerpos no tiene aplicación en la actualidad, ya que no se dispone de anticuerpos específicos contra el VHC que hayan demostrado eficacia. Esto se debe a la variabilidad genética del virus, que facilita su escape del sistema inmune, y a que los epítopos de neutralización no son bien conocidos, por lo que no hay estudios con anticuerpos que hayan indicado un efecto antiviral y profiláctico eficaz; es decir, no hay estudios de neutralización reproducibles.
El tratamiento postrasplante puede ser precoz o tardío. El primero es poco aplicable, porque los pacientes no toleran el tratamiento inmediato y se sabe que, si se comienza en el día cero, a las 48 horas la carga viral muchas veces supera los niveles pretrasplante; por lo tanto, desde el punto de vista cinético tiene poco sentido. En el estudio de Samuel, que es el único estudio aleatorio y controlado con interferón pegilado, hubo una respuesta sostenida de 21%, es decir, son eficacias bajas en general, mucho menores que las que se observan en pacientes inmunocompetentes. Por otra parte, en los estudios de Samuel (2003), de Chalasani (2005) y el nuestro (Carrion, 2005) (Fig. 9), todos ellos controlados, no hubo respuesta alguna en el grupo control; en el estudio de Samuel, en el que se combinó interferón estándar con ribavirina, la respuesta fue de 21%; en el de Chalasani, con interferón como monoterapia, hubo muy poca respuesta (12%); en el nuestro, que combinó interferón pegilado con rivabirina, la respuesta fue de 37%, pero a expensas de gran cantidad de efectos adversos. Se describe una incidencia de efectos graves de 20% a 42%.
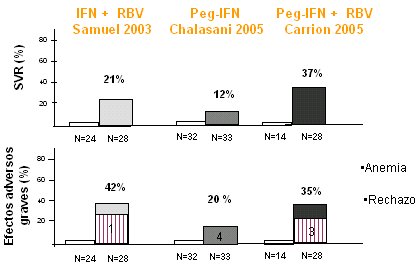 Tamaño completo
Tamaño completo Figura 9. Manejo terapéutico de la hepatitis C post trasplante hepático.
En los estudios que utilizan ribavirina, la anemia es el efecto adverso más frecuente y obliga a suspender el tratamiento hasta en la tercera parte de los pacientes. Tampoco hay que olvidar la posibilidad de rechazo que, aunque ocurre en pocos casos, es grave. Algunas evidencias plantean que el rechazo es más frecuente en los pacientes que alcanzan respuesta terapéutica; es decir, los pacientes en quienes la carga viral se negativiza tienen mayor riesgo de un rechazo. Por otra parte, con el pegilado la respuesta sería un poco más elevada que con interferón estándar.
Hay un algoritmo (Fig. 10) para el manejo del paciente con infección VHC. En él se plantea que los pacientes en lista de espera, con cirrosis compensada, es decir, pacientes en quienes la indicación es un hepatocarcinoma CHILD A, se debería ofrecer tratamiento antiviral. No todo el mundo está de acuerdo con esto, pero son pacientes cirróticos compensados, que toleran bien el tratamiento y a veces tienen buena respuesta, con lo que se pueden evitar problemas a posteriori sin causar grandes efectos secundarios. En pacientes con cirrosis descompensada se debe actuar con más prudencia, porque los efectos pueden ser mucho más graves. A pacientes con un perfil virológico correcto, genotipo 2 ó 3, o genotipo 1 con carga viral baja, se les puede ofrecer tratamiento antiviral, si se les explica bien los riesgos.
En caso de recurrencia de la infección tras el trasplante, se debe seguir un protocolo de biopsias anuales, para seguir la evolución de la recurrencia por virus C. Si la biopsia o la analítica demuestra que la recurrencia es grave, se les debe tratar precozmente con terapia antiviral; por ejemplo, si un paciente hace una colestasia fibrosante al segundo mes, se le debe tratar, porque es la única opción que tiene. En pacientes sin recurrencia grave, lo mejor es hacer biopsias de seguimiento; y en aquellos en que se demuestra progresión, es decir, rebase del espacio porta o fibrosis II o más, se les debe ofrecer tratamiento antiviral. En los pacientes que no tienen progresión de la fibrosis, dados los efectos secundarios graves del tratamiento, es más prudente hacer un seguimiento, sin terapia.
Es probable que dentro de algunos años se disponga de fármacos más eficaces que, solos o en combinación, permitan prevenir la recurrencia grave de la infección.
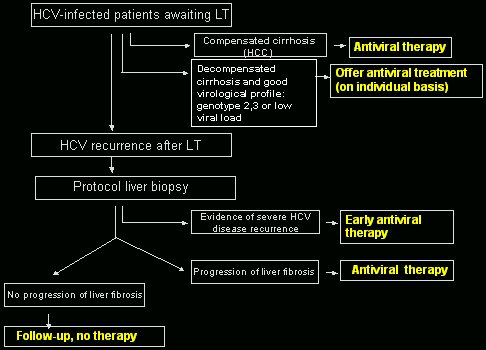 Tamaño completo
Tamaño completo Figura 10. Algoritmo para el manejo del paciente con infección VHC (Forns et al. J Hepatol 2004).

