Congresos
← vista completaPublicado el 1 de julio de 2007 | http://doi.org/10.5867/medwave.2007.06.1042
Inmunomodulación en hemofiltración: lecciones desde la sepsis
Immunomodulation in hemofiltration: Lessons from sepsis
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por la Sociedad Chilena de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores
Introducción
A continuación se analizará el papel que cumplen las terapias extracorpóreas en el complejo síndrome de la sepsis. Se examinará el paso desde las observaciones clínicas a los mecanismos; las fases humorales y celulares de la sepsis; la red de citoquinas; las funciones celulares; la hipótesis de los picos de concentración; el concepto de ambiente séptico y la homeostasis inmune. Todo esto, porque en la actualidad las terapias extracorpóreas se están aplicando a situaciones diferentes a la original, que es la terapia de reemplazo renal; un ejemplo es el caso de un paciente con rabdomiolisis séptica aguda y síndrome de distrés respiratorio del adulto tratado con HF-CPFA (Coupled Plasma Filtration-Adsorption) isovolémica.
La secuencia de hechos en la sepsis es como sigue: invasión bacteriana del huésped; presencia de exotoxinas y endotoxinas en la sangre; reconocimiento de lipopolisacáridos (LPS) por receptores específicos; activación de la respuesta humoral; activación de señales y vías celulares específicas; y producción de mediadores químicos proinflamatorios. Así, el proceso se mueve desde la inflamación hacia el síndrome de respuesta sistémica (SIRS) y desde ahí, a la sepsis y el shock séptico.
La activación de las vías humorales por los LPS lleva a la activación de anafilotoxinas (C3a y C5a), las que a su vez causan agregación plaquetaria (con la participación del factor XII de Hageman); disminución de la resistencia vascular y aumento de la permeabilidad; y activación de los neutrófilos en el endotelio. Al ser activados, los neutrófilos liberan mediadores, como el factor activador de plaquetas (PAF), que tiene diversos efectos biológicos: induce la agregación plaquetaria; promueve la quimiotaxis de los neutrófilos; aumenta la permeabilidad vascular; altera el tono vascular; activa los monocitos; y promueve la degranulación de las plaquetas y los neutrófilos. Por lo tanto, desde el punto de vista biológico, estos mediadores disponen de un amplio espectro de acciones. Cuando el LPS entra en la circulación, también se origina una activación de vías celulares. La proteína ligadora del LPS (LBP) captura el LPS y forma un complejo que se une a los receptores CD14 de la superficie del monocito y lo activa (Fig. 1). Al mismo tiempo, el CD14 soluble, unido a los complejos LPS-LBP, puede encontrar los receptores para CD14 soluble en la superficie del endotelio, lo que causa la activación de la célula endotelial. Aquí, el monocito cumple tres papeles fundamentales: reconocimiento temprano de LPS y complejos LPS-LBP, producción de citoquinas y depuración sanguínea de LPS y complejos.
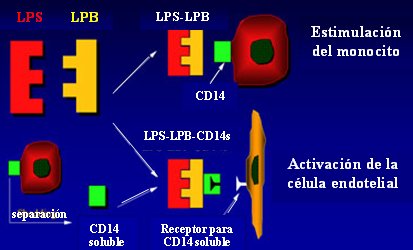 Tamaño completo
Tamaño completo Figura 1. Formación de complejos LPS/proteína en el plasma
Purificación sanguínea extracorpórea en la sepsis
La purificación sanguínea extracorpórea en la sepsis se basa en que, como ciertos factores humorales participan en la patogénesis de la sepsis y el shock séptico, el intercambio de agua plasmática que se realiza en la terapia de reemplazo renal podría contribuir a remover estos mediadores químicos. Por otra parte, se sabe que hay una des-regulación inmune general y que la función de los monocitos está comprometida; por tanto, en vez de dirigirse hacia moléculas específicas, el tratamiento se debe orientar a modificar el ambiente hostil en el cual las células operan por fuerza. La situación es similar a lo que ocurre con la uremia; aún no se ha podido definir claramente en qué consiste, pero se podría considerar como un ambiente no fisiológico en el cual las células están obligadas a funcionar. La sepsis, hasta cierto punto, es lo mismo, pero más agudo.Los mediadores que participan en este proceso son muchos, entre ellos C3a desArg, C5a desArg, IL-1a, IL-1Ra, TNF alfa, IL-6, IL-8, IL-10, PAF, factor D, etc. Lo interesante es que algunos de ellos presentan unión a proteínas y otros no, y que su peso molecular, entre 2.500 y 75.000, está más o menos en el rango de aquellas sustancias que las membranas pueden remover; pero cuando se espera el aclaramiento de algún soluto, muchas veces las cosas no salen como se prevé, porque, desafortunadamente, las cargas eléctricas o la unión a proteínas o a lípidos pueden disminuir la remoción de aquel soluto; en algunos casos hay remoción excesiva, especialmente en tratamientos en que se pensaba que se estaba haciendo difusión y de hecho hay convección; o bien, cuando el coeficiente de difusión es mejor de lo previsto, debido a la configuración estérica de la molécula.
En 1992, Grootendorst publicó los resultados de un estudio efectuado en cerdos a los que se inyectó endotoxina, es decir, se les volvió sépticos y luego se les hizo filtración, lo mismo que a un grupo de cerdos que no recibieron esta inyección. Luego se inyectó el ultrafiltrado de ambos grupos en cerdos sanos y se observó que en los cerdos inyectados con el ultrafiltrado proveniente de cerdos sépticos bajó la presión arterial media y bajó el gasto cardiaco y los animales presentaron síntomas de sepsis. Esto significa que algo que vuelve sépticos los cerdos está presente en el ultrafiltrado.
Hay varios mecanismos para remover sustancias. Por ejemplo, el peso molecular del TNF es de 54.000 daltons, de modo que es difícil imaginar cómo esta molécula puede atravesar la membrana. Hoy se sabe que se trata de una molécula trimérica y es probable que los monómeros atraviesen la membrana por dos mecanismos: simplemente atravesándola o bien, por adsorción a la estructura de la membrana y posterior desplazamiento por otras moléculas, es decir, en un proceso de dos pasos. La capacidad de adsorción de la membrana se puede determinar mediante inmunofluorescencia, como la que se utiliza en las biopsias renales, lo que permite encontrar, por ejemplo, positividad para endotoxina o para mediadores proinflamatorios, como IL-1 o TNF-alfa.
En hemofiltración, el aclaramiento tiene dos componentes, que son el coeficiente de tamizaje de la membrana y la tasa de ultrafiltración; para aumentar el aclaramiento se puede aumentar la permeabilidad o la cantidad de filtración, o ambos. Lo importante es que si algo de intercambio del agua plasmática es beneficioso en el shock séptico, el intercambio intensivo, con alto volumen de ultrafiltrado, puede agregar otros beneficios.
Cole hizo un estudio aleatorio y controlado sobre hemofiltración continua en sepsis, en el que se trató de determinar si el uso de hemofiltración isovolémica, a razón de 2 litros por hora, presentaba alguna ventaja en pacientes con sepsis, en comparación con el no uso de hemofiltración (Crit Care Med 2002). La autora no encontró ninguna diferencia con esos volúmenes; sin embargo, en varios artículos se describe que el uso de hemofiltración de alto volumen en pacientes con sepsis, tiene ventajas; el último, publicado por nuestro grupo en Intensive Care Medicine en enero de 2006, demuestra que el uso temprano de hemofiltración isovolémica de alto volumen mejora la sobrevida en pacientes con disfunción pulmonar y sepsis. Cole, usando esta vez 6 litros por hora en pacientes con shock séptico, comprobó que había diferencias en los requerimientos de fármacos vasopresores y en los niveles de anafilotoxinas.
Como ya se mencionó, otra forma de aumentar el aclaramiento es aumentar el coeficiente de tamizaje. Matson, usando una membrana con poros de gran tamaño, mejoró la vida en animales con sepsis mortal.
Por último, los estudios de nuestro grupo con uso de sorbentes en terapias combinadas demuestran que aumenta la adsorción y hay disminución significativa de TNF y IL-1 beta. El uso de sistemas para remover endotoxinas permite intervenir en forma temprana en la cascada de la sepsis, ya que se consigue neutralizar las endotoxinas, ejercer acción bactericida y, posiblemente, remover citoquinas. En la terapia que utiliza la combinación de filtración de plasma acoplada a sorbentes, o HF-CPFA (Coupled Plasma Filtration-Adsorption), se filtra el plasma y se lo hace circular a través de un sorbente, lo que regenera el plasma filtrado; este procedimiento evita pérdidas no deseadas, evita el contacto de los glóbulos rojos, blancos y plaquetas con el sorbente, y previene la trombocitopenia que induce el tratamiento.
Los resultados de nuestros estudios demostraron que los mediadores estaban presentes en el ultrafiltrado de plasma. Con el sorbente que se utilizó inicialmente (Detoxyl ®) no se comprobó diferencias en la remoción de mediadores, por lo que se utilizó un sorbente específico para este objetivo (Mediasorb®), lo que mejoró este parámetro. Por último, se aplicó el sistema en animales y se demostró que la sobrevida de los animales tratados con el sistema fue similar a la de los animales con tratamiento control, que no fueron inyectados con endotoxina; en cambio, todos los animales inyectados con endotoxina que no recibieron tratamiento murieron (Fig. 2).
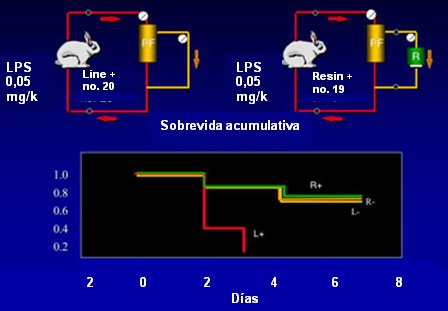 Tamaño completo
Tamaño completo Figura 2. Filtración de plasma acoplada con sorbentes (HF-CPFA, Coupled Plasma Filtration-Adsorption) en un modelo de shock tóxico en conejos.
Posteriormente nuestro grupo hizo un estudio prospectivo, aleatorio y controlado, en el que se comparó el efecto de 10 horas de CPFA versus 10 horas de CVVH (Continuous Veno-Venous Hemofiltration), con un período de washout nocturno (Fig. 3). De nuevo, se observó que mejoraba la resistencia vascular sistémica y el índice cardíaco, con leve mejoría en la presión arterial media y disminución de los requerimientos de norepinefrina para mantener al paciente estable. No hubo cambios en los niveles de TNF, pero hubo un cambio importante en la capacidad de las células para responder, luego de la incubación con LPS. Avaló este efecto el hecho de que, después del sorbente, el plasma de estos pacientes no inhibía las células, a diferencia del plasma antes del cartucho, de modo que el sorbente estaba removiendo algo. Por último, se demostró que lo que se estaba removiendo era IL-10, un mediador antiinflamatorio.
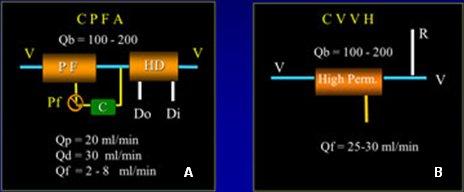 Tamaño completo
Tamaño completo Figura 3. CPFA (A) versus CVVH (B) Diseño del estudio.
En resumen, en este estudio sobre la CPFA se comprobó mejoría de la mortalidad, aunque no era la variable principal de evaluación en este estudio; mejoría de la hemodinamia; reducción de los requerimientos de vasopresores; mejoría de la respuesta de los monocitos al LPS; mejoría de la fagocitosis y efectos inmunomodulatorios mediante una reprogramación de TNF/IL-10. Es decir, el monocito humano, en el paciente séptico, tiene disminuida la capacidad de producir citoquinas frente a una estimulación in vitro. Frente a lo anterior surgieron varias interrogantes: ¿Se trata de células exhaustas? ¿Las células están inhibidas? ¿La remoción se orienta hacia la reducción de mediadores peligrosos o hacia la modulación de la actividad del monocito, permitiéndole recuperar su función de secreción con efectos autocrinos y paracrinos?
Si se inyecta un animal con LPS se forman picos, tanto de mediadores inflamatorios como de mediadores antiinflamatorios. Los tratamientos pueden cortar estos picos, cuya vida media es muy corta (Fig. 4); por eso conviene mantener una terapia continua, ya que no se puede predecir el momento en que van a aparecer estos picos.
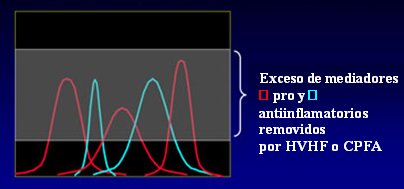 Tamaño completo
Tamaño completo Figura 4. Hipótesis del pico de concentración.
A la luz de lo expuesto, los criterios para medir la eficiencia de una nueva terapia no se deben limitar a la respuesta hemodinámica, con mejoría de presión arterial media, resistencia vascular e índice cardíaco, además de reducción del uso de fármacos vasopresores, sino que se debe esperar una reducción de los niveles circulantes de citoquinas proinflamatorias o endotoxinas y mejoría de los scores de gravedad, además de restablecer la respuesta celular. En este sentido se ha desarrollado la hemofiltración de pulso. En el paciente séptico hay células que ya no responden, de modo que, por un lado, está muy inflamado y, por el otro, está inmunodeprimido; frente a este cuadro, nuestro grupo planteó que la hemofiltración de pulso de alto volumen podría ser útil, lo que se avaló con un estudio en el cual se demostró que, después del tratamiento, las células producían TNF en respuesta a la incubación con LPS y la capacidad de fagocitosis de los monocitos aumentaba en 75%.
El ambiente hostil en la sepsis
En la Fig. 5 se ilustra el concepto de ambiente hostil en la sepsis. Por una parte, la lesión isquémica causa cambios hemodinámicos que a su vez podrían llevar a hipoperfusión, disminución de la presión de perfusión, aumento de la resistencia vascular renal, desequilibrio entre endotelina y oxido nítrico y daño por reperfusión. Por otra parte está la sepsis, con la inflamación sistémica y todos los mediadores. Entre ambas se encuentran las toxinas exógenas, que dañan el riñón a través de hipoxia, toxicidad por estrés oxidativo y óxido nítrico. Todo esto causa daño celular, cuya magnitud puede desencadenar lesiones subletales, apoptosis y necrosis.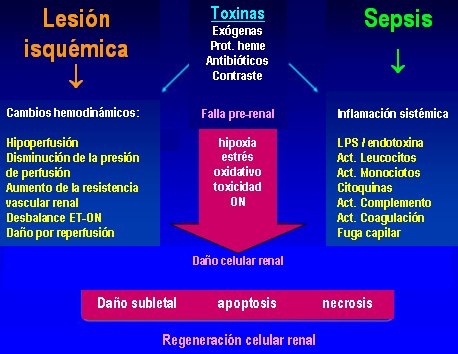 Tamaño completo
Tamaño completo Figura 5. Ambiente hostil en la sepsis.
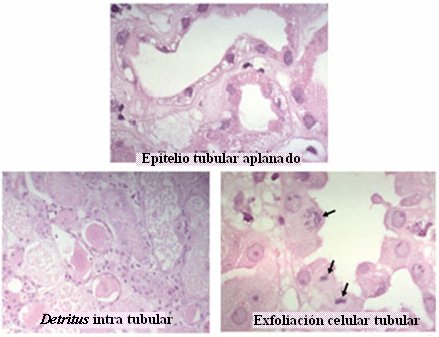
En el modelo típico de reperfusión post isquemia, en el epitelio normal se pierde la polaridad, desaparecen las moléculas de adherencia y se presenta intensa necrosis y algo de apoptosis; las células se descaman, algunas aún viables, hacia el lumen tubular. Luego hay migración, desdiferenciación y proliferación celular, lo que permite volver a la normalidad. En la Fig. 6 se observa la imagen típica de pérdida de moléculas de adherencia, con descamación de las células tubulares y epitelio tubular de aspecto aplanado.
 Tamaño completo
Tamaño completo Figura 6. Histología en la reperfusión renal post isquemia
Es frecuente que en la sepsis no disminuya el flujo sanguíneo renal; de hecho, en la mayoría de los casos se observa una circulación hiperdinámica. La hipoperfusión renal sostenida, con isquemia renal, global o regional, seguida de reperfusión, sería el principal evento desencadenante de la insuficiencia renal aguda; pero si lo anterior vale en los modelos de isquemia-reperfusión y, probablemente, en los estados sépticos hipodinámicos, ¿se podrá aplicar a los estados sépticos hiperdinámicos? Se ha demostrado que en estos últimos hay redistribución del flujo y vasodilatación renal, de modo que el flujo sanguíneo se mantiene; por tanto, la lesión se debe a los efectos tóxicos que se han mencionado.
Además de la necrosis tubular aguda, en la sepsis se puede presentar un estado llamado apoptosis tubular aguda; en otras palabras, el proceso fisiológico de la apoptosis se vuelve patológico debido a las condiciones propias de ambiente hostil, que llevan a un estado apoptótico prevalente. Si en las biopsias de los pacientes con IRA por sepsis no se suele encontrar gran cantidad de apoptosis es porque los monocitos remueven los cuerpos apoptóticos rápidamente. No importa si existe un daño primario renal, porque al final la disfunción renal forma parte del círculo vicioso del síndrome. Se sabe que las células tubulares renales pueden morir de necrosis, pero también de apoptosis; que ésta requiere depleción de GTP; y que, si se inhibe a las enzimas caspasas, la apoptosis disminuye.
Hay dos mecanismos por los cuales una célula puede entrar en apoptosis: uno es la vía de los receptores de muerte celular, que son receptores para TNF o para Fas y Fas-ligando; el otro es la vía del daño celular, en la cual se encuentran las proteínas Bax, que son parte de la familia de BCL-2 y que al ser activadas causan la salida del citocromo C desde la mitocondria, con la consecuente activación de procaspasa-3, caspasa-3 y caspasa-9, que finalmente desencadenan la apoptosis. Es interesante el hecho de que, frente a estas proteínas Bax apoptóticas, hay una molécula especular que es anti-apoptótica. Bax es un miembro pro-apoptótico de la familia de BCL-2 que inhibe la acción anti-apoptótica de BCL-2; se sabe que el knock-out del gen Bax causa tumorogénesis en ratones, no por proliferación celular, sino por falta de muerte celular programada. Por otro lado, BCL-2 es anti-apoptótica; si se sobreexpresa de manera inapropiada también se originan tumores sólidos y, además, contribuye a causar resistencia a la quimioterapia, debido a que impide la apoptosis normal de las células.
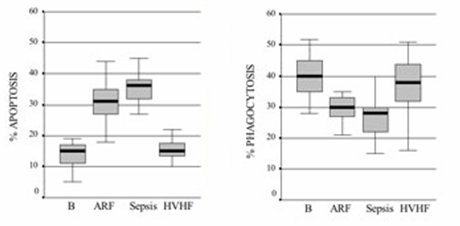
En cuanto a la relación entre el ambiente hostil y la apoptosis (Fig. 7), al observar los niveles basales de apoptosis en sujetos normales y sujetos con insuficiencia renal aguda y sepsis, se puede ver que en los últimos hay una situación de apoptosis patológica, la cual se revierte parcialmente con la hemofiltración de alto volumen. Lo más sorprendente es que la apoptosis se relaciona en forma inversa con la función fagocítica y, de nuevo, la hemofiltración de alto volumen restablece la capacidad de fagocitosis. Por lo tanto, ya no se habla de remover urea o de remover TNF-alfa, sino de remover el ambiente plasmático en el cual las células tienen que operar por fuerza.
 Tamaño completo
Tamaño completo Figura 7. Apoptosis y fagocitosis. B = estado normal; ARF = insuficiencia renal aguda; HVHF = hemofiltración de alto flujo
En otros estudios se ha visto que si se utiliza 4 litros por hora en vez de 2 litros por hora el porcentaje de apoptosis cae significativamente a la hora de tratamiento y si después se vuelve a 2 litros por hora, el efecto se mantiene. Esta es la justificación para hacer hemofiltración de pulso. Es interesante que si se utiliza 2 litros por hora se obtiene algo; si se emplea 2 litros por hora primero y luego se sigue con 4 litros por hora, con el mismo filtro, no se obtiene el mismo resultado después de una hora de alto volumen, sino después de cinco horas. Es probable que lo dicho se deba a que, después de 12 ó 24 horas de uso, el filtro se tapone y el aclaramiento disminuya, incluso con alto volumen, de modo que probablemente sea mejor cambiar el filtro, hacer alto volumen y luego seguir con bajo volumen. Más o menos el mismo tipo de comportamiento se observa en las mediciones de caspasa-3, aunque las variaciones son más amplias y se obtienen valores menos significativos.
Nuestro grupo también estudió la posibilidad de usar sorbentes para remover el potencial pro-apoptótico del plasma y comprobó un efecto de arteria a vena muy pequeño, pero que aumentaría con el tiempo, de modo que los sorbentes pueden ser útiles en este aspecto.
HLA-DR
Los estudios más recientes de nuestro grupo se concentran en HLA-DR. Las moléculas HLA de clase 2 se encuentran en células inmunocompetentes: linfocito B, células presentadoras de antígenos y células T activadas. La función de las moléculas HLA de clase 2 es procesar y presentar fragmentos de péptidos antigénicos a los linfocitos T CD-4, en el inicio de la respuesta inmune; de ahí que la expresión de HLA-DR en la superficie celular se considere un indicador significativo de la respuesta inmune, debido a su importante papel en la presentación antigénica. Varios investigadores documentaron una asociación entre la expresión disminuida de HLA-DR y la desactivación funcional de los monocitos, y establecieron que la disminución de la expresión de HLA-DR puede ser signo de inmunosupresión grave. Una vez más se hace referencia a la sepsis, no como un trastorno proinflamatorio, sino como un trastorno inmune que incluye inflamación e inmunodepresión. Los monocitos con baja expresión de HLA-DR tienen reducida su capacidad para presentar antígenos y secretar citoquinas; por lo tanto, la mantención de la expresión de HLA-DR podría ser fundamental para montar una respuesta antibacteriana adecuada y prevenir complicaciones infecciosas.Con esta base se determinó, en un grupo de pacientes, el porcentaje de monocitos, la intensidad media de la fluorescencia de expresión de HLA-DR y el porcentaje de monocitos que expresan HLA-DR, en un estudio cross-over en el que se tomó como controles a donantes de sangre, pacientes en peritoneodiálisis, pacientes en diálisis crónica y pacientes trasplantados. El porcentaje de monocitos disminuyó en los pacientes sépticos y no varió en los demás grupos, y la intensidad media de fluorescencia para la expresión de HLA-DR fue menor en los pacientes sépticos, en comparación con cualquiera de los otros grupos; es decir, hay una situación alterada que, sin embargo, cumple con condiciones similares a los controles en la fase en que el sistema inmune se encuentra silente.
Por último, en los pacientes sépticos se encontró una disminución del porcentaje de monocitos que expresan HLA-DR. En resumen, en la sepsis hay menos monocitos, el porcentaje de ellos que expresan HLA-DR es bajo y la expresión es menor. Se hizo un análisis preliminar de lo que pasa con la intensidad media de fluorescencia para la expresión de HLA-DR y el porcentaje de monocitos cuando se aplica la hemofiltración de volumen pulsátil, y se encontró una diferencia significativa en estos parámetros antes del tratamiento y a las 48 horas de tratamiento. También se estudió el efecto de CPFA y nuevamente aumentó el porcentaje de monocitos que expresan HLA-DR, tres días después.
Resumen
Los datos que se presentaron son preliminares y todavía no se puede extraer conclusiones, pero lo importante es que confirman que la terapia extracorpórea puede entregar más beneficios que los que habitualmente se esperan de ella, ya que, además de tratar la uremia, la sobrehidratación y los trastornos metabólicos, remueve inmunocomplejos, endotoxinas y mediadores proinflamatorios, restituyendo la homeostasis de la respuesta inmune.Se puede decir que un paciente con uremia sobrevive gracias a la diálisis y que hasta ahora no se sabe por qué, pero lo más probable es que se deba a que la terapia modifica el ambiente hostil de la uremia y lo vuelve más fisiológico: lo mismo se aplica a las terapias extracorpóreas en sepsis. Algunos autores discrepan, pero ya son muchos los pacientes que debían haber muerto por sepsis y han sobrevivido gracias a este enfoque.
La hipótesis de los picos de concentración y la idea de la inmunomodulación han contribuido a introducir el concepto de que no es importante remover una o dos moléculas específicas, sino que es más importante restituir al plasma un estado fisiológico que permita que las células hagan su trabajo.

