Congresos
← vista completaPublicado el 1 de septiembre de 2005 | http://doi.org/10.5867/medwave.2005.08.1197
Nuevas estrategias terapéuticas en artritis reumatoídea
New therapeutic strategies in rheumatoid arthritis
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIII Congreso Internacional de Reumatologia, XXV Congreso Chileno, realizado en Las Termas de Chillán entre los días 17 al 20 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Reumatología.
Presidente del Congreso: Dr Carlos Fuentealba.
Secretario Ejecutivo: Dr Francisco Radrigán.
Presidente Comité Cientifico: Dr Miguel Gutiérrez.
Edición Científica: Dr. Francisco Radrigán.
Introducción
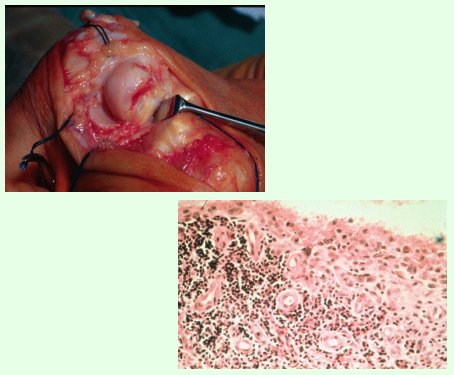
La artritis reumatoídea (AR) es una enfermedad grave, frecuente, heterogénea y potencialmente invalidante, y constituye un problema de Salud Pública. Lo más importante para el médico es manejar los elementos necesarios para hacer el diagnóstico precoz y conocer los nuevos tratamientos que hay en la actualidad, como las bioterapias, que son una verdadera revolución terapéutica. La sinovitis que se desarrolla en las articulaciones destruye el cartílago en esta enfermedad (Figura 1). Es tarea de los médicos detener su avance a tiempo para evitar las secuelas del proceso inflamatorio.
 Tamaño completo
Tamaño completo Figura 1. Sinovitis en artritis reumatoídea.
Impacto y costo de la AR
En Europa se ha determinado el impacto que tiene la AR en el ámbito laboral de los pacientes afectados:
- 50% dejan de trabajar antes de los cinco años;
- rápida invalidez que, en 10% de los casos, aparece antes de los dos años;
- el riesgo de baja laboral se multiplica por 32;
- la frecuencia de incapacidad laboral es 7 veces superior a la de una población de referencia;
- en el estudio PRACTIS, realizado por el equipo que trabaja en Francia, en el que participaron 1109 pacientes con AR, se comprobó una incapacidad total y definitiva en 19, 2% de los afectados, a la edad de 45 años;
- disminución de los ingresos económicos hasta de 50%.
A lo anterior se suma el hecho de que el costo de la enfermedad es elevadísimo:
- el costo anual en Francia es de 5,7 a 7,1 mil millones de euros;
- el costo medio anual, en 12 estudios, se desglosa en costo directo (5.425 euros), costo indirecto (9.744 euros) y costo total (15.169 euros);
- el costo medio es de 10.671 euros;
- el costo durante toda la vida es de 66.081 euros;
- la variación HAQ de 1 punto en 2 años cuesta 5.388 euros, en 10 años, 14.802 euros; o sea, los pacientes mejoran levemente su calidad de vida, medida por la escala HAQ, con un costo de 5.000 a 14.000 euros, en 10 años de tratamiento con terapia anti-TNF.
Importancia del diagnóstico y tratamiento precoz
Es preciso insistir en la importancia del diagnóstico precoz y en los beneficios de un tratamiento temprano eficaz, entre ellos la disminución de la mortalidad (sobre todo con el metotrexato), la mejoría de la calidad de vida y la interrupción de la evolución radiológica (máxima durante los tres primeros años), lo que se ha logrado recientemente gracias a las nuevas terapias anti-TNF. No hay que olvidar, sin embargo, que el mayor beneficio se obtendrá si se inicia la terapia en los tres a cuatro primeros meses de la enfermedad, porque en ese momento las lesiones todavía no son irreversibles.
Se ha demostrado que, cuanto menos tiempo haya transcurrido entre el inicio de los síntomas y el comienzo del tratamiento, tanto mejor será la calidad de vida a los 5 años (Silman, 2002); que, al principio de la enfermedad, el paciente se ve limitado por la inflamación de sus articulaciones, pero cuando lleva más tiempo con la patología, su incapacidad se debe más a las secuelas osteoarticulares que ella va dejando (Kirwan J. J Rheumatol 1999; 26 : 720-5); y que los pacientes que inician tratamiento antes de los seis meses tienen menor grado de Larsen, a los 5 años, que los que llevan 12 meses o más de evolución de su enfermedad (Silman, 2002).
Entonces, el tratamiento debe ser precoz, para lograr la remisión o interrupción de la evolución; la terapia es global y multidisciplinaria; y las indicaciones dependen de los datos clínicos y los factores pronósticos, respecto de los cuales no todos los reumatólogos están de acuerdo, pero los más importantes están claros y son los siguientes, con acento en los elementos clínicos:
- comienzo agudo poliarticular
- manifestaciones extra-articulares (nódulos, vascularitis, compromiso visceral)
- índice de calidad de vida (HAQ); un HAQ elevado significa enfermedad grave
- erosiones óseas y cartilaginosas tempranas
- VHS y PCR muy elevadas
- Factor Reumatoide elevado al inicio de la enfermedad (es de mal pronóstico)
- presencia de genes DR1, DR4 homocigóticos.
El tratamiento precoz es importante para detener y revertir la inflamación, y se debe tener en cuenta que la red de apoyo de estos pacientes se compone no sólo de los médicos, sino de muchas otras personas que no siempre pertenecen al ámbito de la salud. Por eso es importante realizar reuniones multidisciplinarias para evaluar las condiciones del paciente, con el objetivo de diseñar una terapia a la carta, individualizada, que evite el daño definitivo de las articulaciones, logre que el paciente se integre a la sociedad, continúe la actividad laboral e informe al paciente. Este último punto es importante, porque es poco frecuente que los médicos se den el tiempo para explicarle al paciente su estado; por eso, en el equipo de profesionales debe haber psiquiatras que apoyen al enfermo.
En cuanto al tratamiento farmacológico, habrá fármacos tanto para los síntomas generales como para las molestias locales y es fundamental que todo paciente tenga derecho a la rehabilitación funcional. Además, de vez en cuando habrá que recurrir a la cirugía.
Historia de la AR
- En el año 1929, Forestier descubrió las sales de oro;
- en 1950 Hench descubrió la cortisona;
- en 1960 comenzaron las cirugías y las artroplastías;
- en 1980 se descubrió el metotrexato, primer fármaco eficaz para el tratamiento de la AR;
- la primera utilización del tratamiento con anti-TNF alfa data de 1993, cuando comenzó la revolución terapéutica.
Los principales tratamientos de fondo son las terapias ya conocidas: sales de oro (Allochrysine), antipalúdicos (Plaquenil, Nivaquina), salazopirina, derivados tiólicos (Trolovol, Acadione), ciclosporina A (Neoral). Por otro lado, están las nuevas terapias, partiendo por el metotrexato IM o por vía oral (Novatrex), la leflunomida (Arava), los agentes anti-TNFalfa: Remicade (perfusión), Enbrel (subcutáneo) y Humira (subcutáneo), y finalmente, el agente anti-IL1 Kineret (subcutáneo), que tal vez no se encuentre en Chile todavía.
Los elementos terapéuticos necesarios en todos los pacientes con AR son: la adecuada entrega de información y educación para el paciente y su familia; los analgésicos; los antiinflamatorios; casi siempre; la rehabilitación o fisioterapia; y, a veces, los tratamientos locales.
Corticoterapia en la AR
En general, se debe utilizar dosis bajas y preferir fármacos de acción corta, que en Chile son la prednisona y la prednisolona (10 mg/día en una sola dosis matinal). No se debe reducir ni suspender bruscamente los tratamientos, siempre hay que hacerlo en forma progresiva (1 mg/mes). Se debe evitar los sobresaltos cortisónicos y la corticoterapia IM (sobre todo de acción lenta). A veces se puede necesitar bolos de altas dosis de Solumedrol endovenoso.
Los tratamientos de fondo son necesarios casi siempre y cabe recordar que todos tienen reacciones adversas Se debe dar esta información al paciente y controlar la evolución clínica en forma regular y prolongada. La mayoría de los efectos adversos ocurren durante los 18 primeros meses de tratamiento y son de duración variable, pero generalmente larga, desde varias semanas hasta 3 meses. También hay que estar atento a falla del tratamiento, hay que saber cuánto demora cada uno en comenzar a actuar y saber cuándo es necesario cambiar de terapia.
Criterios para elegir el tratamiento en la AR
Para elegir el tratamiento de fondo en un paciente con AR de comienzo reciente, se debe considerar los siguientes elementos:
- el estado inflamatorio de las articulaciones (magnitud de la inflamación);
- la presencia de factores predictivos de gravedad;
- la relación beneficio/riesgo del fármaco (por ejemplo, el tratamiento TNF es riesgoso, pero es de gran utilidad cuando las otras terapias no funcionan);
- el tipo de paciente.
Sin embargo, no hay que olvidar que la eficacia de los tratamientos de fondo sobre las lesiones estructurales es escasa o nula; puede que exista para el metotrexato y la leflunomida. Lo que sí está demostrado es la eficacia de las bioterapias con anti-TNFalfa y anti-IL1.
En el caso de la AR poco activa, en que la patología no tiene mal pronóstico y hay poca o moderada expresión clínica, se puede utilizar tratamientos de fondo antiguos, como las sales de oro, la hidroxicloroquina (HCQ) y la salazopirina (SZP). En el caso de las AR activas, sean o no de diagnóstico reciente (se les llama activas en cuanto a la expresión clínica de la enfermedad), se debe evaluar la presencia de factores pronósticos peyorativos y de erosiones, ambos factores que indicarán la necesidad de iniciar precozmente el tratamiento.
El tratamiento consiste en metotrexato (MTX) intramuscular, 10 a 15 mg/día, generalmente asociado con corticoides, en dosis de 10 a 15mg/día. Cuando existe fracaso o intolerancia al tratamiento con MTX, se puede aumentar las dosis y pasarlo a vía oral. En Francia se aumenta la dosis hasta 20 mg diarios. También se podría cambiar a leflunomide, pero la tolerancia oral no es buena y los pacientes lo discontinúan; o bien hacer combinaciones terapéuticas como la asociación MTX + SZP + HCQ. Si es posible, se utiliza la bioterapia.
En cuanto a las combinaciones terapéuticas, en un estudio de Korpela se comparó dos estrategias de tratamiento en 160 pacientes con AR recientes, de menos de dos años de evolución, que eran SZP o asociación MTX + SZP + HCQ, y se observó mayor respuesta a tratamiento con la terapia combinada: a los 2 años hubo una remisión de 40% en el grupo combinado y de 18% en el grupo con monoterapia, cifras que a los 5 años fueron de 28% y 22%, respectivamente (Arthritis and Rheumatism 2004,50,2072-2081).
El estudio TICORA (TIght COntrol in Rheumatoid Arthritis), igual que otros, demostró que debemos seguir al enfermo con datos precisos y con un sistema de score europeo, que es el DAS 28. En este estudio, dos grupos de pacientes con AR activa y reciente (20 meses), con DAS de 4,8, recibieron tratamiento en forma aleatoria, por 18 meses, con estrategia de rutina o estrategia intensiva tipo set up, que se reevaluó todos los meses según el DAS.
Después de 3 meses, el DAS era de 2,7 (estrategia intensiva) contra 3,7 (estrategia de rutina) y a los 18 meses los DAS eran 1,4 y 2,7, respectivamente. Esto es interesante, porque el reumatólogo se da cuenta que el DAS 28 está en 6 y piensa que debe cambiar de tratamiento, porque el paciente está mal. En Francia no es lo habitual, por lo general se espera un poco, pero eso termina por dañar mucho al paciente; si el score sale mal, el médico debe cambiar la terapia. Además, se observó que 67% de los pacientes con AR y con tratamiento intensivo respondían a los criterios ACR 70, versus 18% de los pacientes con tratamiento de rutina.
El estudio BEST (BEst STrategy) es un estudio muy complejo, en el que se comparó cuatro tipos de estrategia en pacientes con AR de 23 semanas:
- monoterapia secuencial, con MTX 1/5 y 25mg, reemplazado por SZP y por Leflunomida; estrategia aditiva step up: MTX asociado con SZP y HCQ;
- combinación de MTX 7,5 mg + SZP + prednisona 60 mg/día, disminuida hasta 7,5 mg/día, se puede reemplazar SZP con ciclosporina;
- tratamiento anti TNF (Infliximab 3 mg/kg) combinado con MTX 25 mg/semana.
La regla era pasar de un escalón de reducción a otro según el DAS 44: al escalón superior si el DAS 44 era mayor de 2,4, o al escalón inferior si era menor de 2,4 durante más de 6 meses. Los resultados demostraron lo siguiente:
- Tras un año de tratamiento, se demostró la eficacia de las estrategias intensivas: step down MTX + infliximab (AR recientes sin tratamiento de fondo anterior), DAS 44, HAQ y Sharp modificado más bajos.
- Después de 3 meses, la remisión con DAS 44 menor de 2,4 fue de 55% con step down; 47% con MTX+ infliximab; 17% con monoterapia ; 19% con set up.
- Hubo nivelación del efecto en los dos grupos al año.
Por último, en el estudio COBRA, que consistió en la comparación de la SZP sola con el step down, asociando corticoides (60 mg reducidos por pequeños decrementos en 28 semanas) + MTX (40 semanas) y SZP (2g/día), en AR iniciales, con menos de dos años de evolución, se comprobó que, tras un año de tratamiento, el DAS 28 y el Sharp fueron menores: mejores en el grupo de combinación terapéutica. Tras 5 años de tratamiento hubo una progressión radiológica comparable, un grado más bajo en el grupo tratado con step down.
En conclusión, todos estos trabajos comprueban que cuando la monoterapia falla, es posible combinar las drogas. Lo anterior, sin embargo, está cambiando: en el caso de una AR activa y erosiva, en la que el enfermo no está bien, es posible mantener el MTX y comenzar bioterapia con Remicade, Humira o Kineret ; o bien, se puede suspender MTX y tratar con Enbrel o, eventualmente, Humira. En Francia, afortunadamente, se encuentran todos estos fármacos. Kineret es un anti IL-1, pero es menos potente que los anti-TNF alfa; Enbrel, en mi opinión, es el medicamento más potente y barato disponible. Se puede usar también el Humira sin MTX, pero la potencia del Humira es mucho menor que la del Enbrel cuando se usa solo. Es posible asociar al inicio el MTX al Enbrel. No hay esquemas fijos.
Bioterapias
Anti-TNF alfa:
- Anticuerpos monoclonales: Remicade se administra por perfusión endovenosa en dosis de 3 mg/kg D0, D15, D45 cada 2 meses. Es un fármaco hospitalario, cuyo costo es de al menos 15.000 euros/año. También existe Humira, que se administra por inyección subcutánea, 1 inyección de 40 mg cada 15 días o a la semana, lo que permite tratamiento ambulatorio. El costo es de 17.000 euros/año.
- Receptores solubles: Enbrel, se administra por inyección subcutánea, 2 inyecciones de 25 mg a la semana, tratamiento ambulatorio, disponible en farmacia. El costo es de 15.000 euros/año. Es el único producto utilizable en el niño.
Anti-IL1:
Kineret, que impide la transmisión de la señal a la célula, se administra por inyección subcutánea, 1 inyección/día de 100 mg. El costo es de 11.694 euros/año.
Antes de iniciar la terapia se debe informar al enfermo; verificar las contraindicaciones; hacer una prueba de tuberculina, porque el tratamiento con anticuerpos puede desencadenar el cuadro de TBC; radiografía de tórax, dental y de muñecas, manos y pies, para hacer un seguimiento.
En Francia, la administración de estos medicamentos constituye una indicación de hospitalización; o sea, la prescripción inicial es hospitalaria, por un reumatólogo, para 6 meses, y se realiza seguimiento como sigue:
- control clínico mensual;
- no hay normas para el control biológico, pero cada 2 ó 3 meses se mide VHS, PCR, transaminasas, creatininemia, hemograma;
- anticuerpos antinucleares y anti ADN cada seis meses;
- si aparece fiebre, se debe interrumpir la bioterapia; tratar la infección; reanudar la bioterapia después de curación; en caso de infección grave, suspensión definitiva de la bioterapia;
- si el paciente presenta alguna patología agregada, se debe detener el tratamiento de inmediato y evaluar si se continúa o no, según la patología. Por ejemplo, Enbre tiene vida muy corta; si se mide sus niveles 15 días después de suspender el tratamiento, ya no se encuentra en la sangre; Remicade y Humira, en cambio, permanecen durante 60 días;
- durante estos tratamientos los pacientes no pueden recibir vacunas vivas o atenuadas.
En el caso particular de un paciente con AR que se encuentra bien, estabilizado en el plano clínico y biológico, pero cuyas radiografías indican progresión de las lesiones, se debe indicar una bioterapia; por ejemplo, Enbrel más MTX, porque con eso es posible detener la progresión radiográfica. En el caso de AR con vasculitis se utiliza bolos de corticoides, endoxan IV y, de vez en cuando, refliximab; es un anticuerpo anti linfocito B que puede dar resultados extraordinarios en casos de vasculitis que no responden a cicofosfamida. Cuando es una AR antigua y sin actividad en el momento, el tratamiento de fondo no es necesario, sólo los analgésicos, los AINES y el tratamiento con corticoides. La terapia de rehabilitación es muy importante y puede ser necesaria la cirugía.
En Francia hay una red de AR, la red Polyarthrite-Rhumatoïde Languedoc Roussillon (red PR-LR), que está constituída por los reumatólogos y más de 700 pacientes. Es muy interesante, porque facilita el seguimiento de los pacientes y permite lograr diversos objetivos:
- reunión de todos los participantes de la terapia global;
- diagnóstico y tratamiento precoces de la AR;
- acceso a las nuevas bioterapias;
- formación médica continua;
- estudios médico-económicos;
- un sistema coherente, basado en el voluntariado, construido en torno al paciente;
- una nueva manera de ejercer la medicina.
Otras bioterapias
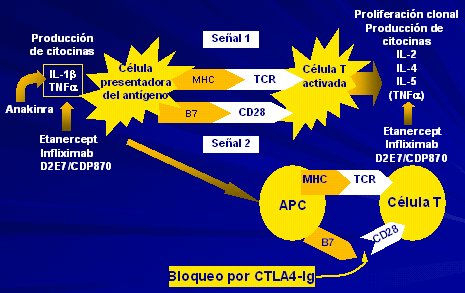
- La CTLA4 Ig origina un bloqueo en la segunda señal de la respuesta inmunitaria (CD28-B7) y es una droga muy interesante, que se puede asociar con el Etanercept y da muy buenos resultados (Figura 2).
- El anticuerpo monoclonal anti-linfocito B (anti – CD20), que se usa como tratamiento del linfoma. En Francia, se llama Refliximab o Maptera.
- El anticuerpo anti-receptor de la Il-6, que todavía está en etapa de prueba.
- Los fármacos del futuro inhiben las vías de la señalización; entre ellos, NF kappa B, MAP kinasas (p38). Tienen problemas de tolerancia.
 Tamaño completo
Tamaño completo Figura 2. Tratamiento de la AR: CTLA4-Ig: inhibición de la activación del linfocito (TACR 2002 - Kremer, 463).
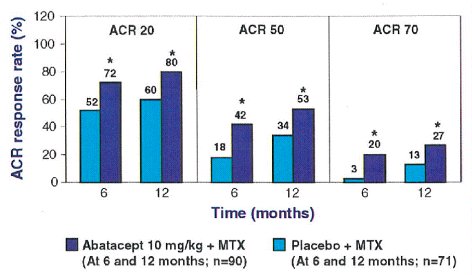
Se obtienen respuestas hasta de 80% en ACR 20, 53% en ACR 50, en un estudio controlado y doble ciego, con la asociación de Abatacep con MTX (Figura 3).
 Tamaño completo
Tamaño completo Figura 3. Respuestas ACR 20, 50, a los 6 y 12 meses, con Abatacept + MTX versus placebo + MTX (* = p menor de 0.05).
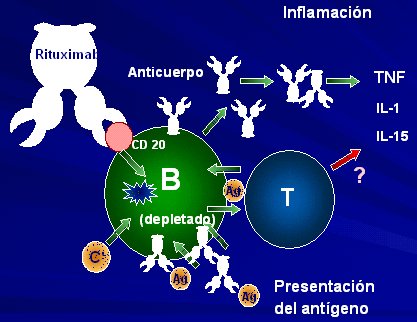
El anticuerpo anti-CD20 Rituximab va a bloquear a los linfocitos B, tal como se ilustra en la Figura 4.
 Tamaño completo
Tamaño completo Figura 4. Tratamiento de la AR: Rituximab = anticuerpo monoclonal anti-CD 20 de los linfocitos B.
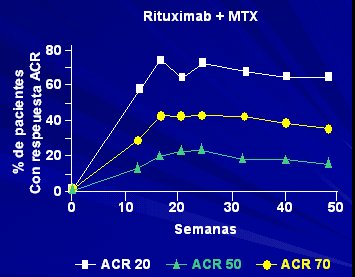
En un estudio sobre la eficacia de los anticuerpos anti-CD20, a las 48 semanas, en AR activas (DAS = 6,9) con fracaso de DMARD, se administró Rituximab 2 x 1 g i.v. en 15 días + MTX o CYC: luego se determinó la eficacia a los 6 meses en los grupos rituximab + MTX y rituximab + CYC, y el mantenimiento de la respuesta clínica a las 48 semanas del tratamiento inicial (n = 40 en cada grupo). La respuesta fue muy buena, con más de 65% de respuesta a ACR 20 (Figura 5).
En la asociación con MTX, en 83% de los pacientes hubo una excelente respuesta; la tolerancia y las infecciones fueron iguales en ambos grupos. A los pocos días la curva de los linfocitos B cae en forma vertical y se mantiene baja durante algunos meses sin efectos secundarios, y el factor reumatoídeo baja mucho. Lo interesante de este fármaco es que con cuatro inyecciones produce remisión por un año y medio, a diferencia de los anti-TNF, cuya suspensión por poco tiempo suele generar una recaída de la enfermedad.
 Tamaño completo
Tamaño completo Figura 5. Tratamiento de la AR con anticuerpo anti-CD 20: eficacia a las 48 semanas.
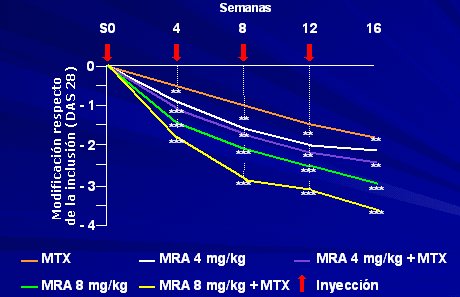
Por último, en la curva del DAS 28 para el anti-IL6 MRA (Figura 6) se observa que 78% de los pacientes tienen respuesta ACR 20, aunque hay algunos problemas, como la mala tolerancia y las infecciones.
 Tamaño completo
Tamaño completo Figura 6. Terapéutica de la AR con anti-IL-6 (MRA). Eficacia según evolución del DAS 28 (Estudio CHARISMA. Nishimoto et al., Arthr Rheum, 2004,50,1761).
Conclusiones
- Hay una necesidad real de diagnóstico y tratamiento precoces de la enfermedad; no hay que esperar que el paciente sufra todos los síntomas y se vea mal para comenzar la terapia.
- Hoy tenemos la posibilidad de frenar la evolución clínica, biológica y radiológica con las nuevas terapias.
- Con la terapia anti-TNF ya se ha obtenido excelentes resultados.
- Es imperativo seguir a los pacientes con regularidad, con datos objetivos como el score de actividad.
- Se debe ir adaptando el tratamiento a cada caso separado y evitar el inmovilismo terapéutico. Si el paciente no responde bien a una de las terapias, habrá que evaluar el mejor tratamiento para ese paciente en particular.

