Congresos
← vista completaPublicado el 1 de abril de 2003 | http://doi.org/10.5867/medwave.2003.03.693
Fisiopatología: coagulopatía e injuria endotelial en la sepsis
Pathophysiology: coagulopathy and endothelial injury in sepsis
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso de Medicina Intensiva de América del Sur, Simposio Eli Lilly: Nuevas Alternativas en el Manejo de la Sepsis, realizado en Iquique el día 18 de octubre de 2002.
Presidente de Sala: Dr. Alberto Dougnac.
Secretario de Sala: Dr. Sergio Gálvez.
Introducción
Sabemos que el paciente séptico presenta inflamación y coagulación de grado variable, desde pequeños depósitos de trombina y fibrina en la circulación hasta coagulación intravascular diseminada y consumo de factores de coagulación. El depósito de fibrina en la microcirculación genera la presencia de disfunción simultánea en múltiples órganos, inducida por la sepsis, inflamación, consumo de factores de coagulación, y con esto predispone a sangrados espontáneos y a coagulopatía secundaria a sepsis.
La cascada de la coagulación, hasta hace algunos años, se dividía didácticamente en dos: vía extrínseca y vía intrínseca. La vía extrínseca era clásicamente la causa de la coagulación inducida por una lesión endotelial. En la sepsis, los productos bacterianos y la activación de las células endoteliales, leucocitos y polimorfonucleares producen la expresión del factor tisular en el endotelio, sin una lesión obvia en éste; se induce coagulación intravascular debido al aumento de la expresión del factor tisular y se forma trombina, que es el elemento clave en la inflamación asociada con coagulación.
Importancia de la trombina en sepsis
La función de la trombina es detener el sangrado y producir la formación del coágulo de fibrina. Diversos mecanismos protegen de la formación excesiva de trombina: fibrinolisis endógena, diversos anticoagulantes como la antitrombina III, proteína C, que impiden que la trombina quede limitada en su función. En la sepsis, tanto el exceso de formación de factor tisular como la interacción con los leucocitos, plaquetas y la disfunción endotelial que se produce cuando existe depósito de fibrina a nivel del endotelio, llevan a la formación de grandes cantidades de trombina.
La trombina es el elemento clave porque es el inicio de múltiples reacciones que culminan con coagulación e inflamación. La trombina induce activación leucocitaria, produce quimiotaxis, activa macrófagos, altera la permeabilidad endotelial, disminuye los niveles fisiológicos de antitrombina III, por consumo o por activación de los leucocitos, y de esta forma, al no existir este anticoagulante natural, más cantidad de trombina ejerce su acción inflamatoria y procoagulante. La relación entre trombina y plaquetas en los productos plaquetarios activados es importante para la coagulación e inflamación. Debido a las células endoteliales activadas por las citoquinas inflamatorias liberadas desde los monocitos y células endoteliales, todos esos factores causan las alteraciones microcirculatorias que se producen en la sepsis.
La unión de trombina a trombomodulina produce la activación de la proteína C. La proteína C activada tiene un papel fundamental, junto a la antitrombina III, en disminuir la formación de trombina. Además ayuda en la activación de la fibrinolisis para compensar los efectos de la excesiva cantidad de trombina circulante.
En la sepsis disminuyen los niveles de trombomodulina, la que no se sintetiza normalmente por acción de la célula endotelial; la proteína C no se puede activar y así la trombina actúa sin retroalimentación negativa en las cascadas de inflamación y coagulación, e impide la fibrinolisis.
Proteína C y sepsis
En la Figura 1 se muestra una imagen representativa de un trabajo sobre proteína C, publicado en el NEJM(1), se esquematiza que bacterias, virus, hongos, parásitos y endotoxinas inducen respuestas semejantes en los monocitos y causan liberación de citoquinas inflamatorias desde la célula endotelial. Además, otros estímulos como hipoxia, hipotensión prolongada, trauma tisular, producen respuestas similares. Los factores tisulares se expresan con inicio de coagulación e inflamación debido a la liberación masiva de citoquinas inflamatorias; en consecuencia, la trombomodulina disminuye, se une a la trombina para disminuir los efectos de ésta por activación de proteína C; por tanto, la trombomodulina es necesaria para que, al unirse a la trombina, active la proteína C que protege de la trombosis e inflamación excesiva; por tanto, la proteína C activada por la trombina unida a trombomodulina controla varios pasos de la coagulación; también previene la inflamación excesiva que ocurre por activación generalizada de la coagulación. La proteína C puede inactivar factores que inhiben la fibrinolisis, porque la trombina actúa para que se forme el coágulo de fibrina; hay una inhibición natural de la fibrinolisis, debido a que en la sepsis los factores inhibidores del plasminógeno están muy aumentados por la acción de las citoquinas inflamatorias que alteran la función endotelial.
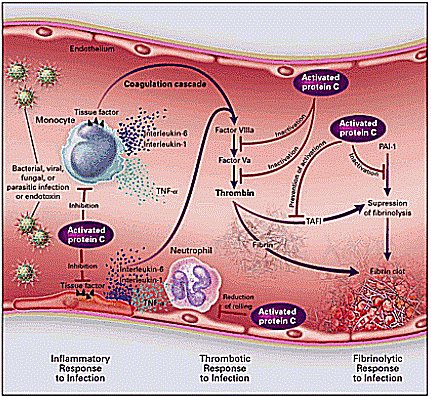 Tamaño completo
Tamaño completo Figura 1.
La función endotelial normal acompaña a un endotelio saludable que sintetiza trombomodulina y ésta, junto con la trombina, activa la proteína C. Los niveles normales de proteína C activada varían de 4.000 a 5.000; en la sepsis se transforman en 1 a 3 ng/ml, se produce una importante disminución de esta proteína (Figura 2). En una enfermedad que no presente los factores de disfunción endotelial que se describen a continuación, la proteína C se activa y ejerce su función controladora de la inflamación y coagulación. Es importante tener buena coagulación e inflamación, pero en la sepsis ocurre una disfunción endotelial generalizada, debido a la liberación masiva de citoquinas desde los monocitos y leucocitos; los niveles de proteína C y de antitrombina III disminuyen, la trombomodulina no se sintetiza adecuadamente porque el endotelio está inflamado, no sube la proteína C y, en consecuencia, la trombina queda desrregulada en sus funciones y se muestra más procoagulante, proinflamatoria y antifibrinolítica (Figura 3).
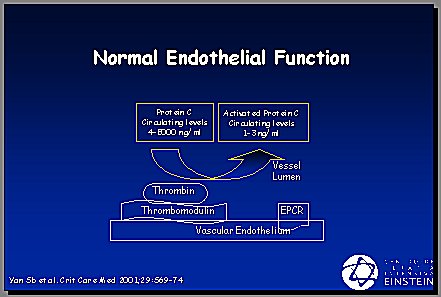 Tamaño completo
Tamaño completo Figura 2. Función endotelial normal.
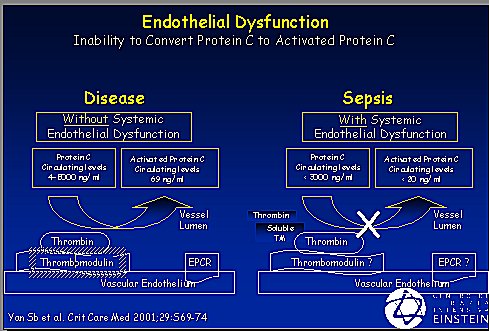 Tamaño completo
Tamaño completo Figura 3. Disfunción endotelial.
Las células sanguíneas, como plaquetas, monocitos, neutrófilos, se alteran profundamente con la liberación de citoquinas y con el ambiente procoagulante que induce la sepsis. En la microcirculación, estos elementos de la sangre entran en íntimo contacto con el endotelio, donde se traduce la inflamación descontrolada de la sepsis. Los mastocitos están fuera de la circulación, muy íntimamente ligados, y producen gran cantidad de citoquinas. Las citoquinas inflamatorias, el endotelio activado por la sepsis y los productos bacterianos activan la función de los leucocitos y generan la expresión de selectinas e integrinas por parte de las células endoteliales; así se causa movilización leucocitaria, quimiotaxis, mayor producción de radicales libres de oxígeno y condiciones favorables para el proceso inflamatorio y coagulación local.
Activación leucocitaria
El leucocito posee una cola, una cabeza y pseudópodos que lo dirigen hacia el lugar del estímulo, donde el endotelio está activado; una vez allí, la forma del leucocito se altera para que quede privado de movilidad y pueda ejercer sus funciones. Esto se observa, por ejemplo, en una preparación con leucotrienos liberados en sepsis que produce vasodilatación y activación leucocitaria.
La mayoría de los episodios que ocurren en la microcirculación ocurren en el lado venular. Con el estímulo endotelial se produce adhesión de leucocitos; las células endoteliales son más permeables y la inducción de los leucotrienos causa una alteración significativa en la tonicidad de los vasos en la sepsis. Cuando el flujo microcirculatorio es normal, los leucocitos se van al centro de la corriente sanguínea debido a la presencia de un flujo laminar; cuando hay vasodilatación y se produce el estímulo de las células endoteliales, los leucocitos se aproximan a la superficie endotelial y empiezan a adherirse (Figura 4).
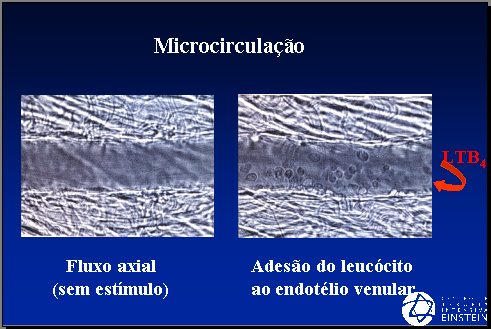 Tamaño completo
Tamaño completo Figura 4. Microcirculación.
Ocurre una agregación de los leucocitos adheridos a la membrana de la célula endotelial, unión de los polimorfonucleares entre sí y su transmigración en la célula endotelial. Los mismos estímulos que producen el proceso inflamatorio generan a su vez la coagulación.
Disfunción energética celular
Un esquema de 1985 (Figura 5) señala que la función circulatoria del organismo permite que lo que se oxigenó en los pulmones pase, con el débito cardíaco, a los tejidos; éstos utilizan el oxigeno que necesitan para sobrevivir y devuelven al pulmón cerca de 75% del oxígeno que recibieron. Esta es la única reserva de oxígeno disponible en nuestro organismo, es decir, si hay disminución del débito cardíaco, si hay disfunción tisular, el aumento de la extracción de oxígeno es el único mecanismo para intentar mantener la viabilidad celular. Se observa una disminución en la oferta de oxígeno al tejido, éste sobrevive a expensas de una extracción mayor, hasta un punto en que el consumo disminuye y ocurre acidosis láctica con una producción muy disminuida de ATP. En presencia de oxígeno se producen cantidades normales de ATP.
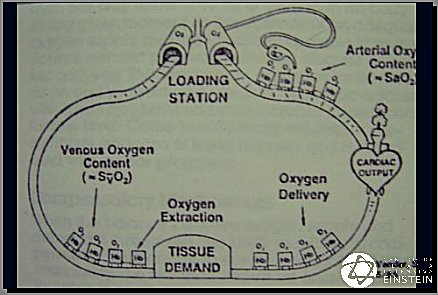 Tamaño completo
Tamaño completo Figura 5. Función circulatoria.
Estos cambios ocurren en la microcirculación, en todos los órganos. Es muy importante el concepto de disfunción energética celular, cuando la disminución del nivel de ATP no puede mantener las funciones celulares básicas. Por ejemplo, en la disfunción precoz de la bomba sodio-potasio ATPasa, el sodio tiende a volver hacia el interior de la célula porque no hay ATP que permita mantener la gradiente. Si esta situación se prolonga, hay destrucción de organelos, el calcio ingresa al citosol, y puede ocurrir la muerte celular.
En presencia de estos cambios, el endotelio se inflama, el sodio permanece dentro de la célula, disminuye la luz de la microcirculación, la célula está edematizada, hay edematización proteica y cambios de conformación, se activa la inflamación, hay activación leucocitaria y predisposición a la agregación celular y coagulación. La disminución del aporte de oxígeno puede generar este cuadro microcirculatorio diseminado en todos los órganos de la economía.
En la sepsis, los fenómenos de inflamación y disfunción endotelial son primarios, debido a la acción de toxinas y citoquinas proinflamatorias. En el shock cardiogénico, en el shock hipovolémico, estos fenómenos son secundarios, pero se comportan de manera muy similar y por eso es de vital importancia que el paciente séptico presente volemia, función cardiológica y hemodinámica optimizada para minimizar los efectos secundarios en la microcirculación. Cuando lo anterior evoluciona a la perfección, se puede agregar moléculas específicas para tratar la sepsis y utilizar las nuevas terapias, pero de nada sirven si no se ofrece oxígeno suficiente.
El esquema de 1985 no tomó en cuenta la presencia del intestino. Cuando disminuye el débito cardíaco hay una redistribución de flujo xacia cerebro y corazón. En cuanto a la distribución del débito cardíaco en reposo, una gran parte va al riñón, pero sin gran consumo de oxígeno. La naturaleza es extremadamente sabia al desviar el flujo intestinal y hepático cuando disminuye el débito, porque no sólo gran parte de la oferta se necesita en corazón y cerebro, sino que, además, en la zona hepatoesplénica, el consumo de oxígeno es muy grande, la síntesis de proteínas hepáticas también; es, pues, importante, en aquellas situaciones en que el débito cardíaco es insuficiente, que el flujo se desvíe de un territorio que necesita mucho oxígeno. Tanto el hígado -órgano importante para la coagulación debido a la síntesis de antitrombina III y proteína C- como el intestino, presentan una rica inervación simpática. En los fenómenos sépticos, la circulación intestinal está muy comprometida, principalmente en las vellosidades intestinales, que son las primeras en quedar sin flujo en casos de inestabilidad y las últimas en restablecerse con el tratamiento. El intestino es muy importante en la respuesta séptica, en la activación endotelial de la sepsis y en la perpetuación de las citoquinas inflamatorias.
Hipoxia intestinal
En la vellosidad intestinal, el oxígeno arterial pasa directamente a la vena (Figura 6). La extremidad de la vellosidad intestinal presenta una presión parcial de oxígeno de 30 a 40 mm Hg, en situación normal, pero, en casos de sepsis o de bajo débito cardíaco por otra causa, su compromiso es muy importante. El intestino presenta gran cantidad de xantina oxidasa, la que exacerba la producción de radicales libres de oxígeno, en estos casos, cuando la isquemia y reperfusión intestinales son muy importantes.
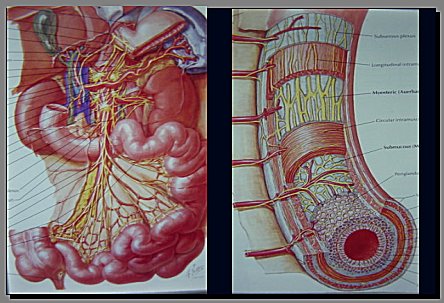 Tamaño completo
Tamaño completo Figura 6.
Territorio hepatoesplénico
El territorio hepatoesplénico sufre gran parte de los efectos inducidos por la sepsis, que las citoquinas realizan en su extensa microcirculación; una vez que ésta se encuentra comprometida, los productos, las citoquinas, la activación linfocitaria van a corresponder a un órgano fundamental en la producción de los elementos que protegen de la inflamación generalizada; pero el hígado tiene gran cantidad de receptores alfa y es muy propenso a la vasoconstricción en la inestabilidad hemodinámica, por lo que la sangre que vuelve del territorio hepatoesplénico presenta alteraciones semejantes a las del shock séptico. El desvío del flujo sanguíneo en el shock hipovolémico salva vidas, excepto cuando hay hipotensión persistente, en cuyo caso la microcirculación hepática se comportará secundariamente, de una forma parecida a como actúa en la sepsis.
Trauma y respuesta inflamatoria
Diversos traumas inducen una respuesta inflamatoria muy precoz, sin necesidad de la presencia bacteriana. Los factores tisulares, la disfunción microcirculatoria, por sí solos son capaces de producir citoquinas, interactuar con todos los mecanismos de coagulación y producir compromiso de la fibrinolisis.
En el caso del paciente quemado, en el minuto cero empieza una gran respuesta inflamatoria, con presencia de coagulación en la microcirculación, consumo de factores de coagulación, una respuesta semejante a la que presentaría si estuviese infectado.
Ciertas situaciones producen profundas alteraciones, tanto de radicales libres, isquemia, reperfusión celular y disfunción endotelial, las que se pueden controlar muy bien, como es el caso de la cirugía de aneurisma tóracoabdominal, procedimiento extenso en el que existe anticoagulación y pérdida sanguínea; pero si las condiciones hemodinámicas y la oferta de oxígeno celular se mantienen y no se produce hipotensión descontrolada, los pacientes evolucionan muy bien, sin disfunción de órganos. En cambio, si hay rotura de un aneurisma aórtico, con pérdida sanguínea escasa, pero con disfunción endotelial inducida por la redistribución del flujo, ocurre lo mismo que en la sepsis, pero sin bacterias, y se produce disfunción endotelial generalizada y de múltiples órganos.
Por lo tanto, para lograr que la microcirculación de los diversos órganos se produzca de una manera natural, adecuada, la inflamación es necesaria, la coagulación es muy importante. Es de capital importancia que el tratamiento del paciente crítico sea óptimo en hemodinamia, reposición de volemia y antibioticoterapia.
Una vez que la formación de trombina dentro de la microcirculación se descontrola, cuando se ha utilizado de todo, queda espacio para que las nuevas terapias ayuden a minimizar las consecuencias de la coagulación activada y de la disfunción endotelial en los procesos inflamatorios.
Cabe recalcar lo siguiente:
- la sepsis es muy compleja;
- las terapias actuales están hechas para obtener resultados impresionantes Ellas han surgido de nuevas posibilidades, al estudiar desde los mecanismos más básicos. Ese es el secreto de las nuevas terapias: que trabajan con la microcirculación como un todo, con la función endotelial y no sólo con una molécula específica. Es necesario trabajar con un enfoque generalizado para disminuir la incidencia de disfunción multiorgánica y la mortalidad relacionada con sepsis.

