Cursos
← vista completaPublicado el 1 de octubre de 2005 | http://doi.org/10.5867/medwave.2005.09.3211
Manejo nutricional de la obesidad y sus comorbilidades
Nutritional management of obesity and its comorbidities
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso de Educación Continua en Obesidad, organizado en Santiago por la Sociedad Chilena de Obesidad desde el 13 de abril al 15 de junio de 2005.
Director del Curso: Dr. Alex Valenzuela
Obesidad: dieta y metabolismo
La mayor parte de la información relativa a obesidad, dieta y metabolismo ya está publicada. Es tan importante conocer los aspectos celulares y metabólicos como saber aplicar este conocimiento. A continuación se analiza las bases de la orientación terapéutica de la dieta en la obesidad y sus alteraciones metabólicas, con la finalidad de conocer el fundamento subyacente.
La dieta es sólo un componente modulador del metabolismo; desde el momento en que el sujeto ingiere un alimento comienza a haber cambios, los que surgen desde una situación aprendida, condicionada por la dieta anterior y por la situación nutricional previa, pero también por la condición aguda en el momento de la ingesta. El concepto de energía metabolizable significa que los nutrientes no son equivalentes, sino que presentan diferencias en cuanto a su absorción y metabolización, desde el momento en que ingresan al tracto digestivo:
- En las grasas y los hidratos de carbono la absorción es elevada; en las proteínas es más baja particularmente en las de origen animal.
- 16% a 20% de la energía de las proteínas se pierde por la orina en forma de urea; en consecuencia, las proteínas no tienen un factor de 5,3 calorías/g, como sería lo obtenido por combustión directa, sino de 4 calorías/g, porque no se absorben ni se utilizan en 100%.
- La pérdida nitrogenada ocurre cuando la proteína se utiliza dentro del ciclo de la urea con fines energéticos; esta pérdida se puede manipular, en términos de disminuir la cantidad de proteína que va al pool de intercambio y a la producción de urea.
Las pérdidas por metabolismo ocurren por condiciones que dependen de las vías metabólicas que siguen los distintos sustratos; cada uno de ellos puede seguir vías metabólicas diversas. La glucosa puede seguir la ruta de la oxidación o depósito (con pérdida de sólo 2% a 5% de la energía) o de la transformación en ácidos grasos (con pérdida de 25%), aun cuando esta última vía, denominada lipogénesis de novo, tiene poca importancia en seres humanos, pues aparece en personas que ingieren cantidades elevadas de hidratos de carbono (300 - 500 g), de manera continua y por tiempo prolongado, lo que es raro que ocurra.
En el caso de los lípidos, no se pierde una cantidad importante por deposiciones; no tienen otras vías de pérdida y su depósito o su oxidación es muy eficaz, de modo que, desde la ingesta hasta el destino final, se pierde entre 2% y 3% de la energía contenida en la grasa; el resto queda depositado.
En el caso de las proteínas, cualquiera sea la ruta: depósito, oxidación o transformación en urea, se pierde entre 20% y 25% de la energía contenida. Por eso se ha usado dietas hiperproteicas, con el fin de causar un efecto termogénico mayor, pero el rango de variación del porcentaje de proteínas es pequeño, porque no es posible indicar una dieta con 50% de proteínas; sí es factible subir de 20% a 30%, pero el costo es elevado.
Desarrollo de la obesidad
Cuando se habla de obesidad, se trata finalmente de balance energético positivo. Siendo que el organismo se rige por las mismas reglas de la termodinámica, es decir, la energía no se crea ni se pierde, sólo se transforma, es así como la grasa de la dieta se transforma en grasa corporal. El balance energético positivo necesario para subir 1 kilo de peso está cuantificado: se necesita entre 6.600 y 8.000 calorías, según el tipo de almacenamiento (más energía si es grasa o menos si es tejido magro). En casi todas las condiciones, el 66% a 75%, la ganancia de peso corresponde a grasa, la que empieza a acumularse en todas partes, no sólo en el tejido subcutáneo. Una parte importante de la grasa se deposita en forma ectópica, incluso en el músculo esquelético, y aparecen alteraciones metabólicas progresivas que pueden ser inducidas experimentalmente mediante infusiones de grasa. La aparición de alteraciones metabólicas está muy vinculada al exceso de grasa, el cual produce alteraciones en el metabolismo de la glucosa o de los lípidos.
Desde el momento en que ingiere una dieta determinada, el paciente reacciona como un todo; en el momento agudo reacciona según el ambiente y la genética que lo predisponen a la obesidad en condiciones determinadas y que son modulados por los dos grandes pilares que controlan la obesidad: la dieta y el ejercicio. Estos dos pilares van a generar una serie de señales celulares y químicas, ya que los hidratos de carbono y grasas ingeridos equivalen a señales químicas que producen distintos estímulos en los diferentes tejidos. En relación a los carbohidratos es importante destacar que no son equivalentes entre sí, por ejemplo, no son equivalentes la glucosa y la fructosa y se produce la misma situación con los ácidos grasos, ya que no son equivalentes los ácidos grasos saturados y los poliinsaturados; incluso, entre los poliinsaturados, no es lo mismo un omega 3 que un omega 6. Las señales celulares dependen de lo que se incorpore al organismo y de lo que termina en los depósitos y puede producir efectos variados.
En un estudio en el que se determinó la relación entre la duración en años de la obesidad y la respuesta al test de tolerancia a la glucosa oral, se observó que los individuos que han sido obesos por más tiempo tienen un nivel más alto de intolerancia a la glucosa, porque ha habido más tiempo para que las señales intracelulares alteren el metabolismo de las grasas y de los hidratos de carbono (Felber Int JObesity 2002; Suppl 2: S39-45).
Tamaño adipocítico y actividad enzimática
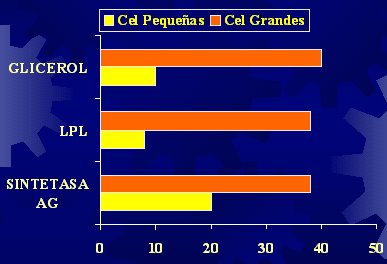
Es importante considerar que los adipocitos funcionan como verdaderos refrigeradores que pueden estar llenos a medias, completamente llenos o, incluso, como en el caso de la obesidad, pueden haber generado más refrigeradores. El tamaño de los adipocitos se correlaciona con los niveles plasmáticos de glicerol, la lipoproteinlipasa (LPL) y la sintetasa de ácidos grasos (SAG) (Figura 1).
 Tamaño completo
Tamaño completo Figura 1. Tamaño de los adipocitos y actividad enzimática (Farnier C, Int J Obesity 2003).
El glicerol es una medida de la lipólisis y proviene de la degradación de los triglicéridos, en la que se liberan tres ácidos grasos, que son utilizados, y un glicerol que va al plasma; por lo tanto, no es raro que las células más grandes liberen más ácidos grasos, porque tienen más triglicéridos. Los ácidos grasos liberados a la circulación pueden ser utilizados como fuente de energía por algunos tejidos, pero hay una gran probabilidad de que se depositen en otros tejidos, en los cuales van a producir más daños que beneficios. Los adipocitos pequeños generan menos glicerol en comparación con los más grandes.
La LPL, que es una enzima relacionada con la captación de los ácidos grasos para permitir su ingreso a la célula, también depende del tamaño del adipocito. De hecho, en la actualidad se está caracterizando el tamaño del adipocito como un elemento de precisión diagnóstica. En el caso de la sintetasa de ácidos grasos, cuyo sustrato son los ácidos grasos, a los cuales transforma en elementos de síntesis o de depósito, esta función también depende del tamaño del adipocito. Por lo tanto, las intervenciones que se realice tienen mucha importancia para reducir los factores de riesgo, pero lo que se hizo antes, con la dieta, que causó aumento o disminución del tamaño de los adipocitos, significa que ya se ha obtenido una célula que va a producir efectos diversos, con señales distintas hacia los tejidos. Por eso, no es raro comprobar que, en los obesos, los niveles de ácidos grasos circulantes son más altos en estado de ayuno.
En un estudio realizado por Weiss en adolescentes obesos, con intolerancia a la glucosa y sin ella, al comparar a los niños tolerantes con los intolerantes no se encontró diferencias en términos de grasa total; o sea, eran igualmente obesos. Al analizar la captación de glucosa por medio de un clamp, el individuo con intolerancia a la glucosa, como era de esperar, mostraba una disminución; pero sí hubo diferencias en la cantidad de grasa visceral, la que era significativamente mayor en los intolerantes. De la misma manera, no hubo diferencias en la glicemia de ayuno, pero sí a las dos horas de la carga de glucosa y, en cuanto a los depósitos ectópicos, la cantidad de grasa a en el músculo esquelético, determinada mediante biopsia muscular, fue significativamente más alta en los individuos con intolerancia a la glucosa (Weiss y cols, Lancet 362. Sept 20, 2003). Lo anterior demuestra que los lípidos están muy relacionados con las señales de la cascada insulínica y con la alteración de la captación de la glucosa, no sólo en niños sino también en adultos, y que es necesario considerar la ubicación de la grasa, el tamaño de los adipocitos y la cantidad de grasa depositada a nivel intramuscular.
Interacción metabólica entre hidratos de carbono y grasas
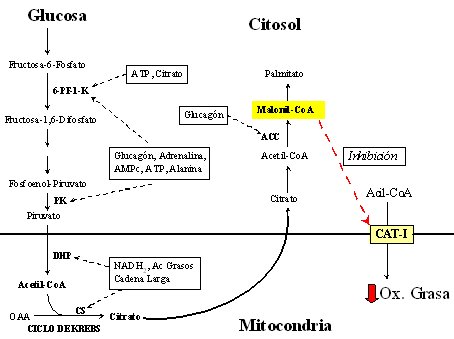
Los hidratos de carbono y las grasas están directamente relacionados en su metabolismo (Figura 2). Cuando se ingiere una cantidad elevada de glucosa, ésta puede llegar al interior de la mitocondria para oxidarse en el ciclo de Krebs; pero, cuando hay una cantidad excesiva de glucosa oxidada, aumenta el citrato, el cual inhibe la oxidación de las grasas; así se explica en parte por qué los hidratos de carbono ejercen un efecto ahorrador, no sólo de proteínas sino también de la combustión de las grasas. Como en general se ingiere las llamadas grasas dulces, esto es, grasas asociadas con hidratos de carbono: por ejemplo, papas fritas, completos y pasteles, la asociación privilegia que el hidrato de carbono se oxide y que, a su vez, frene la oxidación de las grasas.
Las grasas ingresan a la mitocondria para oxidarse, gracias a la carnitina acil transferasa I (CAT-I). Como la utilización excesiva de glucosa produce malonil coenzima A, que inhibe la CAT-I, mientras no pase la carga excesiva de glucosa no se va a utilizar las grasas de manera adecuada. Como las grasas no se oxidan, permanecen circulando y se depositan en otros tejidos en cantidades excesivas. Por lo tanto, se debe mejorar la capacidad oxidativa de los tejidos que participan en el proceso, particularmente del músculo e hígado, mediante la dieta y el ejercicio.
 Tamaño completo
Tamaño completo Figura 2. Interacción metabólica entre hidratos de carbono y grasas.
Moduladores de la sensibilidad insulínica y la oxidación de los ácidos grasos
El proceso mediante el cual la dieta puede modular la sensibilidad a la insulina está muy relacionado con la incorporación de los hidratos de carbono al interior de la célula; median este proceso, en el caso del músculo, los transportadores GLUT 4. También es importante la cantidad de glucosa que se oxida y se desdobla; a partir de los depósitos de glicógeno se utiliza la capacidad de síntesis de glicógeno, la que está conservada o disminuida; la capacidad oxidativa mitocondrial, porque puede haber no sólo un menor número de mitocondrias sino también una capacidad menor de oxidación de hidratos de carbono y de grasa. Se debe trabajar más en la calidad y cantidad de los ácidos grasos depositados, porque, y en general no se pone mucho énfasis en ello, a los sujetos no les importa el tipo de grasa que consumen. Se pensaba que el depósito adiposo no era capaz de diferenciar lo que le llega, pero actualmente se sabe que el organismo tiene una gran capacidad para que los ácidos grasos saturados lleguen como tales al tejido adiposo, y probablemente son más difíciles de movilizar.
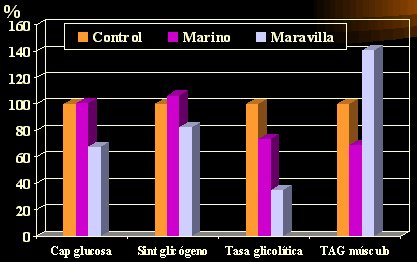
En un estudio del metabolismo de la glucosa en ratas según la dieta, el grupo control recibió una dieta normal y se administró aceite marino o de maravilla a otros dos grupos. La captación de glucosa fue equivalente en el grupo control y en el grupo con ácidos grasos marinos (EPA y DHA) (Figura 3), en los que se mantuvo, pero en el grupo que recibió aceite de maravilla la captación disminuyó casi en 40%; la síntesis de glicógeno tendió a aumentar con el aceite de origen marino, pero disminuyó en alrededor de 20% con el de maravilla; la tasa glicolítica, es decir, la tasa con la cual el organismo usa la glucosa almacenada (el glicógeno) disminuyó 25% con el aceite marino, pero el aceite de maravilla la disminuyó más (65%), lo que reduciría la probabilidad de que el sujeto desdoble sus depósitos de glicógeno y utilice mayor cantidad de grasa; los triacilglicéridos musculares disminuyeron con el aceite marino, pero aumentaron con el de maravilla (Jucker et al. Diabetes 1999; 48:134-40).
 Tamaño completo
Tamaño completo Figura 3. Metabolismo de la glucosa en ratas según régimen dietario.
Estudios de este tipo no se pueden realizar en seres humanos, porque a las ratas se las introduce en un aparato que les extrae todos los ácidos grasos para determinar su contenido; se reseca por completo la masa muscular y luego se analiza qué cantidad de ácidos grasos contiene y de qué tipo. En el ser humano, con sólo hacer una biopsia a nivel muscular esquelético surgen problemas, de modo que esta información proveniente de modelos animales es muy valiosa.
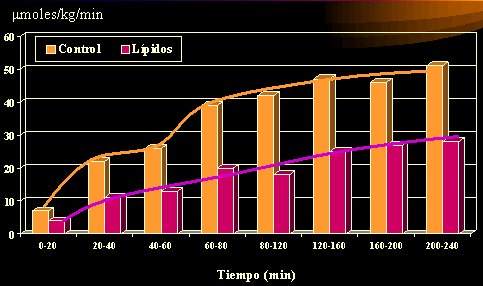
Lo que sí se ha evaluado en humanos es la captación de glucosa en un estado agudo, porque no es posible esperar que un individuo aumente en forma paulatina la cantidad de grasa y la acumule hasta que se produzca la alteración. Para vencer este obstáculo, se infunde lípidos durante varias horas, por ejemplo, 240 minutos, con lo cual se obtiene niveles plasmáticos elevados de lípidos, y se logra un estado similar al que sobreviene en forma progresiva en el tiempo; es un remedo de lo que ocurriría en un sujeto obeso, pero se trata de una obesidad dinámica, inducida.
En el control (Figura 4), la captación de glucosa aumenta con el tiempo, pero se deprime desde los primeros minutos cuando se realiza una infusión de lípidos, de los poliinsaturados a las mezclas. Dresner realizó este experimento en 1999, pero se ha reproducido posteriormente. Muchos de los conocimientos fisiológicos actuales se han obtenido por medio de infusiones de glucosa e insulina y de ahí han surgido varias de las relaciones que se hacen con el índice glicémico. En suma, la infusión de una cantidad excesiva de lípidos, realizada en forma aguda durante 5 horas, altera la captación de glucosa; ésta se evaluó mediante clamp euglicémico hiperinsulinémico y los resultados son de gran valor, dada la solidez del examen realizado. La cantidad de lípidos que se infunde no es la que se recibe con una dieta, pero existe una condición que es factible de ser producida (Dresner et al, JCI 1999; 103:253-259).
 Tamaño completo
Tamaño completo Figura 4. Captación de glucosa en humanos posterior a la infusión de lípidos o glicerol (5 horas).
Oxidación de grasas y adiposidad
No sólo se debe determinar la cantidad de grasas que se libera del tejido adiposo, sino también se debe evaluar lo que ocurre con la oxidación de los ácidos grasos. Como ya se dijo, la glucosa en exceso también puede causar efectos sobre la oxidación de las grasas, ya sea porque la glucosa está elevada secundariamente a un proceso de insulinorresistencia o porque se consume una cantidad exagerada de hidratos de carbono con grasa.
En un experimento realizado en ratas se les administró una cantidad de grasa habitual (no superior 20 g), en forma de manteca, aceite de oliva, EPA, DHA y la combinación de ambos; se observó que cuando la rata recibía EPA y DHA la síntesis de ácidos grasos era menor y la adiposidad de la rata, al cabo de 20 días, disminuía en 40% (de 10 g, perdía 4). Aún no se sabe porqué cuando se combinan ambos ácidos grasos poliinsaturados omega 3, el efecto sobre la adiposidad es aún mejor (Raclot et al. Proc Nutr Soc 1999; 58:633-46).
En humanos también hay estudios al respecto. En un trabajo muy interesante, que no ha sido reproducido en la literatura, durante tres semanas se suplementó a los individuos con 6 g de aceite de pescado o placebo, en forma de cápsulas, mientras se mantenía una dieta similar; se comprobó que la cantidad de grasa, evaluada por medio de DEXA, disminuyó 900 g en promedio con el aceite de pescado, sin ninguna otra modificación; la pérdida mínima fue de 700 g de grasa corporal en tres semanas. Fue un cambio muy importante, ya que no medió otra intervención (Couet et al. Int J Obes 1997; 11:637-43).
Expresión de los ácidos grasos dietéticos a nivel celular
Hay una serie de funciones que los ácidos grasos pueden estimular:
- Según el tipo de ácido graso, puede haber un aumento de la expresión génica de enzimas que están vinculadas con su propia oxidación o con la de otros ácidos grasos.
- La tasa de oxidación también varía según el tipo de ácido graso: EPA y DHA, por ejemplo, se oxidan con facilidad, en parte por la inestabilidad de la molécula y en parte por los dobles enlaces que posee.
- La tasa de movilización: el ácido graso que se deposita al saturarse, probablemente permanece ahí; en cambio, los ácidos grasos poliinsaturados tienden a ubicarse en la periferia del adipocito y tienen mayores probabilidades de intercambio.
- Inducción enzimática: la ingesta de ácido graso omega 3 modula la oxidación de los otros ácidos grasos que lo acompañan en una misma comida.
- La acción insulínica, que también es importante: los ácidos grasos tienen efectos insulínicos y de esa manera pueden aprovechar de estimular la utilización de glucosa.
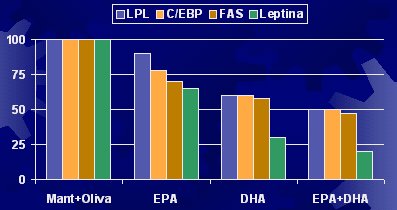
Respecto a la expresión génica y la calidad de los ácidos grasos, la LPL, que está relacionada con la incorporación de ácidos grasos al interior de la célula, es un factor de diferenciación adipocítica; es decir, una célula semilla puede llegar al adipocito o al músculo y transformarse en la célula correspondiente. En la diferenciación desde un preadipocito a un adipocito, existe un componente que es un marcador. Con EPA, DHA o la mezcla EPA-DHA, en un estudio similar al anterior, disminuye la diferenciación adipocítica, la LPL, la síntesis de ácidos grasos y la leptina. Todos estos factores se modifican por el solo hecho de haber cambiado el tipo de ácido graso en la dieta de las ratas (véase Figura 5).
 Tamaño completo
Tamaño completo Figura 5. Expresión génica y calidad de AG en ratas (Raclot et al. Proc Nutr Soc 1999; 58:633-46).
La oxidación, medida en ratas, es distinta según el tipo de ácido graso. Dentro de los ácidos grasos saturados, el porcentaje de oxidación disminuye a medida que aumentan los átomos de carbono en su estructura; el ácido graso laúrico (el del oso polar), de 12 átomos de carbono, abundante en la leche, presenta 64% de oxidación, mientras que el esteárico, de 18 carbonos, presenta sólo 25%; el cacao es el que más tiene ácido esteárico. El ácido graso palmítico saturado, de 16 carbonos, es el ácido graso más importante de la síntesis endógena en seres humanos y es también uno de los más importantes entre los ácidos grasos saturados en el reino animal; por lo tanto, lo que más se ingiere en la dieta es el palmítico, que se oxida sólo en 22%.
En los ácidos grasos insaturados, la oxidación no sólo depende del largo de la cadena, sino también de la posición en que se encuentra el primer doble enlace; si está en la posición 3, como los omega 3, tienen un porcentaje mayor cuando se trata del ácido graso linolénico, el ácido graso precursor de los ácidos grasos omega 3; el EPA y DHA tendrían un valor cercano a 60% ó 70% de oxidación (Leyton J et al. Br J Nutr 1987; 57:383-393).
En un estudio realizado en mujeres sobre la oxidación de ácidos grasos PUFA a las 9 horas, 12 horas y al cabo de una semana, se usó marcadores isotópicos a los cuales se siguió la pista mediante el carbono marcado, en la respiración y se observó que, al cabo de 9 horas, el porcentaje de oxidación del linoleico fue de 13%; en el caso de la familia omega 3 (ácido alfa linolénico) fue de 19% y en el oleico fue de 20%. Al cabo de una semana, cerca de 70% de estos ácidos grasos estaban oxidados; los que más se oxidaron fueron los de la familia omega 3. Los aceites que provienen de la soya y la canola contienen ácidos grasos omega 3 (Mc Cloy y Cunnane, FASEB 2000).
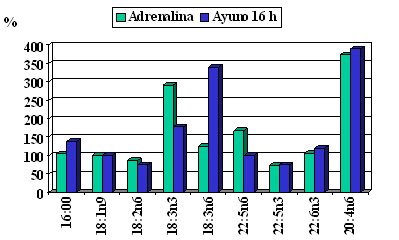
Se han hecho estudios muy meticulosos para ver cómo se movilizan los ácidos grasos, la movilización inducida por una infusión de adrenalina o por un ayuno de 16 horas (Figura 6); el ácido graso palmítico, graficado en el primer par de columnas, se usa como el elemento de 100% con el efecto adrenalínico; por tanto, si todos tuvieran igual tasa de movilización estarían cercanos al ácido palmítico. En el caso del ácido araquidónico, con 20 átomos de carbono y 4 dobles enlaces, el primero en posición 6, por desgracia se moviliza mucho, porque el ácido araquidónico tiene una serie de funciones, entre las cuales hay factores proinflamatorios y producción de citoquinas. El ácido alfa linolénico también se moviliza con el ayuno; este ácido graso se encuentra en pocos vegetales, como el aceite de soya y de canola; en los alimentos marinos están los miembros de la familia omega 3 de cadena más larga, como el EPA y el DHA. La tasa de movilización es diversa, según cuál sea el ácido graso, por lo que no da lo mismo que se trate de un ácido graso saturado o de un omega 3 (Connor et al. J Lipid Research 1996; 37:290-8).
 Tamaño completo
Tamaño completo Figura 6. Tasa de movilización relativa de ácidos grasos (oleico = 100%).
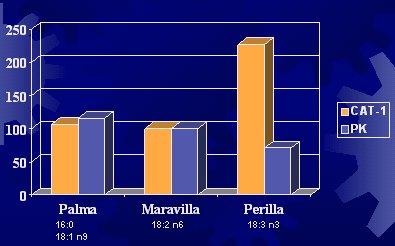
La enzima CAT-1 está relacionada con el ingreso del ácido graso al interior de la mitocondria para que se oxide. La glucosa podría influir en la oxidación de las grasas, porque su metabolismo inhibiría esta enzima, como ya se vio. La fosfofructoquinasa participa en el metabolismo de la glucosa. En un experimento efectuado en hígado de ratas alimentadas con aceite de palma, de maravilla o de perilla (linaza), se observó que las ratas alimentadas con aceite de palma (conformado por ácido palmítico y ácido oleico) o con aceite de maravilla no sufrieron modificaciones en los valores de las enzimas y, en cambio, sí hubo variaciones con el aceite de linaza (Figura 7) (Kabir Y et al. Bioch Biophys Acta 1996; 1304:105-19).
 Tamaño completo
Tamaño completo Figura 7. Actividad de CAT-1 y PK en hígado de ratas alimentadas con distintos tipos de dietas grasas.
En Chile no se dispone de aceite de linaza, pero los huevos omega 3 proceden de gallinas alimentadas con semillas de linaza y tienen un alto contenido de ácido linolénico. En Chile hay harina de linaza, pero los cereales contienen una pequeña cantidad de aceite y, por lo tanto, habría que consumir grandes cantidades; así, una modificación dietética, que es la linaza, puede originar cambios en la enzima que participa en el proceso de oxidación de los ácidos grasos, y su actividad aumenta. Es una acción modulable por medio de la dieta. En cuanto a la composición de los ácidos grasos en los alimentos que se consumen, en general, la composición de los aceites de maíz y otros son similares a la del aceite de maravilla:
- En los aceites comunes (maravilla, soya y raps), su componente principal (50 a 60%) es el ácido linoleico, con 18 átomos de carbono y dos dobles enlaces: el primero en posición 6 (18:2 n6. Este ácido linoleico es el precursor del araquidónico, el cual produce algunos efectos indeseables.
- En el aceite de oliva, el componente principal es el ácido oleico (18:1 n9), con alrededor de 61%.
- Los aceites que tienen mayor contenido de ácido linolénico (18:3 n3) son el de soya y raps, (7 y 8% respectivamente); este último ya no se consume como tal, sino que se comercializa la canola, que es una variedad mejorada, sin ácido erúcico.
En un estudio realizado por nuestro grupo, mujeres obesas y controles consumieron 10 g/día de aceite de canola o de maravilla (además del consumo habitual), ambos disponibles en el mercado, pero con la diferencia de que eran puros, para observar lo que ocurría con estos aceites en relación con un estado basal. Los individuos también recibieron en forma aleatoria un tratamiento previo o posterior. En el momento basal se midió la relación omega 6/omega 3 en el plasma; se preveía que con la canola bajaría la proporción, porque se administró un aceite con al menos 8% de omega 3. Los sujetos fueron reevaluados 14 días después de haber consumido 10 g de aceite, además del consumo extra de las comidas (en total, un máximo de 30 g/día de aceite).
Con la maravilla, los valores basales de la relación n-6/n-3 subieron de 56 a 71 en los controles y de 48 a 65 en las obesas. En promedio, obesas y controles sufrieron un aumento de la relación omega 6/omega 3 cuando consumieron maravilla; es decir, hay mayor disponibilidad de ácidos grasos n-6 en el plasma, porque el aceite que consumieron tenía mayor cantidad de n-6. En cambio, con el consumo de aceite de canola disminuyó el valor de la relación, lo que demuestra que una modificación en la dieta ejerce un efecto a nivel plasmático. La relación de cambio fue 1,79 en los controles y 1,60 en el grupo de obesas, casi 71% de cambio. No tuvo efecto en los controles, pero se produjo un resultado muy interesante: los individuos tendieron a tener una relación directa entre los niveles de insulina (AUC insulina) al cabo de 2 horas, y los niveles plasmáticos de ácido linoleico; o sea, hay una relación entre la cantidad de insulina existente y los niveles de ácido graso linoleico. Se desconoce la relación causa- efecto, pero las modificaciones a nivel plasmático se expresan, al menos, en la secreción de insulina.
Al analizar lo que sucedía con la oxidación de los hidratos de carbono, frente a cada uno de estos aceites, algunos de los controles respondieron con mayor oxidación de hidratos de carbono con aceite de canola y otros con maravilla, pero en las obesas tendió a ser mayor la oxidación de hidratos de carbono cuando consumieron aceite de maravilla. La oxidación de grasas fue mayor con canola en el grupo de obesas, pero en los controles ocurrió lo inverso; sin embargo, es interesante que en el obeso se produzca la oxidación de grasa, porque el aceite de canola se podría utilizar para estimular esta oxidación, aunque algunos obesos se comportaron como controles y algunos controles se comportaron como obesos.
Lo anterior lleva a otra conclusión: no hay una situación metabólica única para el obeso ni para el control; es posible que un individuo de peso normal reaccione como obeso, porque ya tiene alteraciones en su metabolismo derivadas del sedentarismo, la dieta, la actividad que haya suspendido, la pérdida de masa muscular, etc.
Metabolismo de hidratos de carbono
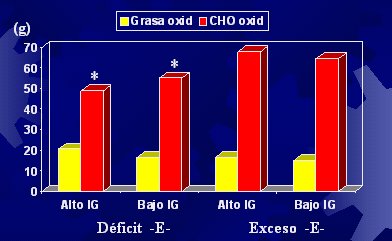
Respecto al índice de glicemia y su repercusión en el efecto insulínico, hicimos un estudio en el cual evaluamos estos aspectos en individuos que fueron alimentados con dietas de distinto contenido energético, alto y bajo, las cuales tenían un índice glicémico alto o bajo. Para resumir, el índice glicémico no produjo los efectos previstos; se preveía que un alto índice glicémico, debido al mayor efecto insulinémico, produjera una menor oxidación de grasa (como corolario, mayor depósito), pero esto no sucedió (Figura 8).
 Tamaño completo
Tamaño completo Figura 8. Oxidación de grasas e hidratos de carbono 5 horas post desayuno (Díaz y cols, 2003).
La única explicación a la falta de asociación entre menor tendencia a la oxidación de grasas frente a efectos insulinémicos más elevados es que la información en la literatura se basa en estudios realizados con clamp euglicémico e hiperinsulinémico donde se usan infusiones elevadas de insulina, con las cuales se logra mantener durante un tiempo la hiperinsulinemia. La dieta, en cambio, produce aumentos en forma de peak y los niveles de insulina disminuyen gradualmente. Las dietas por otra parte, contienen cantidades menores que las que se pueden inducir con una infusión. Así, hay elementos dosis dependientes en la estimulación del depósito de grasa por la insulina. Lo dicho lleva a pensar que no hay relación entre el índice glicémico y el proceso de obesidad. Este índice puede tener algunos elementos beneficiosos, pero no en términos de la oxidación de grasas. Un índice glicémico que se mantiene bajo durante la vida de una persona tiene otros efectos beneficiosos: puede reducir el riesgo cardiovascular y de diabetes, efectos que están demostrados, pero no se relaciona con la obesidad; si así fuera, un efecto insulínico mayor tendría efectos lipogénicos mayores, pero no hay ninguna evidencia en la literatura que permita avalarlo.
Conclusiones
- Las alteraciones ocasionadas por la dieta en la obesidad pueden modificar la utilización de sustratos, metabolitos y señales intracelulares.
- La dieta adecuada es la que considera los efectos metabólicos de los macronutrientes.

