Cursos
← vista completaPublicado el 1 de abril de 2006 | http://doi.org/10.5867/medwave.2006.03.3395
Urgencias neurológicas
Urological emergencies
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Avances en Cuidado Crítico en Geriatría , organizado por la Sección de Geriatría del Hospital Clínico Universidad de Chile durante los días 27 y 28 de marzo de 2005.
Director del Curso: Dr. David Nowogrodski R.
Coordinador del Curso: Dr. Domingo Castillo S.
Introducción
Se tratará los accidentes cerebrovasculares (ACV) en el adulto mayor, en especial los de tipo isquémico, por su mayor frecuencia. Debido a la escasez de literatura disponible sobre ACV en pacientes octogenarios (sólo hay dos estudios), será necesario extrapolar algunos datos. Además, se analizará si actualmente la forma de evaluar los ACV se aplica a los pacientes adultos mayores.
Edad e incidencia de ACV
En el estudio Framingham, en el que se siguió durante 50 años a una cohorte compuesta de pacientes de 35 a 94 años, se encontró una incidencia anual de ACV isquémico de 9,06/1000 y 8,64/1000, en los hombres de 75 a 84 años y de 85 a 94 años, respectivamente; en cambio, entre los 45 y 54 años, la tasa fue de 0,97/1000. En el caso de las mujeres, la incidencia de ACV isquémico fue de 7,52 y 13,79/1000 en los mismos grupos etarios y, entre los 45 y 54 años, la tasa fue de 0,67/1000; por lo tanto, la tasa de ACV aumenta a medida que aumenta la edad.
Han aparecido varios estudios epidemiológicos, pero no todos se refieren a pacientes mayores de 65 años; de hecho, el proyecto más grande, que se está llevando a cabo en los Estados Unidos impulsado por la Organización Mundial de la Salud (OMS), abarca sólo a pacientes menores de 65 años. El estudio Rotterdam (1) se extendió a 7.721 pacientes, a quienes se siguió durante 10 años; en él también se observó que la incidencia de ACV aumentaba al avanzar la edad, tanto en los infartos cerebrales como en los accidentes hemorrágicos y el índice de ACV no especificados fue de 16,6. La única explicación posible de este resultado es que a los pacientes no se les realizó tomografía axial computarizada (TC). En el mismo estudio, la mortalidad a 28 días fue mayor que la observada en grupos más jóvenes y también fue mayor en el grupo con ACV hemorrágicos, en comparación con los casos de infarto. Se comprobó que hasta 50% de los pacientes de algunos grupos de este estudio fallecieron.
En el South London Register (2) se observaron resultados similares: la tasa de incidencia anual de ACV aumentó de manera importante sobre los 64 años de edad, en especial sobre los 84 años, y no hubo diferencia al respecto entre las razas blanca y negra. La incidencia global de ACV en este estudio fue de 19/1000 habitantes, en mayores de 84 años. Por otra parte, un estudio realizado en Grecia (3), en una población cerrada, también demostró que la incidencia de ACV aumenta, en mujeres y hombres, a medida que avanza la edad. Este estudio abarcó registros de mortalidad, porque el objetivo era que no se perdieran los pacientes, lo que es difícil. En el grupo de los mayores de 85 años, la mitad de los pacientes con un ACV fallecieron y un tercio de los que sobrevivieron quedaron gravemente discapacitados.
En el Hospital Clínico de la Universidad de Chile se realizó un registro consecutivo de los pacientes que ingresaron entre octubre de 2004 y marzo de 2005, en la Unidad de Tratamiento de Accidente Cerebrovascular (UTAC). Se registró a 109 pacientes, ninguno de los cuales se perdió, lo que se contrastó con tres bases de datos; 53% de los pacientes eran menores de 65 años; 35% tenían entre 65 y 79 años; y 11% eran mayores de 80 años. La causa más frecuente de ACV fue la cardioembolía, hasta en 41% de los pacientes de más edad, debido probablemente a la alta concomitancia de fibrilación auricular; en cambio, la arteriopatía de grandes vasos alcanzó 31% entre los 65 y los 79 años. Esta cohorte va a seguir en estudio.
Enfoque diagnóstico
Si se quisiera hacer el diagnóstico topográfico del ACV, se podría ver todos los mapas cerebrales para determinar dónde se produjo la alteración vascular, según los síntomas; pero, como es imposible aprenderse el tipo de irrigación de cada área del cerebro, basta con poner atención en tres elementos: la vía visual, el área del lenguaje y los homúnculos de la parte sensitiva y motora. Si el paciente presenta una hemianopsia, una afasia, una hemiparesia o una hipoestesia, es un ACV mientras no se demuestre lo contrario.
El Instituto de Salud de los Estados Unidos (NHI) diseñó una escala, la NIH Stroke Scale, con la cual se evalúa la conciencia, la mirada, la ataxia y otros elementos. La escala del NIH evalúa y asigna puntaje a 11 ítems, con un puntaje máximo de 42 puntos y a cada rubro se le asigna un determinado puntaje validado por estudios anteriores. La sumatoria permite concluir si el paciente tiene un ACV leve, moderado o grave. Se califica como grave si suma más de 20 puntos, lo cual significa que está en riesgo de morir, porque hay una gran probabilidad de que su infarto sufra una transformación hemorrágica. Por otra parte, un infarto leve es el que suma menos de 4 puntos. En esta escala validada de amplio uso para defectos neurológicos, el puntaje se asigna como sigue:
- conciencia: vigilia (3), orientación: mes, edad (2), órdenes: abrir y cerrar ojos y puños (2)
- mirada horizontal (2)
- campo visual (3)
- parálisis facial (3)
- defecto motor de brazos (4)
- defecto motor de piernas (4)
- ataxia cerebelosa (2)
- sensibilidad al pinchazo (2)
- lenguaje (3)
- disartria (2)
- inatención (2)
También existe una escala de discapacidad, la escala de Rankin modificada. Si un paciente suma 15 puntos en la escala NIH significa que tiene una hemianopsia, una hemiplejia y está afásico, no hace falta describir al paciente. La escala de Rankin es diferente, porque mide la evolución del paciente a los tres meses y se basa en 5 puntos. Los pacientes que tienen entre 0 y 1 punto están sanos; con 1 punto, el paciente puede quedar con una pronación, pero no discapacidad; de 2 puntos en adelante aparece la discapacidad: el paciente mantiene sus actividades cotidianas, pero ya no va al cine ni se junta con sus amistades; con 3 puntos, el paciente no puede cumplir sus actividades básicas solo, no puede vestirse, necesita algún grado de ayuda; 4 puntos significa que no puede caminar solo, necesita que alguien lo apoye (si puede andar con un burrito, corresponde a 3 puntos, porque logra caminar solo); con 5 puntos el paciente está en cama y ni siquiera controla esfínteres. Entonces, entre 0 y 1 puntos significa que el tratamiento dio resultado.
Lo más difícil del manejo de un ACV es convencer al resto del equipo médico de que se trata de una patología reversible, porque un tercio de los neurólogos niega esta posibilidad. Lo primero es considerar que el infarto cerebral es una emergencia; después, tratar de establecer códigos para que se activen sistemas de llamados, igual que las cadenas de trauma, aunque también es difícil. De hecho, en el Hospital Clínico de la Universidad de Chile existe un algoritmo en ejecución, pero en otros hospitales no los hay todavía; seguramente los habrá pronto (véase Figura 1).
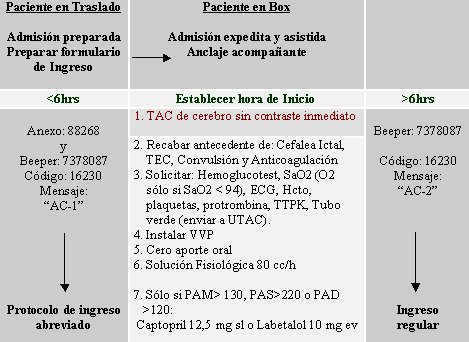 Tamaño completo
Tamaño completo Figura 1. Algoritmo para la primera atención del accidente vascular cerebral en el Hospital Clínico de la Universidad de Chile
Modalidades diagnósticas auxiliares
En todas las guías, tanto la europea (European Stroke Initiative, EUSI) como la de Estados Unidos (American Stroke Association, ASA), la tomografía computarizada (TAC) todavía es el gold standard en el tratamiento del infarto y de la hemorragia cerebral. La resonancia nuclear magnética (RNM) tiene muchas ventajas, pero también el defecto de que las secuencias son muy lentas: tarda entre dos y tres minutos por secuencia; por lo tanto, en cinco secuencias se demora 15 minutos, lapso durante el cual el paciente puede pasar de NIH 2 a 15, lo que es imperdonable.
La TAC se demora un minuto en las máquinas de nueva generación, y en las de segunda generación tarda tres minutos y, si bien no es suficiente para ver la anatomía con detalle, es el mejor examen para ver hemorragia: la sangre brilla en el escáner y ante una imagen como la de la Figura 2 A y B, no es posible equivocarse, en ese caso nadie va a plantear la reperfusión de un paciente. Además se han agregado al tomógrafo o escáner elementos que mejoran su rendimiento, como por ejemplo, más detectores en multicapa, que permiten realizar reconstrucciones del árbol arterial. De hecho, la angio TAC también es muy útil y tarda menos de un minuto, como se ve en las imágenes inferiores de la Figura 2.
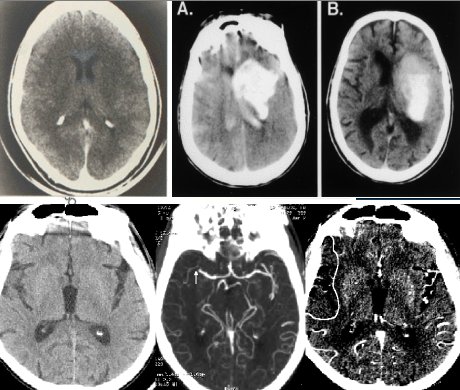 Tamaño completo
Tamaño completo Figura 2. Modalidades diagnósticas auxiliares: TAC cerebral y Angio TAC
La RNM entrega imágenes de excelente calidad, con cortes más finos, y permite realizar estudios histológicos, aunque las descargas se acoplan y los pacientes salen del examen con parestesias. La secuencia T1 no tiene ninguna utilidad en el ACV, porque tarda más de seis horas en volverse positiva; lo importante es ver el agua. La secuencia T2 potencia el agua: se estimula el cerebro y todo lo que es agua comienza a vibrar; se colocan detectores y con ello se construye una imagen. Cuando se dispara y se ve cómo emite el agua (el líquido cefalorraquídeo se comporta como agua), también se obtienen cambios no muy sensibles, que ocurren entre las tres y seis horas; por lo tanto, tampoco sirve.
La difusión es una secuencia ponderada en T2, es decir, estimula y detecta agua. En las secuencias de difusión, examen que se implementó en 1988, la ventaja es que el computador hace el siguiente análisis de cálculo: si los canales iónicos funcionan al 100%, la probabilidad de que una molécula de agua esté dentro o fuera de la célula es 50%. Los voxels se ubican juntos y son de un tamaño muy reducido, para que queden dentro y fuera de la célula; por lo tanto, si las bombas funcionan de manera adecuada, en ese voxel el agua está 50% dentro y 50% fuera al estimular el agua, lo cual se traduce en un color gris. Si, por algún motivo, las bombas no están funcionando, el agua va a estar permanentemente dentro de la neurona: 100% del tiempo va a estar en el mismo voxel, de modo que va a brillar; esto se llama restricción a la difusión del agua y señala que las células tienen membranas disfuncionales, con todos los canales iónicos detenidos. Se ha visto que cuando una neurona llega a ese punto, el proceso probablemente es irreversible. Algunos estudios han demostrado que las difusiones pueden subestimar un poco el tamaño de la lesión, pero, en la mayoría de los casos, cuando se ve una restricción del agua se debe a que las neuronas están muertas (Fig. 3).
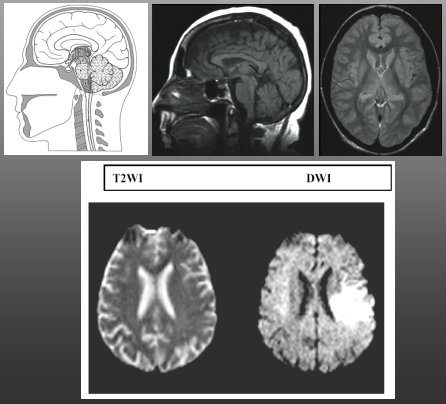 Tamaño completo
Tamaño completo Figura 3. Modalidades diagnósticas auxiliares: difusión
Otras técnicas, como la angio RNM con gadolinio, sirven para mapear todos los vasos. Esta secuencia tarda dos minutos y es muy buena (Fig. 4, a la izquierda). Una secuencia de la angio RNM permite ver el polígono de Willis, pero se demora siete minutos, por lo tanto no es práctica, porque no sirve para indicar terapia de reperfusión. En la Figura 7, el examen de la derecha corresponde a una paciente de 70 años con síndrome de arteria cerebral media derecha; a las dos horas presenta restricción del agua en la cápsula interna (imágenes de la fila superior); esta lesión se expresaría como una hemiplejia y quizás como algún defecto sensorial, porque la vía óptica pasa por esa zona. Cuando se le administra gadolinio (MTT), el tránsito de este medio de contraste se retrasa, por lo tanto, hay un gran defecto de perfusión; eso es lo que entrega la RNM con contraste. Esta discordancia entre la imagen sin medio de contraste (DWI) y con medio de contraste (MTT), se llama mismatch, término que es muy importante conceptualmente, pero no tiene significación clínica. La paciente tiene obstruida la arteria cerebral media, pero alcanza a irrigar una zona gracias a colaterales corticopiales; lo demás está en penumbra. Después de reperfundir a esta paciente se observan algunas ramitas, probablemente se trate de un flujo TIMI 2, y desaparece el defecto de perfusión (imágenes de la fila inferior).
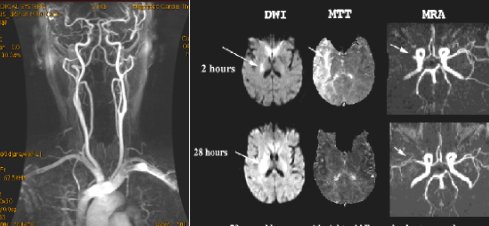 Tamaño completo
Tamaño completo Figura 4. Modalidades diagnósticas auxiliares: a la izquierda, angio RNM. A la derecha, angio RNM con contraste en una paciente de 70 años con síndrome de arteria cerebral media derecha; recanalización arterial con reperfusión tisular; recuperación clínica a las 28 horas.
En el futuro va a llegar el escáner con xenón inhalado. En este caso se observan defectos de perfusión importantes (Fig. 5).
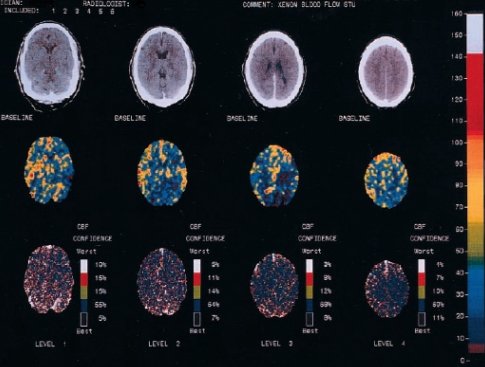 Tamaño completo
Tamaño completo Figura 5. Estudios de captura de penumbra: análisis de escáner con xenón inhalado; hombre con hemiparesia derecha y afasia de tres horas de evolución. (Fuente: Stroke 2003; 34: 1084-1104)
El SPECT se utiliza con mucha frecuencia en la Clínica Las Condes; también se realiza mapeo por RNM en penumbra (Fig. 6).
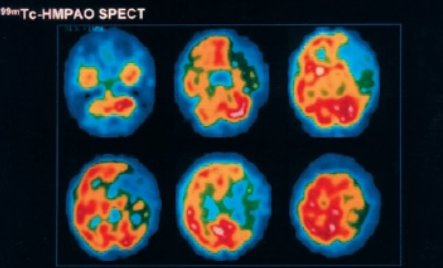 Tamaño completo
Tamaño completo Figura 6. Estudios de captura de penumbra con SPECT: mujer de 35 años, antes de realización de trombolisis. (Fuente: Stroke 2003; 34: 1084-1104)
El caso clínico de la Figura 7 proviene de la guía estadounidense de la ASA; se trata de un paciente que consultó por un defecto crural, se le practicó una difusión, que resultó negativa (Fig. 7 A); después se le realizó una perfusión por RNM y apareció un defecto típico de territorio limítrofe, entre la arteria cerebral media y la cerebral anterior (Fig. 7 B), y al día siguiente la imagen apareció en la difusión (Fig. 7 C). El resultado es llamativo desde el punto de vista teórico, pero la aplicación práctica todavía no está clara.
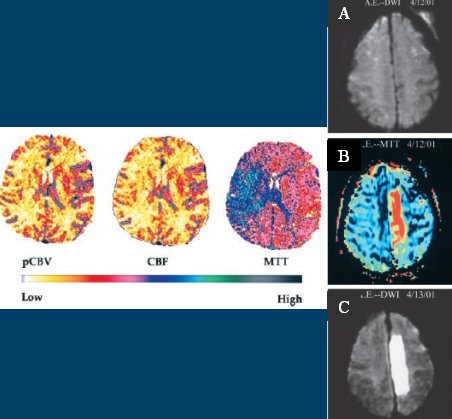 Tamaño completo
Tamaño completo Figura 7. Estudios de captura de penumbra: RNM. (Fuente: Stroke 2003; 34: 1084-1104)
Tratamiento de urgencia convencional
Hay dos grandes ramas de tratamiento: el convencional y el tratamiento de reperfusión, aunque se han agregado también los neuroprotectores, que son moléculas específicas cuyo fin es congelar el estado metabólico de las neuronas; no se refiere a no permitir hiperglicemias ni a mantener ciertas presiones arteriales, ya que eso forma parte del tratamiento convencional.
El tratamiento convencional está descrito con detalle en las guías de la ASA, que fueron actualizadas recientemente, son gratuitas y muy buenas:
- No se debe tolerar la hipotensión y sólo se debe bajar la presión arterial cuando las cifras superan los 220/120 mmHg.
- No obstante, en los pacientes con ACV hemorrágicos y en los que reciben activador tisular del plasminógeno (TPA), la presión no debe superar los 180/110 mmHg.
- No se debe tolerar hiperglicemias: en las guías internacionales el límite es 180 mg/dl, pero en el hospital trabajamos con un límite de 150 mg/dl; sobre ese límite, se administra insulina.
- No se tolera la hipertermia: primero se trata la fiebre y después se busca la causa; ojalá fuera al mismo tiempo, pero es terrible que un paciente tenga temperaturas sobre 37,5º.
- No se tolera agua libre ni soluciones glucosadas, sólo soluciones fisiológicas.
- No se utiliza tratamiento preventivo de las crisis epilépticas, sólo se tratan cuando se presentan.
- Está normado cuáles exámenes se debe solicitar; cuáles se solicitan en circunstancias especiales; y cuáles no se deben solicitar (4), como se detalla a continuación.
Los estudios diagnósticos inmediatos recomendados para la evaluación de un paciente con sospecha de ataque cerebral isquémico son:
En todos los pacientes:
TAC de cerebro (RNM puede ser considerado en centros calificados)
Electrocardiograma
Glucosa sanguínea
Electrolitos plasmáticos
Función renal
Hemograma, incluye recuento de plaquetas
Tiempo de protrombina / INR
Tiempo de tomboplastina parcial activada (TTPK)
En pacientes seleccionados:
Pruebas de función hepática
Exploración toxicológica
Determinación de alcohol plasmático
Prueba de embarazo
Saturación de oxígeno o gasometría de sangre (si sospecha de hipoxia)
Radiografía de tórax (si se sospecha enfermedad pulmonar)
Punción lumbar (si se sospecha hemorragia subaracnoidea con TAC sin sangre)
Electroencefalograma (si sospecha crisis)
Las normas sobre el control de la presión arterial ya tienen bastante tiempo (4); si todavía se administra nifedipino sublingual u oral en un servicio de urgencia, es incorrecto. Un panel de expertos confeccionó los puntos que hay que seguir y, en la actualidad, no atenerse a estas directrices constituye iatrogenia. En términos generales, si el paciente no es candidato a tratamiento trombolítico, se esperan cifras hasta de 220/120 mmHg para intervenir; si se interviene, se permite una disminución hasta de 15% de la presión arterial.
Los medicamentos recomendados, según estas normas, son, en primer lugar, el labetalol, porque no modifica la reactividad vascular del cerebro; el segundo fármaco que se recomienda es la nicardipina. El nitroprusiato de sodio se utiliza sólo en casos muy graves. En pacientes con esquemas trombolíticos, las cifras tensionales nunca deben sobrepasar los 185/110 mm Hg; cuanto más estas cifras superen el nivel señalado, más agresivo debe ser el tratamiento, utilizando desde el labetalol hasta nitroprusiato de sodio. En el tratamiento convencional no hay ninguna diferencia entre los pacientes menores y mayores de 65 años. No hay estudios específicos realizados en pacientes geriátricos y en ninguna guía europea, estadounidense ni internacional se menciona que deba hacerse alguna diferencia en el tratamiento de estos grupos etarios.
Tratamiento de reperfusión
El tratamiento de reperfusión se puede efectuar en varias modalidades: endovenosa, intraarterial, combinada (binding protocol) y mecánica; esta última todavía está en fase experimental, con roedores. La terapia endovenosa lleva 10 años, pero todavía no se ha implementado. Sólo 2% de los pacientes reciben TPA, porque la mayoría de ellos llegan después de las tres horas. En un artículo clásico, publicado en N Engl J Med (5) y auspiciado por el NINDS, se exigía que los neurólogos decidieran si estaban o no de acuerdo con esta terapia. Los ingleses opinan que el estudio no es válido, opinión en la cual se afirman muchos neurólogos que no gustan de las urgencias vasculares.
La terapia se compone de dos partes: en la primera se señala que, si se administra TPA, en tres horas el paciente se va a reperfundir y, por tanto, la escala del NIH mejora en forma inmediata. Sin embargo, a las 24 horas no se observaron cambios estadísticamente significativos, en cuanto al riesgo relativo, entre los pacientes con placebo y los que recibieron TPA; por lo tanto, cuando se administra TPA no se debe prever que habrá cambios en las 24 horas siguientes.
En la segunda parte se propuso ver si había cambios a largo plazo. En el estudio se observó que a los tres meses las escalas de Rankin, NIH, Barthel y Glasgow tuvieron diferencias significativas en comparación con el grupo placebo. El odds ratio global fue de 1,7. Cuando se extrapoló al tipo de infarto, no hubo ningún cambio; se creía que el infarto lacunar no se beneficiaría, porque, según una teoría, no hay trombo, sino una hipohialinosis y la arteria está necrosada. No obstante, se observó que los infartos lacunares se beneficiaban de la misma manera y en el mismo ámbito que los cardioembólicos y los oclusivos de grandes arterias.
Cuando se habla con la familia, es necesario decirle que si se administran trombolíticos al paciente, existe un 30% de probabilidades de quedar sin tratamiento. En términos absolutos, la probabilidad de llevar al paciente a la recuperación completa sería de 12%, pero para la familia es más fácil entenderlo de la otra forma.
El talón de Aquiles de la terapia con TPA es la hemorragia intracraneana, a la que se da mucha importancia, tanto en la primera parte como en la segunda parte del estudio mencionado. A la familia se le debe explicar que si no se trata al paciente, la probabilidad de que desarrolle una hemorragia es de alrededor de 0,6%; en cambio, si se le administra terapia con TPA, el riesgo llega a 6%. Frente a esto todos se impresionan, pero también se debe aclarar que 20% de los pacientes que no reciben la terapia y que no presentan hemorragias intracraneanas, de todas maneras van a morir, debido a las complicaciones de los infartos extensos.

