Cursos
← vista completaPublicado el 1 de septiembre de 2006 | http://doi.org/10.5867/medwave.2006.08.3421
Diabetes mellitus tipo 2 en niños y adolescentes
Type 2 diabetes mellitus in children and adolescents
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Internacional de Diabetes del Niño y del Adolescente, organizado por la Asociación Latinoamericana de Diabetes entre los días 19 al 21 de abril de 2006. Directora: Dra. Gloria López.
Presentación
La diabetes mellitus tipo 2 (DM 2) se comenzó a manejar hace diez años en el Hospital General de Niños Pedro de Elizalde, que se encuentra ubicado al sur de Buenos Aires y atiende a niños de bajos recursos de ese sector (Fig. 1). A continuación se presentará la experiencia acumulada hasta la fecha en este establecimiento.
 Tamaño completo
Tamaño completo Figura 1. Frontis del Hospital General de Niños Pedro de Elizalde, Montes de Oca 40, Buenos Aires, Argentina
Las clasificaciones de la diabetes mellitus son cada vez más complicadas, pero el concepto básico establece que es un grupo de trastornos metabólicos de diversas etiologías; que se caracteriza por la hiperglicemia crónica; que ésta acompaña o es la causa de una alteración del metabolismo de los hidratos de carbono, grasas y proteínas; y que a corto o a largo plazo termina con trastornos micro y macrovasculares. La clasificación etiológica que se utiliza en este momento es la de la ADA (American Diabetes Association), la que cataloga la diabetes tipo 1 autoinmune e idiopática; la diabetes mellitus tipo 2; otros tipos de diabetes, como la MODY y la diabetes transitoria del RNn, entre otras; y la diabetes mellitus gestacional.
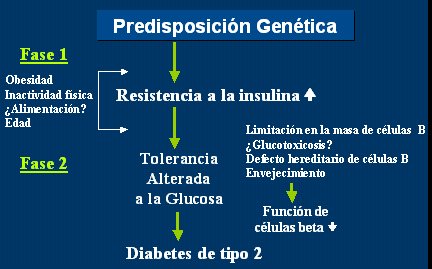
En cuanto a la historia natural de la diabetes tipo 2, siempre hay una predisposición genética que se manifiesta por un aumento de la resistencia a la insulina o una disminución de la sensibilidad a la insulina, y que, en presencia de algunos factores como la obesidad, la inactividad física, la alimentación y la edad, va a provocar alteraciones en el metabolismo de la glucosa, que hoy se conocen como prediabetes o tolerancia alterada a la glucosa. Si este cuadro progresa, terminará en diabetes tipo 2, con alteraciones de la función de la célula beta y, por tanto, insulinopenia (Fig. 2).
 Tamaño completo
Tamaño completo Figura 2. Historia natural de la diabetes mellitus tipo 2
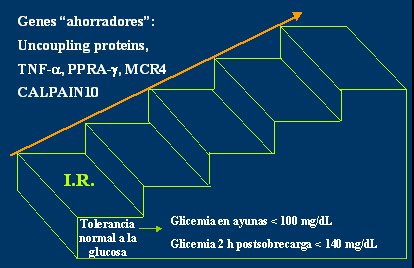
En la Figura 3 se ilustra la evolución de la enfermedad, en forma de una escalera cuyo primer escalón representa la insulinorresistencia, que está determinada en forma genética, se relaciona con ciertos genes ahorradores y está presente con tolerancia normal a la glucosa. Para hablar de diabetes debe haber hiperglicemia; no basta con la clínica, el valor de la glicemia es lo que hace el diagnóstico. Si a esta persona, niño o adolescente ubicado en este primer escalón de insulinorresistencia, se le hace una glicemia en ayunas o a las 2 horas de recibir una sobrecarga de glucosa de 1,75 g/kg, con un máximo de 75 g, diluida en agua o té al 20%, sus valores serán normales, es decir, tendrá una glicemia en ayunas menor de 100 mg/dL o una glicemia dos horas post sobrecarga, menor de 140 mg/dL.
 Tamaño completo
Tamaño completo Figura 3. Influencia de la genética en el paso de insulinorresistencia a diabetes mellitus tipo 2 (J Clin Endocrinol Metab 2004)
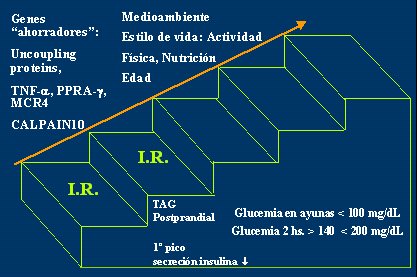
Posteriormente, debido a factores del medio ambiente debidos por el nuevo estilo de vida, que se caracterizan por menor actividad física, mayor ingesta calórica y edad, en el adolescente generalmente aparece una tolerancia a la glucosa postprandial alterada; es decir, cuando se sobrecarga al individuo, se mantiene la glicemia de ayuno postprandial normal, menor de 100, pero la glicemia a las 2 horas post sobrecarga está entre 140 y 200 mg/dl y la primera punta de secreción de insulina es débil (Fig. 4).
 Tamaño completo
Tamaño completo Figura 4. Influencia del medio ambiente en la progresión desde insulinorresistencia a diabetes mellitus tipo 2 (J Clin Endocrinol Metab 2004)
Insulinorresistencia
La insulinorresistencia, o disminución de la sensibilidad a la insulina, se define como la incapacidad de la insulina, en concentraciones normales, a) para adecuar la disponibilidad periférica de la glucosa; b) para suprimir la glucogenolisis hepática, se hace incapaz de sostener la glucogénesis hepática; y c) para inhibir la producción de lipoproteínas de muy baja densidad. La incapacidad para adecuar la disponibilidad periférica refleja que se está perdiendo la homeostasis, ya que el organismo, en situación normal, se las arregla para mantenerse entre 100 y 140 ml/dl; en cambio, ahora, la insulina es incapaz de cumplir estas condiciones.
La insulinorresistencia va a dar origen a una hiperinsulinemia. Todos tenemos insulinemias en ayuno normales, hasta que entra este factor que origina una insulinemia mayor de 15 uU/ml y mayor de 75 uU/ml post sobrecarga a las 2 horas, con una punta mayor de 150 uU/ml (Reaven GM J Clin Endocrinol Metab 1993). El HOMA es un índice que se calcula mediante la fórmula glicemia (mg/dL/18) por insulinemia basal (uU/ml), dividido por 22,5 y que, según Matthews, se considera normal si resulta un valor menor de 3,8. Por lo tanto, la medición de la homeostasis de la glicemia relaciona la glicemia en ayunas con la insulinemia en ayunas.
Todos los seres humanos podrían desarrollar insulinorresistencia, pero esto ocurre sólo en algunos que son los individuos que presentan factores como antecedentes familiares (Goran MI. J Clin End Metab 2003); genética y peso al nacer (Kolterman OG. J Clin Invest 1980); sexo: las mujeres son más insulinorresistentes (Travers SH J Clin End Metab 1995); raza (The Bogalusa Heart Study. Arslanian S. J Clin Metab 2003); y pubertad (Arslanian SA., Diabetes 1994; Goran MI, Diabetes 2001).
Factores de predisposición
Entre los factores que determinan la insulinorresistencia, los antecedentes familiares son fundamentales: el factor de predisposición básico es el de los genes relacionados con la secreción de insulina; en los estudios familiares se encuentra historia de DM 2 en el primer y segundo grado de parentesco, en 74% a 100% de los casos; y en los indios pima menores de 25 años de edad, se ha descrito la DM 2 exclusivamente en individuos con al menos uno de los padres con DM 2 (Kapriel Danadian, Diabetes Care, 1999; Goran Diabetes Care, 2002.
En cuanto a la genética, la hipótesis del fenotipo ahorrador establece que tienen mayor riesgo los niños que nacen con bajo peso para la edad gestacional (hecho frecuente en las poblaciones latinoamericanas) y que experimentan una ganancia brusca de peso en el período postnatal. Este hecho se debe a que, frente a un medio ambiente agresivo, estos niños se adaptan para sobrevivir mediante una respuesta que luego va a actuar en su contra, porque va a contribuir al desarrollo de DM 2, insulinorresistencia y enfermedades metabólicas, fenómeno descrito por Barker (Diabetologia 1992; 35: 595).
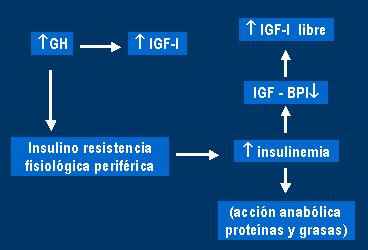
Respecto a la raza, se ha comprobado que los niños afroamericanos sanos tienen más hiperinsulinemia e insulinorresistencia, y menos sensibilidad que sus pares blancos, ya sean pre púberes o púberes (Kapriel Danadian, Diabetes Care, 1999); Arslanian SA, Diabetes, 2002). En los mexicanos también ocurre lo mismo. En la pubertad, la insulinorresistencia fisiológica puede causar aumento de la insulinemia, que tiene una acción anabólica de proteínas y grasas (Fig. 5).
 Tamaño completo
Tamaño completo Figura 5. Insulinorresistencia fisiológica de la pubertad
Factores desencadenantes
La genética, igual que en la diabetes mellitus tipo 1, por ahora no se puede evitar, pero sí es posible evitar la DM 2, porque entre los mecanismos que la causan hay varios que se pueden controlar, como la obesidad, el sedentarismo y, según algunos autores, el tipo de alimentación. La obesidad se puede definir, en forma simplificada, como un acúmulo excesivo de grasa corporal. Se habla de riesgo de obesidad cuando el peso del individuo está sobre el percentil 85, el índice de masa corporal (MC) es mayor de 25 y el z score está entre 2 y 2,5; y se entiende por obesidad que el peso esté sobre el percentil 95, el IMC sea mayor de 30 y el z score, mayor de 2,5. En los últimos años, la prevalencia de la obesidad, estimada por los valores medios de IMC, ha ido en aumento en todo el mundo (Fig. 6).
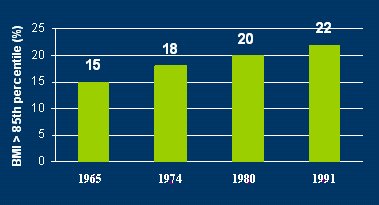 Tamaño completo
Tamaño completo Figura 6. Prevalencia de obesidad en niños de 6 a 11 años en Estados Unidos, según valores medios de IMC (NHANES)
El sedentarismo también ha aumentado notablemente. Todos los niños ven televisión y juegan con videojuegos, y, debido a los peligros de la calle, los padres prefieren mantener a los niños dentro del hogar, aun a costa de reducir su actividad física espontánea. Se ha demostrado que en ciertos grupos étnicos la prevalencia de DM 2 en personas inactivas es dos a tres veces mayor que en sujetos activos de la misma población (Kryska AM, La Porte RE. Diabetologia 1993; 35: 863) y que, en individuos con tolerancia a la glucosa alterada, la incidencia de DM 2 disminuye gracias al ejercicio (Pan XR, Li GW Diabetes Care 1997; 20: 537). En cuanto a la alimentación, algunos autores afirman que el problema no está solamente en el aumento del valor calórico total, sino también en el aumento de las grasas e hidratos de carbono refinados, así como el menor contenido de fibras vegetales.
Consecuencias de la insulinorresistencia
La insulinorresistencia produce hiperinsulinemia, dislipidemia, acantosis nigricans, ovario poliquístico, hipertensión arterial, obesidad central y, en el ámbito cardiovascular, disfunción endotelial, aterogénesis acelerada, fibrinolisis anormal y enfermedad cardiovascular (Fig. 7).
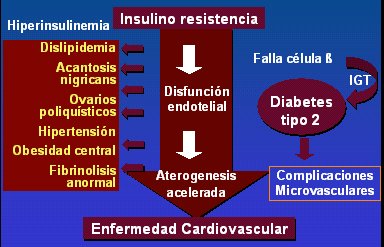 Tamaño completo
Tamaño completo Figura 7. Consecuencias de la insulinorresistencia
Entre estas consecuencias, se debe recordar que, para el National Cholesterol Education Panel, la concentración deseable de colesterol total es menos de 170 mg/dl; de LDL, menos de 110 mg/dl; de HDL, más de 45 mg/dl; de triglicéridos en menores de 10 años, menos de 75 mg/dl, y menos de 90 mg/dl en niños de 10 a 19 años. En cuanto a la acantosis, que tanto preocupa a las adolescentes, es una papilomatosis e hiperqueratosis que se correlaciona con el grado de insulinorresistencia y que se presenta, en general, en las zonas de roce: axila, nuca, pliegue cubital, ingle, ombligo, codos, surco submamario, etc. En lo que se refiere al síndrome de ovario poliquístico, es importante recordar que afecta a entre 4% y 12 % de las mujeres en edad reproductiva y que se debe sospechar en las adolescentes con hiperandrogenismo. Por último, la hiperinsulinemia puede provocar aumento de la presión arterial mediante la reabsorción de sodio y la activación del sistema simpático, y debido a que los ácidos grasos libres inducen la sensibilidad adrenérgica y antagonizan la vasodilatación mediada por oxido nítrico.
En el esquema de los escalones, en el primer escalón está la tolerancia anormal a la glucosa en ayunas, es decir, valores entre 100 y 126, con glicemia a las 2 horas post sobrecarga entre 140 y 200. En el caso de un paciente de 12 años de edad (Fig. 8) con antecedentes de DM 2 en los padres y en los abuelos, acantosis nigricans marcada, presión arterial de 130/85, IMC de 31 y glicemia de 116mg/dL, o sea que es intolerante, pero la insulina es de 28 uU/ml (mayor de 15 uU/ml y el HOMA está en 8,13. A los 30 minutos post sobrecarga, la glicemia sube a 160mg/dl y la insulina a 135 uU/ml, pero logra manejarlo y llega a los 120 minutos con una glicemia de 74 mg/dl y una insulina de 16 uU/ml.
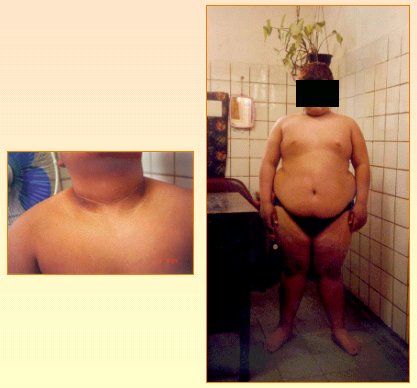 Tamaño completo
Tamaño completo Figura 8. Caso clínico de intolerancia a la glucosa (detalle en el texto)
Los valores normales, como ya se dijo, son 100 mg/dL o menor para la glicemia en ayunas y 140 mg/dL o menor a las 2 horas post sobrecarga; y la tolerancia alterada se define por la glicemia en ayunas entre 100 y 126 mg/dL y la de 2 horas post sobrecarga, mayor de 140 y menor de 200 mg/dL. Así se llega al cuarto escalón, donde ya está presente la DM 2 y luego al quinto escalón, en el que se agrega insulinopenia (Fig. 9). Aquí ya se manifiesta la clínica de la DM 2, con polidipsia, poliuria, polifagia, pérdida de peso y cambio de carácter en los niños, más una glicemia casual igual o mayor de 200 mg/dl; glicemia en ayunas de 126 mg/dl o más, o una glicemia a las 2 horas post sobrecarga de 200 mg/dl o más.
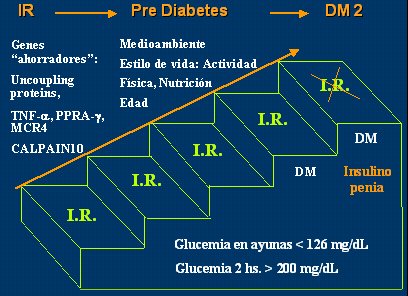 Tamaño completo
Tamaño completo Figura 9. Evolución de insulinorresistencia a prediabetes y DM2
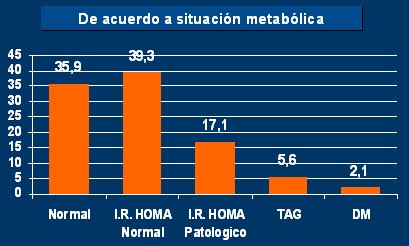
En nuestro servicio se hizo un estudio en 235 pacientes que consultaron entre enero y diciembre de 2004, con edad media de 11,4 años e IMC mayor del percentil 95, en quienes se hizo prueba de tolerancia oral a la glucosa (PTOG), glicemia e insulinemia basal y a los 120 minutos. El HOMA (Fig.10) fue normal en 35,9% de los pacientes; 56% de ellos tuvieron insulinorresistencia; la mayoría tenían HOMA normal; otros, HOMA alterado; 5,6% tenían tolerancia alterada a la glucosa y 2%, diabetes.
 Tamaño completo
Tamaño completo Figura 10. HOMA, TAG Y DM en pacientes obesos que concurrieron durante 2004 al Servicio Nutrición y Diabetes del Hospital Pedro de Elizalde (ME. Andres, M. Ferraro, P. Duran, O. Ramos)
En el mundo, se prevé que el número de personas con DM 2 aumentará a 121 millones en 2010 y a 300 millones en 2025. En los niños, la DM 2 se describió en 1992 en Japón; en 1993 en China; en 1996 en Libia, Estados Unidos y Australia; en 1997 en Bangladesh; en 1999 en Nueva Zelanda y en 2000 en Gran Bretaña. En nuestro servicio no existía este problema antes de 1994, pero desde entonces han aparecido más casos cada año. Se debe estudiar a todos los niños que tengan sobrepeso (IMC sobre el percentil 85 según edad y sexo); historia familiar de DM 2 en primer o segundo grado; insulinorresistencia o condiciones asociadas como acantosis nigricans, hipertensión, dislipidemia y ovario poliquístico; además de la edad de inicio desde los 10 años. El estudio consiste en examen clínico, con énfasis en la presión arterial; glicemia de ayuno y a las 2 horas post sobrecarga; PTOG; glicemia e insulinemia; perfil lipídico (colesterol total, HDL, LDL y triglicéridos); y HbA1c.
Tratamiento
Los pacientes con insulinorresistencia solamente necesitan terapia nutricional y ejercicio, lo que significa que deben consultar a la psicóloga y a la nutricionista; los pacientes que tienen hiperglicemia necesitan dieta, ejercicio y, si es necesario, hipoglicemiantes orales. Hoy se suelen indicar estos fármacos apenas se detecta la insulinorresistencia, pero el sentido común indica que primero se debe tratar de lograr que el paciente modifique su estilo de vida. Aquellos pacientes que entran en cetoacidosis, que prácticamente siempre es cetosis, es decir, el pH es superior a 7,30 y el bicarbonato es superior a 15, se deben hospitalizar para recibir el tratamiento habitual, con el cual la glicemia bajará rápidamente. Después de iniciar el tratamiento con insulina, algunos pacientes se mantienen equilibrados con dieta y ejercicio, pero algunos necesitan hipoglicemiantes orales.
El niño que no baja de peso y no mejora con la dieta y el ejercicio tiene mal pronóstico, como ocurrió con un paciente que acudió en noviembre de 1999 con hiperglicemia, glucosuria y cetonuria, a pesar de lo cual, su perfil lipídico era casi normal. La Hb glicosilada era de 9,6 %. En este paciente el tratamiento empezó con insulina NPH 10 U a.d. y 4 U a.c, más correcciones con insulina corriente, según necesidad. Pesaba 69,5 kilos y llegó como máximo a 37 unidades, es decir, media unidad por kilo. Todo esto, junto con un plan alimentario hipocalórico. Luego de 45 días de tratamiento se suspendió la insulina y la glicemia bajó progresivamente hasta llegar a lo normal, a los 2 años y medio, con un IMC de 24 y una Hb glicosilada de 4,5. La acantosis desapareció y, en la curva de tolerancia, la glicemia basal fue de 83 mg/dl; a los 30 minutos, 130 mg/dl; a los 60 minutos, 108 mg/dl; y a las 2 horas, 63 mg/dl. La curva de insulina tenía un nivel basal de 6,6 UI/mL; a los 30 minutos fue de 35,5 UI/mL; a los 60 minutos, de 49,2 UI/mL; y a los 120 minutos, de 16,9 UI/mL.
Pero no siempre se logran estos resultados. Otro paciente desapareció después del tratamiento con plan de alimentación hipocalórico, actividad física e insulina, y volvió después de seis a siete meses, otra vez obeso, por lo que necesitó metformina. Y en otro caso, aún peor, el paciente también llegó con cetosis, hipertensión y dislipidemia. Por lo tanto, pacientes con el mismo cuadro clínico tienen distinto grado de adhesión al tratamiento; por eso se debe iniciar el tratamiento con insulina, porque para la familia esto significa riesgo y enfermedad en cambio, si se indica sólo ejercicio, la familia no le da mayor importancia. El tratamiento con dieta y ejercicio se considera un éxito cuando el paciente frena la ganancia de peso, crece en el percentil adecuado y mantiene la glicemia en ayunas en menos de 126 mg/dL y laHbA1c en menos de 7%. Sin embargo, aunque el tratamiento tenga éxito, se deben realizar evaluaciones periódicas a intervalos de no más de dos meses, para reforzar la modalidad de tratamiento y revisar la automonitorización de la glicemia, glucosuria y cetonuria. El paciente debe mantener contacto casi permanente con el equipo multidisciplinario. Cuando el tratamiento no tiene éxito, se debe tratar como una diabetes mellitus tipo 1.
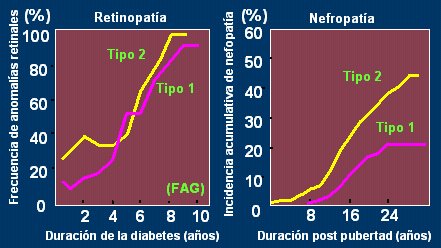
En Japón (Fig. 11), los niños con diabetes tipo 2 llegan a retinopatía y nefropatía en mayor porcentaje que los diabéticos tipo 1, con el mismo tiempo de evolución, lo que significa que no es una enfermedad banal: al contrario, el paciente con diabetes tipo 2 también va a tener complicaciones y en forma temprana.
 Tamaño completo
Tamaño completo Figura 11. Complicaciones en niños japoneses con diabetes tipo 1 y tipo 2. A: frecuencia de anomalías retinales según duración de la diabetes (Yamamoto T. et al J. Jpn Soc Opthalmol 1979). B: incidencia acumulativa de nefropatía según duración de la enfermedad post pubertad (Yokoyama H. 2000)
La investigación de la diabetes tipo 2 en la edad escolar parte con la determinación de glucosuria matinal: si es positiva, se debe hacer una curva simplificada de tolerancia a la glucosa y si ésta es positiva, se hace la curva regular de tolerancia oral a la glucosa con insulinemia, además de la Hb glicosilada y un estudio de lípidos.
El Bogalusa Heart Study demostró que la obesidad y el sedentarismo en el niño y el adolescente son los mejores predictores de riesgo de desarrollar una constelación de desórdenes metabólicos y hemodinámicos, entre ellos la DM 2 y las enfermedades cardiovasculares. En consecuencia, la obesidad, cuya tendencia secular mundial va en aumento, se debe considerar como un problema de Salud Pública. La prevención y la intervención precoz, para evitar el aumento de peso en las primeras etapas de la vida, debe ser la base de una de las políticas sanitarias de máxima importancia y los médicos pediatras, que son los últimos médicos de familia, cumplen un papel fundamental en la tarea de impedir que un niño de dos años de edad, con buenos hábitos alimentarios y buen peso, se convierta en los años siguientes en un paciente obeso.

