Práctica clínica
← vista completaPublicado el 2 de julio de 2020 | http://doi.org/10.5867/medwave.2020.06.7950
Implicaciones del COVID-19 (SARS-CoV-2) para la práctica anestesiológica
Implications of COVID-19 (SARS-CoV-2) for the anesthesiological practice
Resumen
El objetivo de este artículo es revisar las características del SARS-CoV-2, los aspectos clínico-epidemiológicos de COVID-19 y las implicaciones que tienen para los anestesiólogos al realizar procedimientos generadores de aerosoles. Se realizó una búsqueda en las bases de datos PubMed, Scopus, SciELO y Web of Science hasta el 9 de abril de 2020, utilizando las palabras: “COVID-19 or COVID19 or SARS-CoV-2 and anesthesiology or anesthesia”. Se incluyeron 48 artículos con información sobre el manejo del paciente en el perioperatorio o en la unidad de cuidados intensivos ante la sospecha o confirmación de infección por SARS-CoV-2. En general, se recomienda el aplazamiento de las cirugías electivas por no más de seis a ocho semanas, de acuerdo a las condiciones clínicas de los pacientes. En el caso de cirugías de urgencia o emergencia, se revisan tópicos del sistema de protección personal así como las estrategias recomendadas para la realización de los procedimientos.
Ideas clave
- En vista de la reciente pandemia de COVID-19, es necesario revisar las implicaciones que esta representa para la práctica anestesiológica, tanto en el manejo de los pacientes como en el establecimiento de medidas de protección personal.
- Este trabajo aporta una revisión sobre la información, recomendaciones y lineamientos en el ámbito de la anestesiología en el contexto de la pandemia.
- Sin embargo, al tratarse de una enfermedad nueva, la información aquí presentada puede ser reforzada o refutada conforme se incremente el conocimiento disponible.
Introducción
COVID-19 es una enfermedad infecciosa causada por un coronavirus denominado SARS-CoV-2, que fue descubierto recientemente y era desconocido hasta antes del brote de neumonías virales reportadas en Wuhan, China, en diciembre de 2019[1]. El brote de la enfermedad creció sustancialmente y se extendió por todo el mundo, llegando a infectar a casi dos millones de personas y causando la muerte de más de 130 000 de ellas hasta el 16 de abril de 2020[2].
El SARS-CoV-2 ingresa principalmente por la mucosa respiratoria a través de gotas o aerosoles provenientes de una persona infectada o mediante el contacto con superficies contaminadas con el virus. En la práctica clínica, este mecanismo de transmisión resulta una amenaza para el personal de salud, incluyendo a los médicos anestesiólogos, quienes tienen alta probabilidad de tener contacto directo o indirecto con las vías respiratorias al administrar anestesia quirúrgica o bien al realizar procedimientos que generan aerosoles (intubación y extubación traqueal, ventilación con presión positiva, utilización de ventilación mecánica no invasiva y administración de oxígeno a alto flujo; incluso tos y vómito como consecuencia de dichos procedimientos) en pacientes potencialmente infectados con SARS-CoV-2. Por todas estas razones, el objetivo de este artículo es revisar las características del SARS-CoV-2, los aspectos clínico-epidemiológicos de COVID-19 y las implicaciones que tienen para los anestesiólogos al realizar procedimientos generadores de aerosoles.
Métodos
Se realizó una revisión general sobre el origen, epidemiología y características del SARS-CoV-2 y de las principales manifestaciones clínicas de la enfermedad COVID-19. Posteriormente, se realizó una búsqueda de la literatura científica disponible en las bases de datos PubMed, Scopus, SciELO y Web of Science hasta el 9 de abril de 2020. Se utilizaron las palabras clave “COVID-19 or COVID19 or SARS-CoV-2 and anesthesiology or anesthesia” y se incluyeron todos los artículos publicados en el idioma inglés (independientemente del diseño), en cuyos resúmenes se incluyera información relacionada con el manejo anestésico del paciente en el perioperatorio o en la unidad de cuidados intensivos ante la sospecha o confirmación de infección por SARS-CoV-2 y/o enfermedad COVID-19. Se localizaron 59 referencias y/o resúmenes que fueron evaluados por dos investigadores independientes. Se seleccionaron 48 artículos susceptibles de ser incluidos y se evaluaron a texto completo
Revisión
Origen
Los primeros reportes de una nueva forma de neumonía severa en Wuhan, Hubei, China, ocurrieron en diciembre de 2019[3]. Los síntomas típicos clínicos de los primeros casos reportados fueron fiebre, tos seca, disnea, cefalea y neumonía. En algunos casos la enfermedad cursó con falla respiratoria progresiva secundaria al daño alveolar e incluso muerte[4].
Las muestras de siete pacientes que fueron ingresados a la unidad de cuidados intensivos del Hospital Wuhan Jin Yin-Tan al inicio del brote, se analizaron en el Instituto de Virología de Wuhan en busca de coronavirus (el brote había ocurrido en invierno en un mercado de mariscos, el mismo ambiente en que se detectaron infecciones por el coronavirus relacionado a síndrome respiratorio agudo severo, SARS-CoV), siendo cinco de ellas positivas por reacción en cadena de la polimerasa. Una muestra de líquido de lavado bronquioalveolar se analizó para identificar el agente etiológico mediante metagenómica con secuenciación de nueva generación y posterior reacción en cadena de la polimerasa dirigida, observándose que el agente viral tenía un 79,6% de identidad con la secuencia del SARS-CoV, por lo que inicialmente fue nombrado como el nuevo coronavirus 2019 (2019-nCoV)[4]. Recientemente, el virus fue renombrado como SARS-CoV-2 y el cuadro clínico como enfermedad por coronavirus 2019 (COVID-19)[1].
SARS-CoV-2
Los coronavirus son virus envueltos de ácido ribonucleíco de sentido positivo no segmentados de la familia Coronaviridae y del orden nidovirales que se encuentran ampliamente distribuidos en humanos, otros mamíferos (por ejemplo, camellos, vacas, gatos y murciélagos) y pájaros; causando enfermedades respiratorias, intestinales, hepáticas y neurológicas[3],[4]. Raramente los coronavirus animales pueden infectar al humano y entonces transmitirse entre la gente[5]. Sin embargo, la alta prevalencia y amplia distribución de los coronavirus, su gran diversidad genética, la frecuente recombinación de sus genomas y el incremento en el contacto humano-animal, elevan la probabilidad de que nuevos coronavirus surjan periódicamente en humanos produciendo infecciones entre especies y eventos ocasionales de contagio. Aunque la mayoría de las infecciones por coronavirus en humanos son leves, el SARS-CoV-2 al igual que el SARS-CoV y el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV) son ß-coronavirus, tienen origen zoonótico y pueden producir infecciones de vías respiratorias severas potencialmente fatales[4].
La secuencia completa del SARS-CoV-2 de un paciente fue registrada y estuvo disponible en GenBank (GenBank: MN908947) en enero de 2020. Después de China, la Center for Disease Control and Prevention hizo públicas las secuencias de virus aislados en diversos pacientes. Hasta el momento están disponibles aproximadamente 200 genomas, lo que representa una gran diversidad genómica del virus en China y otras poblaciones[5]. Zhang y colaboradores[6] analizaron los genotipos de SARS-CoV-2 en diferentes pacientes de diversas provincias en China encontrando que había mutado, aunque el grado de diversificación fue pequeño. Tang y colaboradores[7] condujeron un análisis de genética poblacional de 103 genomas de SARS-CoV-2 y los clasificaron en dos grupos según la prevalencia de su envoltura, el tipo L en el 70% de los casos y el tipo S en el 30% de los casos. Aparentemente, las cepas en el tipo L derivan del tipo S y son evolutivamente más agresivas y contagiosas[8].
Hasta el momento se sabe que uno de los mecanismos con potencial implicación clínica se relaciona con el sistema renina-angiotensina-aldosterona, un sistema clave en la fisiología humana. SARS-CoV-1 y SARS-CoV-2 interactúan con el sistema renina-angiotensina-aldosterona a través de la enzima convertidora de la angiotensina 2, una enzima que fisiológicamente contrarresta o impide la activación del sistema renina-angiotensina-aldosterona, pero que también funciona como uno de los receptores virales, por lo que se ha propuesto como un potencial factor para la infectividad del virus. Ambos virus activan la respuesta inmunológica y desencadenan la secreción de citocinas inflamatorias y quimiocinas en las células endoteliales vasculares pulmonares, por lo que la “cascada” o “tormenta” de citocinas ha sido postulada como el mecanismo que causa falla orgánica[9].
Por otro lado, Zhou y colaboradores[10] realizaron estudios de infectividad viral mostrando que SARS-CoV-2 usa una enzima convertidora de la angiotensina 2 de humanos, murciélagos, civetas y cerdos como un receptor de entrada y que no usa otros receptores de los coronavirus como la aminopeptidasa N y dipeptidil peptidasa 4. Dichos reportes generaron preocupación desde el punto de vista clínico, dada la posible asociación del uso de inhibidores del sistema renina-angiotensina-aldosterona (que pudieran alterar la enzima convertidora de la angiotensina 2 y modificar su expresión), con la severidad en pacientes con hipertensión arterial sistémica y uso de dichos medicamentos. Por este motivo, en algunos sistemas de salud incluso llegaron a recomendar la suspensión de inhibidores de la enzima convertidora de la angiotensina y bloqueadores del receptor de la angiotensina, ante la sospecha de infección por SARS-CoV-2. De hecho, reportes clínicos iniciales mostraron una alta prevalencia de hipertensión arterial sistémica entre pacientes con SARS-CoV-2, e incluso mayor severidad de la enfermedad, con una mayor proporción de pacientes que requerían ingreso a la unidad de cuidados intensivos y ventilación mecánica o que murieron. Dichas observaciones llevaron a hipotetizar que el manejo médico para esta comorbilidad, incluyendo el uso de inhibidores del sistema renina-angiotensina-aldosterona, podría haber contribuido a los resultados adversos reportados, aunque hasta el momento la correlación clínica molecular no es concluyente[11],[12].
Epidemiología
El brote de la enfermedad creció sustancialmente hasta dispersarse en un periodo muy corto como consecuencia de la transmisión humano a humano en diferentes países, por lo que la Organización Mundial de la Salud (OMS) declaró la epidemia de COVID-19 como una emergencia de salud pública de preocupación internacional el 30 de enero de 2020, con un total de 7 736 casos confirmados en China y 82 casos en 18 diferentes países[13]. Dado que Wuhan es una de las ciudades con mayor transportación en China (aproximadamente 3 500 personas se desplazan por vía aérea en un día promedio), se implementaron medidas de control que posteriormente se extendieron a ciudades adyacentes[14]. Sin embargo, los casos continuaron aumentando rápidamente en todo el mundo, por lo que el 11 de marzo de 2020, la OMS declaró a COVID-19 como pandemia[15].
El 5 de febrero de 2020 en Yokoyama, Japón, un crucero llamado Diamond Princess, que albergaba a 3 711 personas, se sometió a cuarentena por dos semanas ya que se reportó un pasajero con COVID-19 después de desembarcar en Hong Kong. Desde el 16 de marzo[16] y hasta el 16 de abril de 2020[2], 712 personas habían sido reportadas positivas para la infección por SARS-CoV-2 y 12 habían muerto. La mayoría de las infecciones ocurrieron antes o muy próximas a la fecha de inicio de la cuarentena, lo que manifestó la potencial transmisión del virus, especialmente en sitios confinados. Con los datos reportados hasta el 21 de febrero (634 personas infectadas) Mizumoto y colaboradores[17] estimaron mediante un modelaje estadístico que la proporción de individuos asintomáticos entre aquellos que resultaron positivos para SARS-CoV-2 era de 17,9% (intervalo de confianza al 95%: 15,5 a 20,2%).
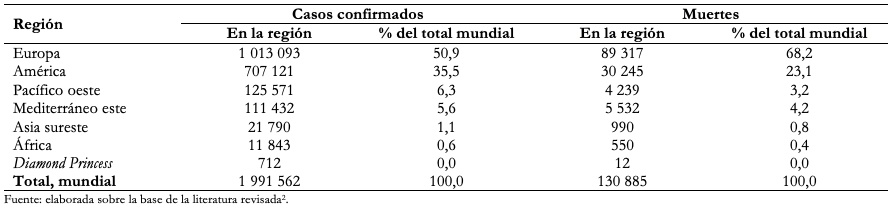
Hasta el 16 de abril de 2020, el virus había llegado a infectar a 1 991 562 personas y había ocasionado 130 885 muertes en el mundo (Tabla 1)[2].
 Tamaño completo
Tamaño completo Cuadro clínico
Los síntomas clínicos incluyen fiebre (83 a 98,6%), tos seca (47 a 82%), disnea (14 a 59%), mialgia o fatiga (11 a 44%), producción de esputo (20 a 28%), cefalea (6,5 a 16%), mareo (9,4%), dolor de garganta (5 a 17,4%), rinorrea o congestión nasal (4%), hemoptisis (5%), pérdida de apetito (18 a 39,9%), náusea y vómito (de uno a 10,1%), dolor abdominal (2,2%) y diarrea (3 a 14%)[3],[9],[18],[19]. Recientemente se ha reportado disfunción olfatoria en 85,6% y disfunción gustativa en 88% de los pacientes en población europea[20].
La mayoría de los casos han sido clasificados como moderados (81%) al no presentar neumonía o presentarla en forma leve, sin embargo 14% han sido severos y 5% críticos[21]. Los pacientes que requieren cuidados intensivos son de mayor edad (sobre 65 años) y con una mayor frecuencia de comorbilidad como hipertensión arterial sistémica (58,3%), diabetes (22,2%), enfermedad cardiovascular (25%) y enfermedad cerebrovascular (16,7%) (p < 0,05)[19].
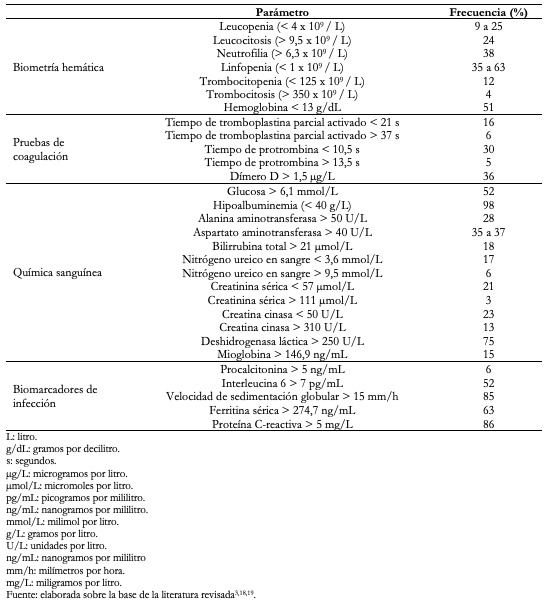
Los hallazgos en las pruebas de laboratorio de pacientes con COVID-19 se muestran en la Tabla 2. En pacientes que ingresan a la unidad de cuidados intensivos en comparación con quienes no lo hacen, se observa mayor conteo de leucocitos y de neutrófilos, pero menor conteo de linfocitos[19], mayor elevación del tiempo de protrombina y del dímero D[3],[19], mayor creatina quinasa banda miocárdica, deshidrogenasa láctica, alanino amino transferasa, aspartato amino transferasa, bilirrubinas totales, nitrógeno uréico en sangre y creatinina, así como mayor procalcitonina (p < 0,05)[19].
Qin y colaboradores[22] además reportaron disminución de células B, células T (en particular de las células T ayudadoras CD3+CD4 y supresoras CD3+CD8+) y células asesinas naturales, así como aumento de la relación neutrófilos/linfocitos y de los niveles de citocinas pro-inflamatorias (interleucinas -2R, IL-6, IL-8, IL-10 y factor de necrosis tumoral α), observándose mayor alteración en los casos más severos de la enfermedad, y en el caso de la relación neutrófilos/linfocitos se ha asociado con mayor mortalidad[23].
 Tamaño completo
Tamaño completo Respecto a los hallazgos radiológicos, las imágenes de tomografía computarizada de tórax al ingreso hospitalario han mostrado afectación bilateral pulmonar en 98% de los casos[3]. Se ha reportado opacidad en vidrio despulido pura (77%) y con patrón reticular y/o engrosamiento septal interlobular (75%), áreas subsegmentarias de consolidación (59%) y broncograma (80%). Otras características incluyen reticulación, derrame pleural, derrame pericárdico pequeño y linfadenopatía[24].
Las principales complicaciones reportadas incluyen progresión a síndrome de dificultad respiratoria aguda (19,6 a 29%), falla cardiaca aguda (7,2 a 12%), arritmia (16,7%), infección secundaria (12%), falla renal aguda (7%) y choque (8,7 a 7%)[3],[19]. La mayoría de los pacientes han sido tratados con diferentes esquemas de fármacos antivirales, antibióticos, glucocorticoides, α interferon, inmunoglobulinas y antimicóticos[25]. En 26% de los casos fue necesario el ingreso a la unidad de cuidados intensivos. Se ha descrito el uso de oxígeno de alto flujo en 11,1%, ventilación mecánica no invasiva en 44,4% y ventilación mecánica invasiva entre 10 y 47,2%, requiriendo terapia de rescate con membrana de oxigenación extracorpórea en cinco a 23% de los casos[3],[19].
El pronóstico en general ha sido hacia la recuperación, aunque la tasa de mortalidad total ha sido reportada en 2,3% con variaciones en función de la edad, siendo de 8% en pacientes de 70 a 79 años y de hasta 14,8% en mayores de 80 años. En pacientes con enfermedad crítica la tasa de mortalidad reportada es mucho mayor (49%), así como en pacientes con enfermedad cardiovascular (10,5%), diabetes mellitus (7,3%), enfermedad respiratoria crónica (6,3%), hipertensión arterial sistémica (6,0%) y cáncer (5,6%)[21].
Dinámica de la transmisión
Li y colaboradores[26] reportaron un tiempo de incubación del SARS-CoV-2 de 5,2 días (intervalo de confianza 95%: 4,1 a 7,0). Con datos obtenidos hasta el 4 de enero de 2020, estimaron una tasa de crecimiento en la curva epidémica de 0,1 por día (intervalo de confianza 95%: 0,050 a 0,16), con un tiempo de duplicación de 7,4 días (intervalo de confianza 95%: 4,2 a 14) y un número de casos esperado directamente producido por una persona en una población susceptible a infección (R0) de 2,2 (intervalo de confianza 95%: 1,4 a 3,9). Posteriormente, otro estudio mostró datos similares respecto al tiempo de incubación[27], por lo que se ha sugerido un periodo de cuarentena de 14 días. En cuanto al R0 en modelos más recientes se ha estimado un valor de 2,24 a 3,58[28] e incluso tan alto como 6,47; si se toman en cuenta las generaciones de transmisión viral y los contactos sociales intensivos[29].
Respecto al inicio y duración del periodo de contagiosidad, no está bien definido. Hay reportes de infecciones asintomáticas, es decir de detección del ácido ribonucleíco viral sin presencia de síntomas en 1% de los casos[21] y de infecciones presintomáticas, es decir detección del virus previo al desarrollo de síntomas[30]. El ácido ribonucleíco del SARS-CoV-2 ha sido detectado en muestras del aparato respiratorio alto y bajo, sangre y heces; con una duración de varias semanas, mientras que el virus ha sido aislado de muestras del aparato respiratorio alto, líquido de lavado bronquioalveolar y cultivos celulares de heces en algunos pacientes. Aún se desconoce si otros fluidos corporales de una persona infectada (vómito, orina, leche materna o semen) pueden contener SARS-CoV-2 viable e infeccioso[5].
Hasta el momento se sabe que el SARS-CoV-2 se dispersa de persona a persona, principalmente a través de gotas producidas por las vías respiratorias de individuos infectados que pueden llegar directamente o a través de superficies contaminadas a la boca, nariz y ojos, o ser inhaladas hacia los pulmones de otra persona. La transmisión es más probable cuando la distancia entre los sujetos es menor a dos metros, siendo fácil y factible la transmisión comunitaria en diversas áreas geográficas, aún sin que las personas conozcan cómo y dónde se infectaron[5]. Van Doremalen y colaboradores[31] mostraron que el SARS-CoV-2 puede permanecer viable e infeccioso por horas en aerosol y por días en las superficies (mayor estabilidad en plástico y acero inoxidable que en cobre y cartón), dependiendo del inóculo.
De esta manera, la transmisión en entornos asociados a la atención a la salud es una amenaza, tanto para pacientes que acuden a recibir atención médica como para el personal de salud. Wang y colaboradores[19] reportaron la sospecha de transmisión hospitalaria como mecanismo de infección en 29% de los profesionales de la salud afectados y en 12,3% de los pacientes hospitalizados, mientras que Wu y colaboradores[21]registraron que de 44 672 casos confirmados en China; 3,8% correspondían a trabajadores de la salud, de los cuales 14,8% presentaron enfermedad crítica y de estos 1,96% murieron.
Esta situación incrementa la preocupación sobre la presencia de infecciones en personal de salud, a pesar del aparente uso de equipo de protección personal. Sin embargo, debe tomarse en cuenta que el trabajador de salud puede estar expuesto al contagio antes del uso del equipo de protección personal, por lo que es muy importante la identificación y aislamiento oportunos de los casos sospechosos[14]. En el caso de los médicos anestesiólogos que están involucrados en procedimientos que generan aerosoles (intubación traqueal, ventilación no invasiva, traqueotomía, reanimación cardiopulmonar, ventilación mecánica antes de la intubación y broncoscopia), es trascendental revisar los diferentes escenarios y las medidas de protección que deben llevarse a cabo con la finalidad de reducir la transmisión del SARS-CoV-2.
Sistema de protección del personal de salud
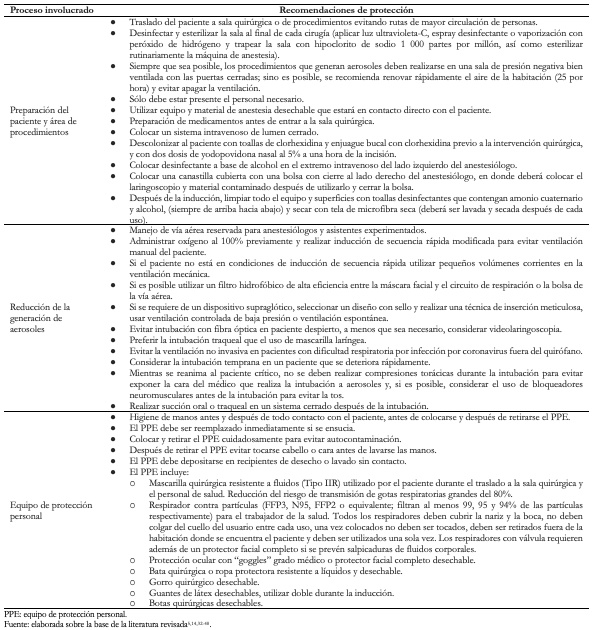
El equipo de protección personal es un componente importante del sistema de protección del personal de salud. Pero no el único, ya que además debe prepararse adecuadamente el área de realización de procedimientos médicos generadores de aerosoles, y deben establecerse estrategias para minimizar la generación de los mismos.
En la Tabla 3 se muestran las principales medidas o sugerencias a tomar en cuenta en los diferentes ámbitos del sistema de protección del personal de salud, y en la Tabla 4 los niveles del equipo de protección personal para trabajadores de la salud[5],[14],[32],[33],[34],[35],[36],[37],[38],[39],[40]. Cabe mencionar que dichas medidas deben ser tomadas en cuenta ante un paciente con sospecha o confirmación de infección por SARS-CoV-2, independientemente del tipo de procedimiento anestésico o quirúrgico que se pretende realizar. Además, es importante recalcar que ningún síntoma de COVID-19 en el personal de salud debe ser minimizado, por lo que deben ser evaluados inmediatamente para descartar infección por SARS-CoV-2 y establecer el manejo oportuno y adecuado.
 Tamaño completo
Tamaño completo 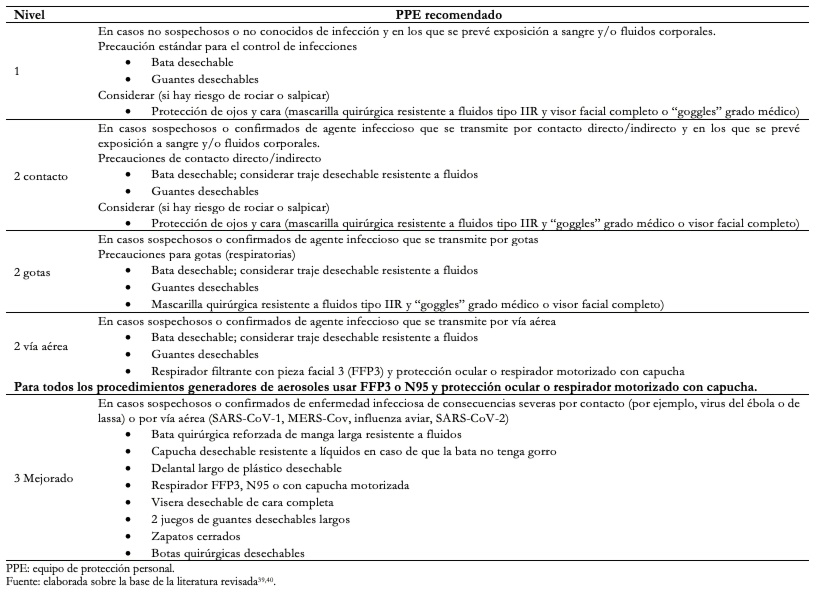 Tamaño completo
Tamaño completo Cirugía electiva y de urgencia
Actualmente existe una reorganización de los servicios quirúrgicos y anestésicos en todo el mundo, ya que además de existir pacientes que requieren manejo quirúrgico (en algunas ocasiones urgente o a corto plazo) con cuidado intensivo postoperatorio (cirugías mayores, incluyendo las cardiacas y oncológicas), también existe un gran número de pacientes con sospecha o confirmación de COVID-19 que ameritan atención hospitalaria e incluso ingreso a la unidad de cuidados intensivos[41]. Aún cuando cada colegio y sociedad han emitido sus propias recomendaciones al respecto, todos han coincidido en el aplazamiento no mayor a ocho semanas (de ser posible y tomando en cuenta las características del paciente y su enfermedad) de todas las cirugías electivas y esenciales, dadas las consideraciones etiopatológicas relacionadas con el trauma quirúrgico, la infección por SARS-CoV-2 y la presencia de comorbilidad.
Existe evidencia de la redistribución de linfocitos del área vascular al tejido linfático con subsecuente linfopenia y de la respuesta inmunológica producida por el trauma quirúrgico, al estimular la secreción de diversos mediadores inflamatorios que incluyen citocinas, especies reactivas de oxígeno, óxido nítrico, factor activador de plaquetas, factores de crecimiento y eicosanoides; los cuales a su vez activan a los leucocitos polimorfonucleares, células endoteliales, macrófagos y linfocitos, que podrían agravar una infección por SARS-CoV-2 o aumentar la susceptibilidad de los pacientes a infectarse[42].
En condiciones normales algunas citocinas funcionan como reguladoras de la inmunidad para limitar el daño o la respuesta inflamatoria excesiva, por lo que debe existir un equilibrio dinámico entre las citocinas pro y antiinflamatorias para evitar la disfunción orgánica e infección y, por lo tanto, reducir la morbilidad y mortalidad postoperatoria. Dicho equilibrio pudiera alterarse en pacientes con compromiso inmune asociado a la infección por SARS-CoV-2 caracterizado por incremento en la secreción de citocinas proinflamatorias descrita con anterioridad, particularmente de interleucinas 6, cuyos niveles se han observado significativamente elevados (un marcador asociado con severidad de pacientes críticos, aparición de falla orgánica y disfunción miocárdica durante la sepsis) en los pacientes con neumonía severa[22].
Los pacientes programados para cirugía durante el periodo de incubación del SARS-CoV-2, aunque en apariencia están sanos, no están libres de la infección por SARS-CoV-2 y por lo tanto ya inició la replicación viral y los cambios inmunológicos asociados. Lei y colaboradores[43] reportaron que en 34 pacientes sometidos a cirugía electiva durante el periodo de incubación de COVID-19, todos desarrollaron neumonía a corto plazo después de la cirugía, 44,1% requirieron ingreso a la unidad de cuidados intensivos y 20,5% murieron después de la admisión a la unidad de cuidados intensivos. En estos pacientes, las principales complicaciones fueron síndrome de dificultad respiratoria aguda, choque, arritmia y falla cardiaca aguda. Por ello, la cirugía puede acelerar o exacerbar la progresión de COVID-19.
Si bien, los pacientes en periodo de incubación del SARS-CoV-2 que ingresaron a la unidad de cuidados intensivos después de la cirugía fueron de mayor edad, estuvieron sometidos a cirugías más complicadas y presentaron mayor frecuencia de comorbilidad[18]; se recomienda que todo paciente programado para cirugía tenga un periodo de aislamiento de 14 días, o bien se excluya la infección en el paciente antes de ser considerado para cirugía electiva durante la pandemia de COVID-19[43].
En el caso pacientes con cirugía cardiaca, se ha reportado alteración en la expresión de la proteína de superficie de monocitos HLA-DR (implicada en la respuesta a patógenos) e inhibición de las funciones monocíticas y dendríticas, factores asociados con mayor estancia en la unidad de cuidados intensivos y mayor mortalidad en casos de infección severa[42], que al agregarse al riesgo de infección por SARS-CoV-2, podrían ser catastróficos para los pacientes.
En cuanto a los pacientes oncológicos, se ha sugerido un incremento en el riesgo a desarrollar infección severa por SARS-CoV-2, probablemente por la inmunodepresión asociada. Liang y colaboradores[44] reportaron que 75% de los pacientes con neoplasia que fueron operados o tratados un mes previo a la infección por SARS-CoV-2 presentaron enfermedad severa.
Por otro lado, algunos marcadores asociados a mal pronóstico en pacientes oncológicos, también lo son en pacientes con COVID-19, lo que genera mayor preocupación. Por ejemplo, en pacientes con cáncer colorectal una relación neutrófilos/linfocitos mayor a 2,8 incrementa el riesgo de complicaciones postoperatorias a dos años (Hazard ratio: 5,36; intervalo de confianza 95%: 1,95 a 14,90)[45]; mientras que en pacientes con COVID-19 una relación neutrófilos/linfocitos elevada es un factor de riesgo independiente para la mortalidad hospitalaria[23].
En cuanto a los procedimientos quirúrgicos urgentes y emergentes (incluyendo procedimientos quirúrgicos superficiales y periféricos), así como ciertos procedimientos diagnósticos, estos pueden ser realizados en áreas de cirugía ambulatoria disponibles o acondicionadas en áreas alejadas de los servicios de urgencias y terapia intensiva. Se incluyen los relacionados con trauma (fracturas, luxaciones, reparaciones tendinosas, síndrome compartimental y drenajes de abscesos o hematomas), los relacionados con cáncer (diagnósticos o terapéuticos), los procedimientos urológicos con el potencial de progresión a obstrucción/infección o dolor severo que amerite hospitalización, o incluso ciertos procedimientos intraabdominales emergentes (por ejemplo, apendicectomía y colecistectomía). Dichos procedimientos deben ser realizados en pacientes sin sospecha clínica de COVID-19 y, de ser posible, negativos a infección por SARS-CoV-2 confirmada por reacción en cadena de la polimerasa. Si el paciente es sospechoso o diagnosticado con COVID-19 o el procedimiento a realizar pone en peligro la vida del paciente, debe ser manejado dentro del quirófano del hospital siguiendo los protocolos específicos de cada paciente y condición[41].
Intubación orotraqueal y ventilación
Aproximadamente 3,2% de los pacientes con COVID-19 requieren intubación y ventilación invasiva en algún momento del curso de la enfermedad, particularmente cuando se incrementa la hipoxemia a pesar de la terapia con oxígeno de flujo alto y la ventilación con presión positiva no es suficiente. Por otro lado, aunque las cirugías electivas se aplazan, pueden surgir cirugías de emergencia (incluyendo cesáreas) en pacientes con sospecha o confirmación de COVID-19, que ameritan anestesia general con intubación endotraqueal. Ambas situaciones exigen medidas de auto protección para el personal de salud, así como la adecuada preparación y manejo de la vía aérea de los pacientes[46].
En general, la decisión para intubar es inmediata ante la presencia de falla cardiopulmonar o pérdida/compromiso de la vía aérea. Sin embargo, en pacientes con falla respiratoria aguda e hipoxemia secundaria a infección por SARS-CoV-2, debe realizarse una monitorización estrecha para identificar signos de deterioro respiratorio y llevar a cabo una intubación electiva más que emergente[38]. La preparación para la intubación debe iniciar cuando la saturación de oxígeno es inferior a 93% y la relación presión arterial de oxígeno/fracción inspirada de oxígeno es inferior a 300 milímetros de mercurio/%[46] y la decisión de intubar se toma inmediatamente cuando no hay mejoría de la dificultad respiratoria, taquipnea (frecuencia mayor a 30 por minuto) y pobre oxigenación (relación presión arterial de oxígeno/fracción inspirada de oxígeno inferior a 150 milímetros de mercurio/%) después de dos horas con oxígeno a flujo alto o ventilación mecánica no invasiva[47].
Meng, y colaboradores[46] sugieren el acrónimo OH-MS MAID correspondiente a Oxígeno, Helpers (ayudantes disponibles), Monitor, Succión, Máquina, Airway supplies (video-laringoscopio, laringoscopio directo, etc.), acceso Intravenoso, Drugs (medicamentos), para facilitar la preparación de la intubación en pacientes con sospecha o confirmación de COVID-19.
Se ha sugerido la administración de ventilación no invasiva tres minutos antes de la intubación como método de preoxigenación, para después realizar una inducción de secuencia rápida modificada[37],[48]. Se recomienda compresión o desplazamiento cricoideo cuando la exposición de las cuerdas vocales es díficil o el tiempo de ayuno del paciente se desconoce[37]. En pacientes extremadamente ansiosos se puede considerar midazolam a dosis de uno a dos miligramos, mientras que la lidocaína intravenosa de 1,5 miligramos por kilogramo o más, puede ser efectiva para suprimir la tos durante la intubación[46],[49]. Para la inducción en pacientes con inestabilidad hemodinámica se recomienda etomidato (de 0,2 a 0,3 miligramos por kilogramo) y para pacientes estables propofol (de uno a 1,5 miligramos por kilogramo).
Inmediatamente después de la pérdida de la consciencia, se recomienda utilizar rocuronio de uno a 1,2 miligramos por kilogramo o succinilcolina de un miligramo por kilogramo[46],[50]. Para suprimir el reflejo laríngeo y optimizar la intubación puede administrarse fentanilo de 50 a 100 microgramos, sufentanilo de 10 a 20 microgramos o remifentanilo de 2,5 microgramos por kilogramo[46]. Después de la intubación se sugiere verificar el éxito de la misma mediante capnografía, nebulización dentro del tubo, evaluación de movimientos torácicos, saturación de oxígeno y color de las mucosas del paciente, evitando la auscultación del tórax[37],[46].
Ante la falla de la intubación, en pacientes COVID-19 sospechosos o confirmados, no se recomiendan más de dos intentos para intubar (modificando la posición, equipo y técnica entre intentos) dado el riesgo de dispersión viral, por lo que debe insertarse una mascarilla laríngea e incluso considerar la traqueotomía con las debidas precauciones[37],[50]. Si es necesaria la intubación traqueal en paciente despierto, esta debe ser realizada por un experto y debe administrarse sedación intravenosa para minimizar la tos[50].
Se recomienda la utilización de volúmenes corrientes pequeños durante la inducción, hasta que el paciente este intubado. Posteriormente, las guías para la ventilación protectora pulmonar en pacientes con síndrome respiratorio agudo grave sugieren un volumen corriente inferior o igual a seis mililitros por kilogramo de peso, frecuencia respiratoria inferior o igual a 35 por minuto, presion meseta inferior o igual a 30 centímetros de agua y presión positiva al final de la espiración mayor o igual a cinco centímetros de agua[46]. Se recomienda la ventilación en posición prona por lo menos 12 horas al día para mejorar la mecánica pulmonar y el intercambio gasesoso[46],[51].
Aun cuando se ha sugerido el uso de ventilación oscilatoria de alta frecuencia en pacientes con daño pulmonar por infecciones virales, en el caso de infección por SARS-CoV-2 no se recomienda dicha estrategia dada la cantidad de aerosoles que genera. Respecto a la oxigenación por membrana extracórporea, se han reportado algunos casos en los que se ha utilizado. No obstante, se recomienda su uso sólo en centros con experiencia y capacidades técnicas apropiadas[51].
En cuanto a la extubación después de la anestesia general o cuando el estado clínico del paciente lo amerita, debe efectuarse de forma similar a la intubación. Esto significa, por anestesiológos expertos y con el personal mínimo necesario en la sala, además del uso de equipo de protección personal (incluyendo colocación de doble guante)[14]. También se ha sugerido colocar una gasa húmeda sobre la nariz y boca del paciente justo antes de la extubación y utilizar lidocaína intravenosa para evitar la tos[47],[48]. Después de la extubación, se recomienda colocar al paciente una mascarilla quirúrgica y oxígeno suplementario a través de mascarilla plástica.
Anestesia general versus anestesia regional
Una de las decisiones más importantes que debe tomar el médico anestesiólogo es el tipo de anestesia que le otorgará a cada paciente, dadas sus características clínicas y los posibles resultados postoperatorios. Esta decisión, ante la pandemia de COVID-19, requiere tomar en consideración la seguridad del personal médico que interviene en la cirugía y anestesia.
La selección de anestesia general implica el uso de dos procedimientos médicos generadores de aerosoles, la intubación orotraqueal y la extubación, los mismos que incrementan el riesgo de infección cruzada con un Odds ratio de hasta 6,6 para la transmisión de infección respiratoria aguda de los pacientes a profesionales de la salud[52].
Por otro lado, la anestesia regional tanto central como periférica, además de evitar la manipulación de la vía aérea, produce un mejor control del dolor postoperatorio, reduce el consumo de opioides, mejora la disfunción cognitiva postoperatoria y, por lo tanto, reduce la incidencia de náuseas y vómito (generador de aerosoles que potencialmente pueden contaminar al personal sanitario)[33],[34]. En pacientes con COVID-19, cuya función pulmonar puede estar comprometida por la neumonía y el síndrome de disfunción respiratoria, la anestesia regional, al no alterar la mecánica ventilatoria, reduce las complicaciones postoperatorias. La evidencia actual, en pacientes con infección por SARS-CoV-2, muestra que la anestesia regional ha logrado mantener una mecánica ventilatoria adecuada sin aumentar la necesidad de cuidados respiratorios postoperatorios. Tampoco se han reportado defunciones en pacientes en quienes se utilizó (aun cuando se tratara de procedimientos urgentes)[34]. Por lo que aquellos pacientes cuya cirugía pueda ser realizada con anestesia regional, deben ser manejados con esta técnica. De lo contrario, se deberá administrar anestesia general teniendo en cuenta los riesgos y tomando todas precauciones necesarias.
Anestesia regional
Para la realización de procedimientos de anestesia regional, tanto centrales como periféricos, se debe tener presente que quien debe realizarlos es el medico anestesiólogo con mayor experiencia. Esto, con el fin de evitar lo más posible la conversión de una técnica regional a anestesia general, ya que una intubación urgente en el contexto de la pandemia por COVID-19 puede ser más compleja que en el ámbito normal. La planificación es un aspecto muy importante, por lo que deben tomarse en cuenta los tiempos de duración de la anestesia y cirugía. Es mejor realizar una intubación planeada al inicio del procedimiento con todas las medidas de protección y sin prisas, ni más dificultades, que una intubación de emergencia.
En los pacientes con COVID-19 no se recomienda reducir las dosis de anestésicos locales, ni dejar fluir el líquido cefalorraquídeo por el riesgo de contaminación del personal. También debe tenerse presente que la realización de procedimientos adicionales aumentan el riesgo de contaminación cruzada, por lo que ante la presencia de sospecha o confirmación de infección por SARS-CoV-2 (sin olvidar que en la fase de dispersión comunitaria se debe asumir que todos los pacientes son positivos); si se puede utilizar analgesia postoperatoria intravenosa, deben evitarse los bloqueos periféricos y la colocación de catéteres epidurales, ya que se requiere mayor contacto con los pacientes al vigilar esta modalidad analgésica.
Anestesia espinal y epidural
Durante la pandemia de COVID-19 se han reportado diversas series de casos, principalmente cesáreas de urgencia, manejados con bloqueo subaracnoideo y/o bloqueo epidural, aunque no son los únicos procedimientos reportados que se han realizado bajo anestesia espinal.
Chen y colaboradores[53] reportaron 17 pacientes con COVID-19 que presentaban datos de neumonía en la tomografía de tórax, sin trombocitopenia, pero con hipotensión importante en el 86% de los casos, que fueron sometidas a cesárea con bloqueo epidural con técnica estándar, en donde no se observaron complicaciones ni sintomatología secundaria en el postoperatorio y la mayoría fueron dadas de alta entre los seis y 13 días postoperatorios. Respecto al personal de salud, no reportaron ningún caso de contagio de SARS-CoV-2 entre los 10 anestesiólogos que intervinieron en las 17 cesáreas.
Xia H y colaboradores[54] reportaron un caso de bloqueo subaracnoideo con técnica estándar para una cesárea de emergencia, en donde la paciente con infección por SARS-CoV-2 presentaba datos de neumonía en la tomografía de tórax, saturación de oxígeno de 92 a 93% y pruebas de coagulación normales. La cirugía se realizó sin contratiempos, salvo por la presencia de tos, hipotensión transitoria y taquicardia (mayor a 138 latidos por minuto) durante la cirugía. La analgesia postoperatoria se efectúo a través del catéter epidural insertado. La paciente y el recién nacido fueron negativos a infección por SARS-CoV-2 al tercer y quinto día de la cirugía y ninguno de los médicos que intervinieron en el procedimiento resultó infectado.
Zhong Q y colaboradores[55] reportaron el uso de anestesia espinal, específicamente bloqueo subaracnoideo, en 49 pacientes con datos clínicos y radiológicos de COVID-19 y confirmación infección por SARS-CoV-2 mediante transcripción reversa-reacción en cadena de la polimerasa en 26,5% de los casos en quienes se realizó cesárea o cirugía ortopédica de urgencia. Todos los pacientes presentaban síntomas respiratorios leves, 53,1% fiebre y ninguno presentó trombocitopenia. Previo a la anestesia espinal se administraron antieméticos profilácticos, sin embargo, el 6,1% de los casos presentó vómito. Todos los pacientes tuvieron una adecuada evolución clínica y postoperatoria, ya que ninguno desarrolló neumonía severa o falleció por COVID-19.
Respecto al personal de salud, posterior a la administración de los bloqueos subaracnoideos en los que participaron 44 anestesiólogos, cinco de ellos fueron positivos para infección por SARS-CoV-2. Al analizar el tipo de equipo de protección personal que utilizaron, se observó que cuatro de los siete anestesiólogos que utilizaron equipo de protección personal categoría 1 (57,1%) y sólo uno de los 37 anestesiólogos que utilizaron equipo de protección personal categoría 3 (2,7%) se infectaron, por lo que el uso de equipo de protección personal categoría 3 muestra una reducción del riesgo relativo de 95,3% (intervalo de confianza 95%: 63,7 a 99,4).
En general, la mayoría de los autores coinciden en que las técnicas regionales producen menor riesgo, tanto para los pacientes como para el personal sanitario; siempre y cuando se tomen en consideración las condiciones clínicas de cada paciente y las medidas de protección personal.
Bloqueo de nervios periféricos
Si se realiza bloqueo de nervios periféricos guiado por ultrasonido, debe protegerse todo el equipo (transductor, pantalla y teclado). En el caso del transductor pueden utilizarse fundas plásticas de cámaras. Para el equipo se pueden utilizar las bolsas transparentes para cobertura de los fluoroscopios ya que, además de protegerlo, permite la manipulación adecuada de los controles y la visualización de la imagen.
La sedación debe administrarse juiciosamente (ya que los pacientes con infección por SARs-CoV-2 presentan una función pulmonar limitada). Se recomienda la utilización de mascarillas faciales tipo Hudson teniendo la precaución de utilizar el menor flujo de oxígeno posible para mantener una saturación adecuada, ya que las distancias de dispersión del aire exhalado aumentan con el incremento del flujo de oxígeno (distancias laterales de 0,2; 0,22; 0,3 y 0,4 metros desde el plano sagital durante el suministro de oxígeno a 4; 6; 8 y 10 litros por minuto respectivamente), siempre monitoreando el dióxido de carbono expirado.
No se recomienda el uso de puntas nasales debido a la posible aerolización con el flujo de oxígeno[56]. En la medida de lo posible, se deben evitar los bloqueos periféricos que puedan reducir la capacidad pulmonar, como el bloqueo interescalénico que potencialmente puede producir hemiparesia diafragmática, o los que pueden generar neumotórax, entre los que se incluyen el bloqueo supraclavicular y el bloqueo infraclavicular. Si se decide utilizarlos, hay que valorar el riesgo-beneficio reduciendo la dosis de anestésicos locales, el volumen o ambos; y siempre ecoguiados, tratando de no afectar la mecánica ventilatoria. Asimismo, se debe considerar que pueden presentarse las complicaciones habituales de estos procedimientos y que puede requerirse la manipulación de la vía aérea, para lo cual se debe contar con el material y equipo necesario.
Conclusiones
La pandemia de COVID-19 ha llevado a un replanteamiento de los sistemas de salud, ya que actualmente el número de casos se incrementa constantemente, sin que haya la suficiente capacidad hospitalaria, insumos o recursos humanos para su atención.
Los anestesiólogos, al ser expertos en el manejo de la vía aérea, se enfrentan a una sobrecarga de trabajo. Por un lado, el constante incremento de pacientes infectados por SARS-CoV-2 que ameritan intubación y ventilación mecánica. Por otro, los pacientes con patologías que por su gravedad ameritan intervenciones quirúrgicas a corto plazo, sino es que en forma emergente o urgente. Sin embargo, aun cuando las actividades clínicas llegan a ser extenuantes, el personal de salud no ha dejado de transmitir su experiencia y los resultados de la constante investigación clínica y molecular, la que efectúan día a día para tratar de mejorar el cuidado y la atención de los pacientes que sufren de una enfermedad, que hasta hace algunos meses era desconocida y que en ciertos casos puede resultar fatal.
El conocimiento disponible hasta el momento ha llevado a efectuar la recomendación de aplazar las cirugías electivas por no más de seis a ocho semanas de acuerdo a las condiciones clínicas de los pacientes. En el caso de las cirugías de urgencia o emergencia, se sugiere establecer una serie de estrategias para la autoprotección del personal en salud y para el cuidado y manejo óptimo de los pacientes, dado el riesgo que implica la realización de algunos procedimientos médicos.
Sin duda, la evidencia que surge todos los días en diversos lugares del mundo será de gran utilidad para los profesionales de la salud que están enfrentando situaciones similares, o están por enfrentarlas, sin olvidar que cada nueva experiencia y cada nuevo hallazgo puede reforzar o bien refutar las recomendaciones y lineamientos disponibles hasta el momento.

