Suplementos
← vista completaPublicado el 1 de julio de 2003 | http://doi.org/10.5867/medwave.2003.06.1721
El concepto de terapia de "descalación"
The concept of "de-escalation" therapy
Resumen
Simposio Satélite Merck, Sharp & Dohme. Realizado en Iquique, 8 de octubre de 2002, en el marco del Congreso de Medicina Intensiva de América del Sur.
Presidente de Sala: Dr. Sergio Gálvez
Secretario de Sala: Dr. Raúl Romero.
El término” terapia de de-escalación” o descalation se refiere a una estrategia terapéutica en infección grave, definida esta última como una sepsis con compromiso orgánico. Al elegir una terapia, se deben considerar los agentes infecciosos, la resistencia antibiótica local, el costo y los mecanismos de acción y administración del fármaco. Los estudios han mostrado que se reduce la mortalidad si se comienza con una terapia empírica más amplia y apropiada y luego, con conocimiento del agente causal, se reduce al antimicrobiano más especifico.
En la comunidad, los agentes que se encuentran con más frecuencia son Streptococcus pneumoniae, Staphylococcus aureus, anaerobios, en ocasiones Lysteria monocytogenes, gramnegativos como las enterobacterias, Haemophylus influenzae y algunos hongos. En el entorno nosocomial hay patógenos más complejos: Staphylococcus epidermidis, Staphylococcus aureus y enterococcus, sobre todo en patología postquirúrgica; y gramnegativos como enterobacterias multirresistentes. También se observan algunos patógenos exclusivos de unidades de alta complejidad, como Acinetobacter y Pseudomonas.
Algunos patógenos progresivamente adquieren resistencia específica y se debe conocer los grados de resistencia de las cepas locales. En Chile, se ha detectado aumento en la resistencia de Haemophylus influenzae tanto en infecciones invasoras como respiratorias; de Streptococcus pneumoniae en infecciones respiratorias; y resistencia de 70% de la E. Coli a la ampicilina. En vista de lo anterior, al elegir un antimicrobiano se debe preferir los antibióticos bactericidas, buscando asociación sinérgica, administración endovenosa, el mayor espectro posible, baja toxicidad, bajo potencial de desarrollo de resistencia, perfíl farmacocinético favorable y buena relación costo-beneficio.
Introducción
El objeto de esta exposición es aclarar un poco este término especial de la terapia de “de-escalación”, cuya génesis es un poco difícil de entender. En primer lugar, el concepto que desarrolló el laboratorio Merck Sharp and Dhome en relación con esta estrategia terapéutica, fue discutido largamente en enero de este año, entre especialistas internacionales, en Miami; posteriormente, hubo una reunión sólo de especialistas latinoamericanos para traerlo a una realidad un poco más local. Se presentarán algunas cifras referidas a las características y a la resistencia de algunos grupos específicos de patógenos que se pueden encontrar en América Latina y en Chile.
La principal indicación de esta terapia es la infección grave. Cuando se plantea una terapia agresiva de inicio, nacen varias dudas, entre ellas: ¿quiénes serán los beneficiados? ¿Será adecuado aplicar esta estrategia en un paciente que tiene una infección grave, pero por patógenos relativamente sensibles, como los comunitarios? Si se inicia una terapia agresiva y luego se suspende, porque se trata de un patógeno sensible, ¿se va a generar resistencia con estos 2 ó 3 días de tratamiento? Estas fueron las preguntas que se intentó responder en la reunión de Miami.
Infección grave
La definición operativa de infección severa es una sepsis con compromiso orgánico (Tabla I).
 Tamaño completo
Tamaño completo Desde el inicio del daño más profundo endotelial y microvascular, con el consiguiente compromiso de la perfusión, hasta el momento de la muerte, hay alternativas de tratamiento las que se debe intentar aplicar precozmente en estos cuadros.
Las infecciones graves adquiridas en la comunidad son las neumonías graves, la sepsis de foco urinario, las infecciones intraabdominales, los cuadros meníngeos, las infecciones de piel y tejidos blandos, y las infecciones en pacientes inmunocomprometidos.
El grupo en que se ha centrado el interés es el de los pacientes con infecciones nosocomiales, sobre todo bacteremias relacionadas a catéteres, neumonías asociadas o no con ventilación mecánica, sepsis postquirúrgica, infecciones del politraumatizado, sepsis de foco urinario nosocomial, meningitis postquirúrgica, infecciones en inmunocomprometidos e infecciones por hongos.
Agentes causales y aparición de resistencia
En la comunidad, los agentes que se encuentran con más frecuencia en las infecciones graves son los mismos de siempre: Streptococcus pneumoniae, Staphylococcus aureus, anaerobios y, en ocasiones, Lysteria monocytogenes. En cuanto a los gramnegativos, están las enterobacterias, Haemophylus influenzae y algunos hongos. Respecto a estos últimos, en otros países latinoamericanos es más evidente su presencia, con algunas importantes endemias que en Chile no hay; pero sí son importantes algunos casos de candidiasis, criptococosis e infecciones por Aspergillus sp.
En el entorno nosocomial se encuentran patógenos un poco más complejos, con la aparición más importante de Staphylococcus epidermidis y S. Aureus meticilina resistentes, enterococcus (sobre todo en patología postquirúrgica) y gramnegativos, como enterobacterias (pero con patrones de resistencia mayores) y algunos patógenos exclusivos de unidades de alta complejidad, como Acinetobacter y Pseudomonas. Por supuesto, uno de los actores más importantes en el último tiempo es la Candida albicans (Tabla II).
 Tamaño completo
Tamaño completo Aparte de lidiar con diferentes patógenos en la comunidad y en el hospital, estos van adquiriendo resistencia específica; por ejemplo, en la comunidad se encuentra el neumococo resistente a penicilina. Esta situación es particularmente frecuente en algunos países latinoamericanos y en Europa. Incluso ya se han detectado en la comunidad 1 a 3% de S. Aureus resistentes a la oxacilina. En cuanto a gramnegativos, hay algunas cepas de meningococos resistentes a la penicilina, así como resistencia de la E. Coli secundaria al uso indiscriminado de antibióticos para tratar infecciones urinarias, y resistencia a cotrimoxazol por parte de la Shigella.
En el ambiente nosocomial se ven mayores problemas, con S. Aureus resistente a la oxacilina y, en la actualidad, incluso, a la vancomicina, como sucede con algunas cepas de enterococo, lo que ha obligado a formular antibióticos para tratar de resolver este problema; el gran grupo de bacilos gramnegativos productores de betalactamasas de espectro extendido que son capaces de defenderse prácticamente contra todos los antibióticos, en particular la Klebsiella; y los patrones de resistencia que desarrollan Acinetobacter y Pseudomonas. Esta es la situación que se debe enfrentar.
Los datos extraídos de estudios latinoamericanos señalan que los patógenos son básicamente los mismos. En infecciones respiratorias, S. Pneumoniae; urinarias, E. Coli; e intestinales, Shigella, Salmonella y, ocasionalmente, Vibrio cholerae.
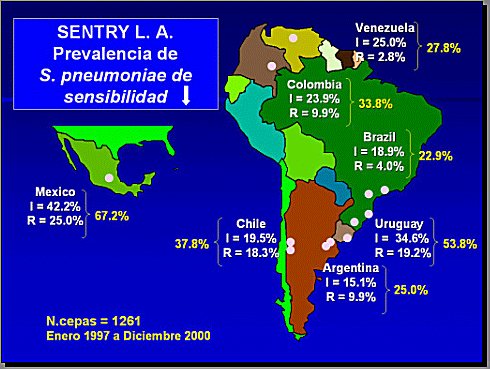
El programa de vigilancia de susceptibilidad antibiótica informa que, con el paso del tiempo, la eficacia de antibióticos que pudieron haber tenido alguna vez una muy buena sensibilidad ha ido decayendo lentamente, como el caso concreto de S. Pneumoniae, con altos porcentajes de resistencia a penicilina (Figura 1). En Chile esta situación todavía no es tan categórica; es mucho más frecuente la aparición de este fenómeno en niños, afortunadamente con categorías de resistencias de nivel intermedio o bajo.
Los datos de aparición de resistencia en patógenos nosocomiales, obtenidos en varias localidades de América Latina, demuestran que los problemas son comunes, en cuanto a bacteremias por S. aureus, E. coli, Staphylococcus coagulasa (-) y enterobacterias. En el caso de las neumonías nosocomiales, están Pseudomonas y S. Aureus; en el caso de herida operatoria, S. aureus y E. Coli; y en el caso de infección del tracto urinario, nuevamente los gramnegativos.
En cuanto a los patrones de resistencia que se han detectado en Chile, la resistencia de Haemophilus influenzae, en infecciones tanto invasoras como respiratorias, en algunos casos alcanza entre 15% y 18%. En el caso de Streptococcus pneumoniae, en infecciones respiratorias, ya hay casi 40% de resistencia. En 2001 se detectó, mediante el Programa de Vigilancia de Resistencia, 70% de resistencia de la E. Coli a la ampicilina (Figura 2).
 Tamaño completo
Tamaño completo 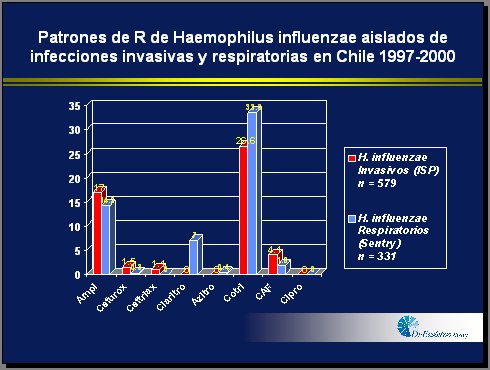 Tamaño completo
Tamaño completo Esta es la situación que es preciso enfrentar: probablemente, infecciones graves de la comunidad e infecciones graves del nosocomio, que van a presentar a un paciente complejo. ¿Qué estrategias se le van a ofrecer? Es preciso optimizar los métodos de diagnóstico clínico y microbiológico, conocer la realidad bacteriológica y tomar cultivo a todo paciente con sospecha de infección. Se le va a ofrecer manejo de soporte progresivo que corresponda a la unidad de cuidados intensivos; todo lo que significa el manejo hemodinámico, con volúmenes y drogas vasoactivas; el manejo respiratorio, con las nuevas modalidades de ventilación mecánica; terapias de soporte renal y novedades en el apoyo nutricional, sedación y analgesia. Asimismo, cuando sea necesario, se ofrecerá al paciente cirugía, con drenaje de foco y colecciones, y terapia antimicrobiana. Por último, también se puede modular la respuesta inflamatoria, emplear esteroides pero con otro enfoque, indicar la proteína C recombinante, y usar precozmente inmunoglobulinas endovenosas, sobre todo en infecciones por grampositivos.
Terapia apropiada frente a terapia inapropiada
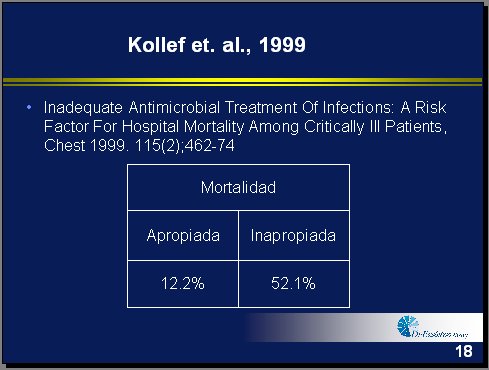
Las alternativas para enfrentar una infección grave son la terapia antibiótica apropiada o la terapia antibiótica inapropiada. La terapia inapropiada inicial se define como un esquema que no cubre los patógenos causales o los cubre pero la dosis es inadecuada. Las diferencias de mortalidad son significativas entre ambos tipos: con las terapias inapropiadas, 52% de mortalidad; con las terapias apropiadas, 12% (2) (Tabla III).
 Tamaño completo
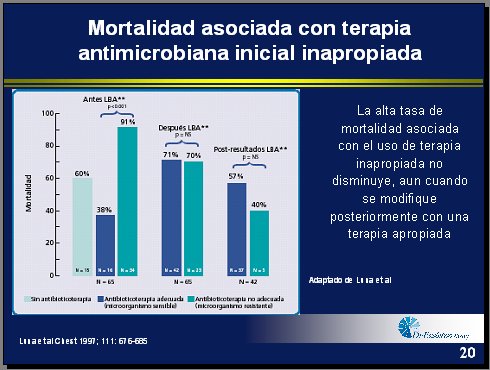
Tamaño completo Según Luna y cols., si se comienza con una terapia empírica y, después de obtener el resultado de los cultivos con un lavado broncoalveolar, se pasa a un antibiótico apropiado, no se logra cambiar la mortalidad (Figura 3) (3). Por tanto, con la terapia clásica, los dos o tres primeros días de tratamiento se pierden. Esto demuestra que no se logra revertir la alta tasa de mortalidad, aunque se cambie después a una terapia adecuada, de manera que el concepto es partir desde el principio con la terapia adecuada.
 Tamaño completo
Tamaño completo 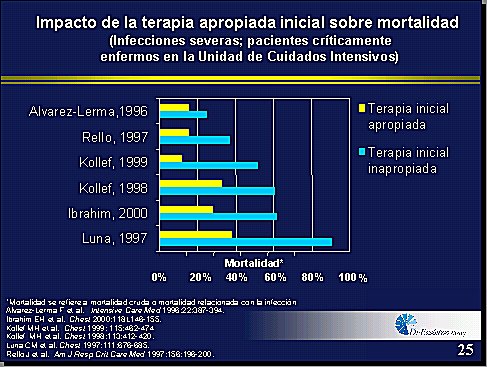 Tamaño completo
Tamaño completo En este caso, la terapia apropiada es una terapia empírica de amplio espectro, que se inicia ante la primera sospecha de infección grave y que garantiza que se cubran todos los microorganismos causales más probables. En esta situación, se debe elegir una terapia en función de las características del paciente, la localización de la infección, los factores de comorbilidad del paciente, el conocimiento de la epidemiología local y los patrones de resistencia.
La presencia de Acinetobacter varía en las distintas unidades de cuidados intensivos: en algunas de ellas es un dolor de cabeza difícil de manejar y, en otras, un patógeno erradicado por largo tiempo. Por ese motivo, la decisión de cubrir o no Acinetobacter va a depender de la prevalencia que tenga en esa institución determinada. También se debe estar al tanto de las características farmacodinámicas del tratamiento elegido, de manera que el antibiótico efectivamente llegue a la zona de infección. Algunas localizaciones son de muy difícil acceso, por ejemplo, mientras que algunos fármacos no atraviesan la barrera hematoencefálica, entre otros factores a considerar.
Ventajas de la terapia adecuada
¿Cuál es el efecto de utilizar una terapia adecuada? Hay efecto en la mortalidad, en costos y en la ecología. Las tasas de mortalidad claramente se reducen (trabajos de Luna, Namias, etc.) (Figura 4) (2,3,4,5,6,7). En términos de costo, la estadía intrahospitalaria es más corta y se reducen los días de tratamiento. Esto último es importantísimo, porque cuanto antes se rescate al paciente de su infección, mayor probabilidad se tendrá de evitar la aparición de complicaciones que van a surgir tardíamente. Si ese paciente sale de la UTI antes de los 10 a15 primeros días, se evita una serie de gastos posteriores, sobre todo en materia de sobreinfecciones, deterioro progresivo de órganos, necesidad de terapias como diálisis, etc. Por último, desde el punto de vista ecológico, la utilización adecuada de los antibióticos implicará menor probabilidad de surgimiento de resistencia bacteriana.
Los pacientes cuya evolución es rápidamente fatal, van a morir, hágase lo que se haga, pero los pacientes cuya evolución no es rápidamente fatal son los que determinan la enorme diferencia en términos de mortalidad, y ese grupo de pacientes es el que hay que rescatar precozmente (8) (Tabla IV).
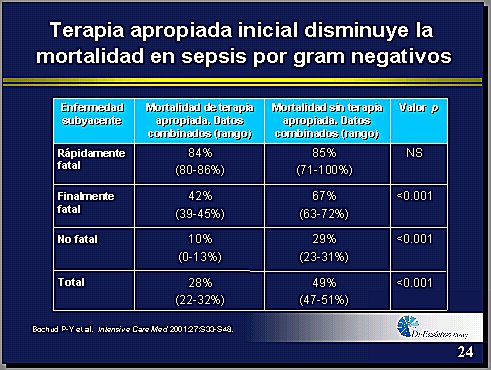 Tamaño completo
Tamaño completo Terapia de “de-escalación” (de-escalation therapy)
¿Qué significa de-escalación? Significa que si se actúa con un antibiótico de amplio espectro desde el momento preciso, cuando llegue el cultivo, dependiendo del estado del paciente, se puede bajar a un antibiótico de menor espectro e incluso suspender si no se demuestra la presencia de infección. La tendencia es a mantener el antibiótico, ya que son pacientes tremendamente complejos, pero si se quiere volver atrás, es decir, “desescalar”, no se provocarán problemas en términos de resistencia, pero se habrán ganado tres o cuatro días en términos de mortalidad.
¿Quiénes son los más beneficiados? El consenso del grupo de trabajo de Quito está orientado a pacientes con infecciones de origen nosocomial, particularmente en unidades de cuidados intensivos, sepsis graves sin foco conocido, infecciones polimicrobianas, imunocomprometidos, postquirúrgicos con comorbilidad grave, antibioticoterapia previa, patógenos multirresistentes, entre otros. Se trató este tema en el Congreso de Medicina Intensiva de Barcelona, y el consenso fue que la terapia de “de-escalación” es una alternativa terapéutica válida, apoyada en evidencia bastante sólida en la unidad de cuidado intensivo, que también debe ser considerada en pacientes de la comunidad.
Al elegir el antimicrobiano se da preferencia a los bactericidas y se busca asociación sinérgica, administración endovenosa, el mayor espectro posible, baja toxicidad, bajo potencial de desarrollo de resistencia, perfil farmacocinético favorable y buena relación costo-beneficio global. ¿Cuáles son los antibióticos que cumplen mejor estos requisitos? Los betalactámicos, sobre todo las cefalosporinas de cuarta generación; los betalactámicos asociados con inhibidores de betalactamasas; los monobactámicos, como el aztreonam, que se usa en los Estados Unidos, pero que se dejó de usar en Chile porque no tuvo buenos resultados; y los antibióticos con mayor espectro conocido hasta el momento, que son los carbapenémicos, con o sin asociación de aminoglicósidos; y fluoroquinolonas, dependiendo de la realidad local, con o sin asociación de glicopéptidos.
Para concluir, la terapia de “de-escalación” consiste en iniciar la terapia de amplio espectro lo más precozmente posible, sin tener miedo a la selección de cepas resistentes. No hay generación de cepas resistentes si la terapia empírica se utiliza por un tiempo corto y posteriormente se cambia. Es una terapia dirigida a salvar vidas.

