Suplementos
← vista completaPublicado el 1 de julio de 2008 | http://doi.org/10.5867/medwave.2008.06.510
Nuevos horizontes en el tratamiento de la hipertensión: modulación farmacológica de la renina plasmática
New horizons in the treatment of hypertension: pharmacological modulation of plasma renin
Resumen
Este texto completo es una transcripción editada y revisada de la conferencia que se dictó en el simposio organizado por Novartis Chile en ocasión del lanzamiento de Rasilez (aliskiren), el 9 de abril de 2008 en Santiago de Chile, y cuyo moderador fue el Dr. Luis Hernán Zárate de la Sociedad Chilena de Hipertensión.
Introducción
En este momento se está iniciando una etapa interesante y novedosa en el manejo de la hipertensión arterial y del riesgo cardiovascular y renal. A continuación se analizará tres aspectos relacionados con este tema:
I. Daño cardiovascular y riñón.
II. Sistema renina-angiotensina-aldosterona (SRAA).
III. Efectos clínicos, particularmente renales, del bloqueo directo de la renina.
I. Daño cardiovascular y riñón
El análisis de la incidencia de enfermedad cardiovascular en diferentes subgrupos, estratificados según etapa de insuficiencia renal crónica, demuestra que la disfunción renal es un factor de riesgo particularmente importante. Si se divide a los pacientes en pacientes que mantienen filtración glomerular inferior a 60 ml/min o superior a ese nivel, se observa que el riesgo de enfermedad cardiovascular cambia de 15,6% a 37,1%, respectivamente, teniendo como punto de comparación el riesgo de 5,4% de la población general (Fig.1).
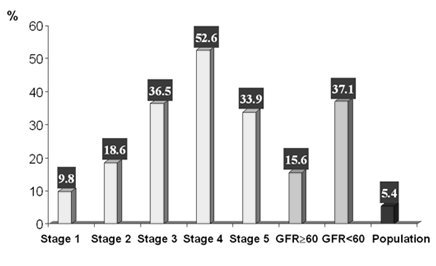 Tamaño completo
Tamaño completo Asimismo, el grado de proteinuria se correlaciona directamente con el riesgo cardiovascular: al agrupar pacientes según sus niveles de proteinuria, se observa que tanto el riesgo de accidente vascular cerebral (AVC) como el de episodios coronarios aumentan progresivamente (Fig.2).
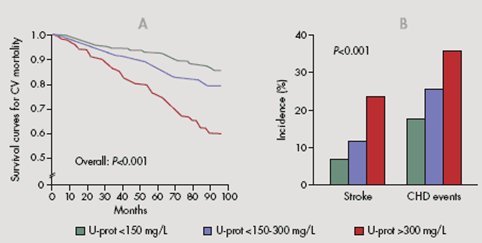 Tamaño completo
Tamaño completo
II. Sistema renina-angiotensina-aldosterona
El sistema renina-angiotensina-aldosterona (SRAA), que actúa como regulador de la presión arterial, se encuentra en los vertebrados desde los más primitivos hasta los mamíferos y hay evidencia de su presencia desde hace millones de años. Esta perpetuación se debe, sin duda, a su alta eficiencia.
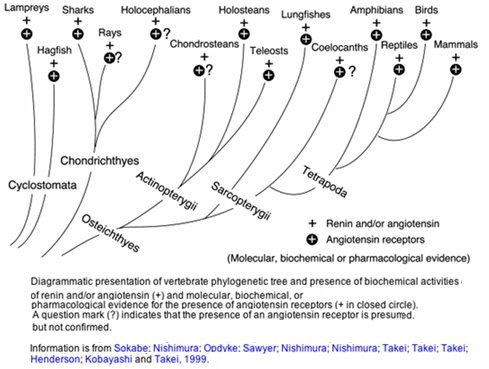 Tamaño completo
Tamaño completo Actualmente se sabe que el SRAA se comporta como una serie, en cascada, de factores proteolíticos que van activando otros factores peptídicos. El punto de partida de este sistema es la renina, la que se sintetiza principalmente a nivel renal y que actúa catalizando el paso de angiotensinógeno, el cual se origina fundamentalmente a nivel hepático, a angiotensina Y; ésta se transforma en el factor activo angiotensina II, en gran medida, pero no exclusivamente, por acción de la enzima convertidora de angiotensina. Hay una serie de vías de alternativa a los sistemas clásicos, ya que la conversión de angiotensinógeno a angiotensina I se debe no sólo a la renina sino también a otros péptidos, como la catepsina D. Otro ejemplo es el paso de angiotensina I a II, debido a las quimasas, proceso relevante a nivel cardiaco.
Es importante destacar que la angiotensina II establece una autorregulación negativa sobre la activación de la renina mediante su acción directa sobre el receptor AT I, y regula así la producción de angiotensina II; ésta es el factor más importante que participa en la producción y secreción de aldosterona, uno de los elementos claves en el control de la presión arterial dentro de este sistema. La angiotensina II se cataboliza en diferentes péptidos, los que influyen también en el control de la presión arterial, pero este aspecto no se desarrollará en detalle en esta exposición (Fig. 4). Las líneas punteadas indican vías de alternativa principalmente documentadas en estudios experimentales. Los bloqueadores beta, inhibidores de renina, inhibidores de la enzima convertidora de angiotensina (ACE) y bloqueadores del receptor de angiotensina II tipo 1 (ARB) reducen la actividad del sistema renina-angiotensina (RAS). Las flechas negras indican estimulación y las rojas, inhibición. AT-R: receptor de angiotensina; EP: endopeptidasas; EC: células endoteliales.
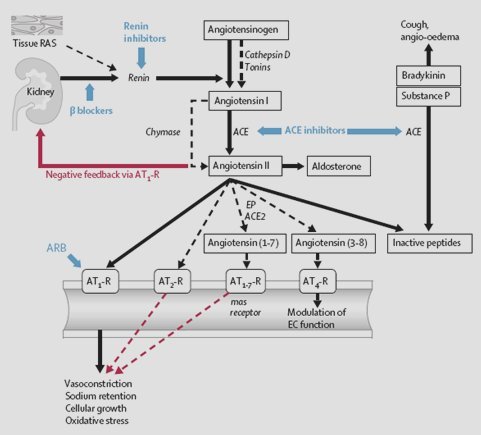 Tamaño completo
Tamaño completo Además del efecto de autorregulación negativa que ejerce la angiotensina II sobre la activación de renina, un sinnúmero de reacciones y factores participan en este complejo sistema de control de la presión arterial. Históricamente se ha dispuesto de fármacos eficaces para inhibir casi todos los elementos de esta cascada; así, se dispone de inhibidores de aldosterona, inhibidores del paso de angiotensina I a II y, durante la última década, se han desarrollado elementos capaces de intervenir en la activación del receptor AT 1. Hace poco se ha incorporado una nueva familia de fármacos capaces de inhibir directamente la acción catalítica de la renina.
El SRAA se organiza como un circuito de retroalimentación negativa circular, en el que cada uno de los péptidos que activa el siguiente causa un episodio que amplifica su acción. La producción final de angiotensina II dentro de este circuito y el hecho de que aquélla inhiba la activación de la renina establecen el cierre de este círculo de autorregulación (Fig. 5). El SRAA es cíclico: tiene un círculo de retroalimentación negativa. A medida que aumenta la formación de angiotensina II, circula de regreso al riñón e inhibe la producción de renina.
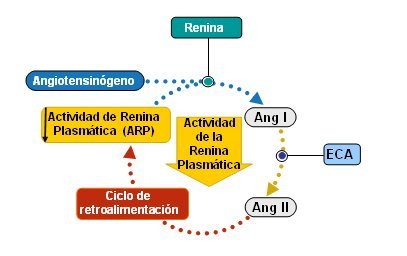 Tamaño completo
Tamaño completo En la medida en que se bloquea diferentes niveles de esta cadena se acumulan los factores participantes corriente arriba, puesto que se pierde la inhibición que da la angiotensina II sobre la producción de renina. Así, los inhibidores de enzima convertidora, que bloquean el paso de angiotensina I a angiotensina II, causan acumulación de angiotensina I y renina, lo que aumenta la actividad de la renina plasmática. Lo mismo se observa con el uso de inhibidores del receptor de angiotensina II, que además aumentan la actividad de angiotensina I y II.
La presencia de vías alternativas permite, dada la acumulación de factores corriente arriba, que otros péptidos puedan ejercer su acción y determinar un aumento compensatorio de la actividad de renina plasmática, asociado tanto al uso de inhibidores de angiotensina como al de inhibidores de enzima convertidora. Lo anterior significa que pueden existir efectos biológicos no controlados a nivel renal: vasoconstricción glomerular, inflamación y fibrosis; a nivel cardiaco: hipertrofia, vasoconstricción y fibrosis; a nivel de vasos sanguíneos: hiperplasia/hipertrofia, inflamación, oxidación y fibrosis; y a nivel cerebral: vasoconstricción.
El uso del nuevo fármaco aliskiren permite contrarrestar el aumento de la actividad de la renina plasmática que aparece como consecuencia del aumento de la concentración plasmática de renina y favorecido por la pérdida de autorregulación negativa del eje. El bloqueo del sistema de la renina en cualquier punto provoca una elevación compensatoria de la liberación de renina, debido a que los niveles de angiotensina II descienden o sus efectos sobre los receptores AT1, situados en la superficie de las células yuxtaglomerulares del riñón, se bloquean. Aliskiren es el único fármaco que contrarresta el aumento resultante de la concentración de renina en circulación mediante la inhibición de su función como enzima, es decir, la reducción de la actividad de la renina plasmática (ARP). Otros tipos de fármacos que ejercen sus efectos sobre el SRAA, los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas del receptor de angiotensina (ARA) están asociados con la elevación de la ARP, al mismo tiempo que aumenta la liberación de renina. Como la ARP indica la capacidad de la renina circulante para descomponer el angiotensinógeno y formar angiotensina I, los niveles de esta última también suben debido a la presencia de dichos fármacos. Los IECA reducen la ulterior conversión de la angiotensina I en angiotensina II, lo que causa la reducción general de los niveles de ésta, aunque su generación continúa en cierta medida por vías no IECA, para las cuales aumenta el sustrato de angiotensina I. Con los ARA, los niveles elevados de angiotensina I provocan aumento de la producción de angiotensina II y así el SRAA se regula por aumento, aunque los efectos vía el receptor de AT1 de la molécula efectora angiotensina II se bloquean. Como aliskiren reduce la ARP, desciende la generación de angiotensina I; así, desciende la cantidad de sustrato para la conversión a angiotensina II por medio de la enzima convertidora de angiotensina (ECA) u otras enzimas. Debido a estos hechos, la inhibición directa de la renina causa una eficaz supresión general del SRAA (Fig. 6) (RS = sistema de la renina. ARP = actividad de la renina plasmática. Ang = angiotensina. ECA = enzima convertidora de angiotensina. IECA = inhibidor de la enzima convertidora de angiotensina. ARA = antagonista del receptor de angiotensina.).
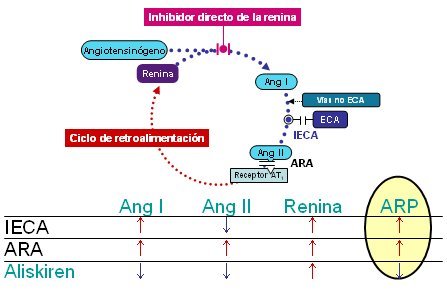 Tamaño completo
Tamaño completo La renina se produce fundamentalmente en el riñón, donde se sintetiza como pre-pro-renina y madura en el aparato de Golgi hasta producir el precursor pro-renina y la molécula final, renina. La pro-renina circulante es mayor que la renina y ambas pueden unirse a un receptor que se expresa preferentemente en áreas específicas del riñón, corazón y en ciertos territorios vasculares. Así, la expresión diferencial de receptores en un tejido dado permite amplificar el efecto de la renina sobre la transformación del angiotensinógeno en angiotensina I, modulando focalmente la actividad del eje renina-angiotensina sobre el territorio en cuestión.
También existe un efecto asociado con la pro-renina, pues, cuando ésta se une al receptor periférico, se abre y expone un sitio activo idéntico al de la renina, y permite la transformación de angiotensinógeno en angiotensina. En otras palabras, la pro-renina se une al receptor, con el que comparte una afinidad casi idéntica con la renina, lo que permite que ésta se active, de tal modo que tanto la renina como la pro-renina tienen actividad similar en los territorios en que se expresan dichos receptores. Así se explica el conocido papel enzimático de estos factores. Por otro lado, la unión de la renina y pro-renina a estos receptores aumenta la producción intracelular de sustancias que promueven la síntesis de fibronectina y colágeno, que generalmente son moléculas profibróticas. Este aspecto es lo que da a la renina el carácter de hormona, diferente del carácter de enzima con que se la considera habitualmente.
Es importante destacar que la renina puede actuar a niveles más bajos que los niveles en que actúa en fase soluble, con un Km diez veces menor, al unirse al receptor. Esto determina efectos de gran potencia a niveles plasmáticos bajos, cuando se une al receptor.
III. Bloqueo selectivo de renina y riñón
En un trabajo publicado en 2002 se observó que la expresión del receptor de renina se concentra fundamentalmente en el riñón, en los vasos y en los glomérulos, y, a nivel cardiaco, en el territorio perivascular coronario. La concentración de aliskiren en los glomérulos y vasos renales puede explicar su efecto antihipertensivo prolongado, el que le permite ofrecer protección frente a las lesiones renales provocadas mediante el SRAA. El patrón de localización renal y su retención pueden causar una inhibición de larga duración del SRAA a nivel del tejido renal.
En otro estudio, publicado en 2007, se trabajó en un modelo experimental de ratas diabéticas con mayor grado de fibrosis a nivel renal, versus ratas sanas. Al serles administrado perindopril se redujo la aparición de fibrosis, pero al utilizar aliskiren la reducción fue aún mayor (Fig. 7).
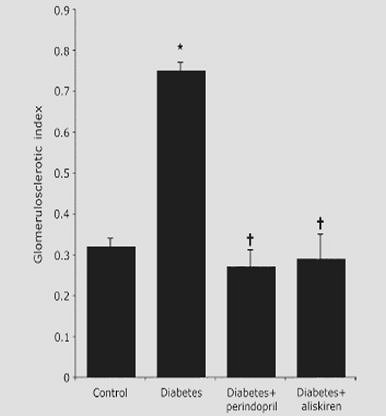 Tamaño completo
Tamaño completo 
