Publicado el 1 de septiembre de 2006 | http://doi.org/10.5867/medwave.2006.08.2418
Posibles determinantes perinatales de morbilidad en la edad adulta
Possible perinatal determinants of disease in adulthood
Resumen
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
Introducción
Desde fines de la década de 1980 se empezó a hablar en la literatura internacional de una probable relación entre los episodios que le ocurren al feto y el desarrollo de enfermedades en la etapa adulta, y, en los diez últimos años, un numeroso grupo de investigadores en todo el mundo se ha dedicado a analizar estas relaciones y a objetivar cuáles factores del período fetal pueden determinar enfermedades del adulto. En la Revista Médica de Chile se publicó en 2001 una revisión de lo que había en la literatura hasta ese momento (Aros S, Cassorla F. Posibles determinantes perinatales de morbilidad en la edad adulta. Rev Med Chile, Mar. 2001, vol.129, no.3, p.307-315). Esta exposición tratará de lo que ha ocurrido en estos últimos años. Hay mucha información procedente de trabajos de investigación de buen nivel y es importante que los pediatras actualicen sus conocimientos sobre el tema para ejercer de manera adecuada su labor de educación y prevención.
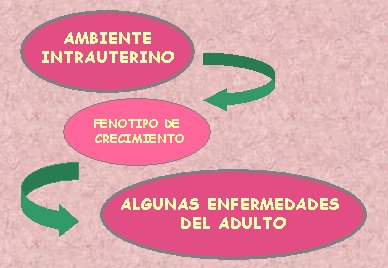
En 1987, Barker analizó los datos de una gran cohorte de adultos seguidos desde el período de recién nacidos y en 1988 publicó la hipótesis del origen fetal de algunas enfermedades del adulto, en la que planteó que el ambiente intrauterino al que está expuesto el feto determina un fenotipo especial de crecimiento en la vida posterior. Un feto expuesto a malnutrición se adapta para sobrevivir dentro del útero; luego, en el período postnatal, mantiene los mecanismos adaptativos, pero las condiciones ambientales cambian y este hecho podría llegar a determinar algunas de las enfermedades del adulto (Barker DJ. Arch Dis Child 1988;63:867-9) (Fig.1).
 Tamaño completo
Tamaño completo Figura 1. Hipótesis del origen fetal de las enfermedades del adulto
En 2006 Gluckman, quien ha profundizado el tema, llegó a una conclusión que parece básica, pero que en verdad es difícil de lograr: plantea que la única forma de prevenir gran parte de las enfermedades del adulto es optimizar el desarrollo fetal, es decir, que cada gestación tenga como resultado un niño nacido de padres sanos y óptimamente preparado para las próximas etapas de su vida, a corto, mediano y largo plazo. (Gluckman et al. Horm Res 2006;65:5-14). La dificultad está en definir los elementos claves para lograr este desarrollo fetal óptimo. Barker planteó que el feto desnutrido recurre a mecanismos metabólicos para adaptarse a la malnutrición, los que persisten a través del fenómeno de programación, y modifican los niveles de insulina, hormona de crecimiento y factores insulinosímiles, como IGF-1 y otros factores, lo que puede ser perjudicial en la vida postnatal, en especial ante una oferta alimentaria normal o una sobreoferta, como es frecuente que se haga en el niño pequeño para la edad gestacional (PEG), con el fin de lograr que suba de peso más rápidamente.
Restricción del crecimiento intrauterino (RCIU)
En una revisión del tema se demostró que las etiologías de RCIU son similares en países desarrollados y subdesarrollados: el estado nutritivo de la madre es importante, pero no por la presencia de desnutrición u obesidad, sino porque cada vez se da más importancia a la función de los micronutrientes como fierro y zinc; las edades maternas extremas (menor de 16 o mayor de 35 años); la primiparidad; la diabetes mellitus y la hipertensión arterial; la presencia de enfermedades e infecciones crónicas; el consumo de tabaco, alcohol y drogas, que se ve con una frecuencia cada vez mayor; y la presencia de alteraciones placentarias y fetales (Horm Res 2006;65:19-27).
Los mecanismos de acción del ambiente intrauterino sobre el crecimiento fetal no están bien establecidos, pero se sabe que son importantes los factores insulinosímiles, de los cuales IGF-1 e IGF-2, que se expresan tempranamente en la gestación, son los más estudiados. IGF-1 es muy dependiente del aporte de nutrientes maternos y modula la proliferación celular, el crecimiento y la diferenciación; sus niveles son bajos en el feto, en comparación con RN y adulto; tiene un efecto anabólico; y está regulado por el aporte de nutrientes. IGF-2 es importante en el segundo y tercer trimestre del embarazo, en que se encuentra en los tejidos fetales en altos niveles, que bajan después del nacimiento; tiene un rol en el crecimiento placentario y transferencia de nutrientes; regula el crecimiento y diferenciación celular; y no depende mucho del estado nutritivo materno (Placenta 2003;24:803-12, JCEM 2003;88:1687-91).
El Proyecto Perinatal Colaborativo Nacional de los Estados Unidos es un trabajo multicéntrico clásico, que se realizó en Estados Unidos en la década pasada; en él se siguió a una cohorte de 55.760 niños, de los cuales 6% presentaron RCIU, porcentaje parecido al que hay en la actualidad en Chile. Lo interesante fue que las madres de los niños con RCIU eran más delgadas y pequeñas que las mujeres de la población general, presentaron una ganancia ponderal menor durante el embarazo y tenían mayor tasa de tabaquismo. Los niños con RCIU tuvieron menos peso y talla a los 7 años que la población general y que sus hermanos de peso adecuado, con promedio de z score -0,5 DS (1,6 k de peso y 2 cm de talla), lo que llevó a plantear la pregunta de cuánto pesan en esto los factores genéticos. Posteriormente, muchos estudios han demostrado la importancia del factor genético y la influencia de los factores mencionados (J Pediatr 1998; 133: 67-72).
El cigarrillo es el factor modificable de RCIU de mayor prevalencia en los países desarrollados; si se controlara se lograría un gran impacto, porque el tabaquismo determina que el riesgo de tener un niño con peso de nacimiento menor de 2.500 gramos sea dos veces mayor, lo que significa que el cigarrillo es causante de 20% a 30% de los RN de menos de 2,5 kg de peso al nacer. Los hijos de madres fumadoras pesan entre 100 y 400 gramos menos que los hijos de no fumadoras; y cuanto mayor es la exposición al tabaco, menor es el peso de nacimiento. En cambio, el tabaquismo pasivo no se ha relacionado claramente con disminución del peso de nacimiento (Steyn K et al. Paediatr Perinat Epidemiol 2006, Godding V et al. Pediatr Res 2004, Law KL et al. Pediatrics 2003). En cuanto a los mecanismos de acción, los efectos adversos del cigarrillo sobre el crecimiento se producen en el feto por vasoconstricción placentaria, lo que afecta la talla, la circunferencia craneana y la masa muscular, y no al tejido graso; también disminuye IGF-1, quizás por un efecto directo del cigarrillo sobre el hígado (Obstet Gynecol 1993;81:551-5, JCEM 2005; 90:2556-62).
En cuanto al alcohol, algunos estudios no muestran alteración significativa del peso de nacimiento ni del crecimiento postnatal en niños expuestos a alcohol. Sin embargo, en la cohorte del IDIMI, en 100 niños hijos de madres alcohólicas, la incidencia de PEG fue de 13%, que es el doble de la incidencia de la población general en Chile, por lo que es importante. En relación a crecimiento y alcohol, se sabe que si la exposición es precoz, en el primer trimestre, lo más probable es que ese niño no recupere el peso en el período postnatal, porque además va a presentar dificultad para alimentarse y mal apetito (regulación de hambre y saciedad). Si la exposición es más tardía, en el segundo y tercer trimestre del embarazo, que es lo menos frecuente, estos niños tienen más posibilidad de presentar crecimiento compensador (catch-up growth) postnatal (Day NL. 1997). Hay una relación lineal entre dosis de alcohol y RCIU, y el umbral sería la ingesta promedio de un trago al día, lo que corresponde a 100 ml de vino o 300 ml de cerveza. También importa la duración de la exposición; se sabe que los niños más afectados son los expuestos a alcohol durante todo el embarazo; pero si la madre deja de beber, se observa recuperación del crecimiento (Day N. et al. Alcohol Health Res World 1992;16:238-44, Mills JL. et al. JAMA 1984; 252:1875-9). En relación con los mecanismos respectivos, se ha visto que la ingesta crónica de alcohol altera la regulación de IGF-1 y sus proteínas transportadoras, origina cambios placentarios y afecta el crecimiento pre y postnatal; además, se reprograma el eje fetal HHA (Alc Clin Exp Res 1995;19:867-73, Exp Biol Med 2005;230:376-88).
Hoy se discute la definición de RCIU, porque por años se ha definido al PEG como el niño que está bajo el percentil 10 de su peso para la edad gestacional, pero las patologías se concentran en los niños bajo el percentil 3, incluso bajo el percentil 1, que corresponden a un pequeño porcentaje, de modo que las estrategias se deben dirigir especialmente a esos niños. Por este motivo, varios autores plantean que para el trabajo poblacional se podría usar el percentil 10, pero para efectos individuales se deben concentrar los esfuerzos en los niños de más bajo peso. En Estados Unidos, entre 1% y 3% de los embarazos cursan con RCIU y, en Chile, 5,6% de los recién nacidos son PEG (MINSAL, 2003).
El otro concepto clásico que se está modificando es el de RCIU simétrica y asimétrica. La RCIU simétrica se produce por una noxa precoz y afecta el peso, la talla y la circunferencia craneana, se debe a problemas fetales o infecciones congénitas precoces; en cambio, la RCIU asimétrica se debe a causas placentarias y compromete especialmente el peso; pero lo anterior también se cuestiona, porque en 1987 se describió que los niños que tenían peor evolución perinatal y a largo plazo, eran los niños con crecimiento asimétrico, que son los que tienen más probabilidades de presentar un crecimiento compensador, mientras que los niños con RCIU simétrico estaban en riesgo de hipertensión arterial, pero no de síndrome X o síndrome metabólico completo. Otra circunstancia que se ha descrito en la literatura es que ambos patrones, simétrico y asimétrico, pueden comenzar en forma precoz, o sea, esta división no es tan clara y se debe reevaluar (Horm Res 2006;65:19-2, Lancet 1993;341:938-41).
Las consecuencias de ser recién nacido PEG, a causa de la programación que se ha mencionado, es lo más estudiado, aunque hay otras asociaciones entre patología fetal y enfermedades del adulto. Los niños PEG muestran: mayor morbilidad y mortalidad neonatal; mayor riesgo de prematurez; mayor riesgo de obesidad, aunque ésto no se ha establecido con claridad; mayor incidencia de alteraciones del desarrollo cognitivo y de retraso del crecimiento postnatal; mayor frecuencia de pubertad precoz y síndrome de ovario poliquístico; y mayor riesgo de enfermedad cardiovascular, diabetes mellitus tipo 2, síndrome metabólico, osteoporosis y sordera sensorioneural (Horm Res 2006;65:5-14, JCEM 2005;90:4452-6). Las consecuencias de origen adaptativo pueden ser inmediatas: el tamaño, proporcionalidad y maduración del feto se alteran, lo que determina prematurez y desarrollo acelerado del eje hipotálamo-hipófisis-adrenal (HHA).
Todo esto configura una estrategia que resulta perjudicial para su propio organismo cuando el feto enfrenta el ambiente postnatal, en que se presentan las consecuencias a mediano y largo plazo, que son:
- mayor riesgo de obesidad;
- riesgo de insulinorresistencia;
- estrategia reproductiva alterada (adrenarquia y menarquia aceleradas);
- menor protección ante la longevidad; osteopenia y disminución del crecimiento músculo-esquelético;
- disminución del desarrollo cerebral;
- sensibilidad alterada ante un ambiente amenazante (alteración del eje HHA, alteraciones del ánimo).
Lucas define la programación como un fenómeno en el que estímulos o lesiones surgidos durante épocas críticas o sensibles de la vida fetal, pueden tener consecuencias a largo plazo. No todos los niños PEG tendrán estas consecuencias; hay susceptibilidad genética y, además, dependerán del período en que ocurran las noxas. Los factores ambientales que actúan precozmente en la vida fetal, afectan los sistemas en desarrollo y alteran permanentemente su estructura y función. También pueden ser estímulos generados en forma endógena por la madre (patologías maternas) o de origen ambiental. Lo importante es que estas noxas influyen en que se constituya un fenotipo ahorrativo, cuyo fin es defenderse de la agresión (Lucas A. J Nutr 1998;128.401-6).
En los últimos años se ha planteado que el bajo peso de nacimiento es sólo un marcador, es decir, no es lo que ocasiona todo el fenómeno, sino que sólo refleja que algo ocurre. En algunos trabajos se ha planteado que el alcohol reprograma de alguna manera el eje HHA y que los niños PEG que sufrieron exposición a alcohol corren mayor riesgo de desarrollar patologías del adulto. Lo anterior apoya la hipótesis de que otros factores, además del peso, son importantes para desencadenar el proceso. Lo que interesa es que aquí el eje HHA es el sistema clave y que se puede alterar por estrés, administración de corticoides y malnutrición También participaría el proceso de oxidación de los ácidos grasos en la vida fetal, cuya alteración podría programar respuestas de factores de crecimiento para toda la vida (Exp Biol Med 2005;230:376-88, J Inherit Metab Dis 2006;29:71-5).
Alteraciones epigenéticas
La epigenética es la herencia de información basada en los diferentes niveles de expresión de uno o varios genes y no en la herencia de una secuencia genética, fenómeno que también se conoce como la penetrancia de cada gen, es decir, cuánto se expresa cada gen. Todos nuestros tejidos contienen los mismos 30.000 genes, pero el código epigenético determina que en cada tejido, en un momento determinado, se expresen sólo algunos de los genes, lo que da origen al fenotipo de cada tejido. Ciertos estímulos nutricionales transitorios, por ejemplo, un déficit específico, en estados ontogénicos críticos, pueden tener efectos definitivos al interactuar con este mecanismo epigenético, y modificar así toda la programación de esos genes. Dicho efecto se puede transmitir a las generaciones siguientes (efecto transgeneracional); o sea, un proceso que podría haber sido normal se alteraría en el feto por un déficit nutricional de la madre y este niño podría transmitirlo a sus descendientes. Se ha invocado la epigenética en varias patologías, como ciertos cánceres, alteraciones cromosómicas, retardo mental, síndrome metabólico y ateroesclerosis (Diabetes 2005; 54:1899-1906). Por lo tanto, es indispensable lograr que la alimentación y las emociones maternas sean óptimas y que se eliminen del ambiente intrauterino las influencias del tabaco, el alcohol, la contaminación y las enfermedades(Fig. 2).
 Tamaño completo
Tamaño completo Figura 2. Eventuales noxas en el período prenatal
Influencia del ambiente postnatal
Entre los factores del ambiente postnatal tiene mucha importancia la acelerada ganancia de peso en los dos primeros años de vida, tanto en los niños de término como en los prematuros. Esta acelerada ganancia puede ocasionar sobrepeso y, aunque este niño baje de peso después, va a desarrollar insulinorresistencia e hipertensión a los 20 años de edad. Por lo tanto, los nutriólogos deben determinar si las curvas de crecimiento que se utilizan actualmente son apropiadas para estos niños, porque la mayoría de dichas curvas se obtuvieron en niños alimentados con fórmula, de modo que es posible que se les esté exigiendo más de lo debido; y también habría que ver si es necesario que los prematuros utilicen fórmulas tan enriquecidas, ya que son uno de los grupos de más riesgo. En este contexto, es muy importante promover la mayor duración y la exclusividad de la lactancia materna (Diabetes 2005; 54:1899-1906).
Los niños PEG, de término o pretérmino, presentan alteración del crecimiento en los primeros años de vida; si en la etapa postnatal se restauran condiciones más favorables, éstos niños pueden mostrar crecimiento compensador o catch-up growth, aunque 10% a 15% de ellos no van a presentar esta recuperación y van a quedar con talla baja (Pediatr Res 1995; 38: 267-7). El catch-up growth o crecimiento compensador es básico para que el niño recupere su talla, pero cuando el crecimiento compensador de peso o de índice de masa corporal (IMC) es excesivo, se asocia con consecuencias adversas, especialmente obesidad. Si un niño tiene un aumento importante del IMC, en especial por aumento de la masa grasa, su composición corporal se alterará en forma permanente (BMJ 1999; 318: 427-31, BMJ 2000; 320: 967-71). Se ha visto que estos niños presentan aumento de la insulinemia en ayunas y alteración de su curva de tolerancia a la glucosa, y que el crecimiento compensador exagerado en IMC se relaciona significativamente con insulinorresistencia en la edad adulta (NEJM 2004;350:865-75, J Clin Endocrinol Metab 2003; 88: 3645-50) y con mayor mortalidad por enfermedad coronaria; O sea, el crecimiento compensador es bueno y resulta esencial para que el niño recupere talla, pero se debe controlar de cerca y evitar que sea exagerado (BMJ 1999; 319: 51403-7).
La ganancia ponderal rápida postnatal está claramente identificada como factor de riesgo; en el período de lactante es un mecanismo compensatorio cuando el niño ha nacido PEG, pero a largo plazo sus efectos dependen de la presencia de factores de crecimiento, especialmente IGF-1, de la duración de la lactancia materna y de la introducción de otros alimentos. Lo más llamativo es que en la infancia precoz y en la etapa de preescolar, cualquier niño puede presentar una ganancia ponderal rápida, independiente de su peso de nacimiento, los que exhiben esta ganancia por malos hábitos alimentarios y de actividad física también están expuestos al riesgo de desarrollar aumento del tejido adiposo y obesidad en la edad de adulto joven. Por lo tanto, los pediatras nunca debemos exigir ni permitir una ganancia ponderal rápida, con el objetivo de hacer entrar al niño en su curva normal, porque lo más probable es que éste quede con alguno de estos mecanismos alterados en forma permanente (Am J Clin Nutr 2006;83:324-30).
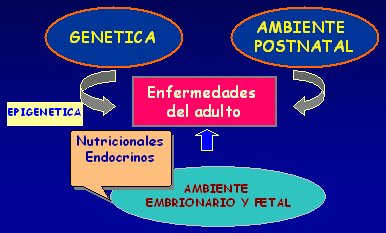
En resumen, las enfermedades del adulto estarían determinadas por factores genéticos que determinan la susceptibilidad del individuo frente a lo que pasa; por un ambiente embrionario y fetal regulado por mecanismos nutricionales y endocrinos; por la interacción entre estos factores nutricionales y la genética, que es la epigenética; y por el ambiente postnatal (Fig 3).
 Tamaño completo
Tamaño completo Figura 3. Condicionantes de las enfermedades del adulto
A continuación se revisará la evidencia disponible sobre el efecto de posibles determinantes perinatales sobre distintos grupos de patologías del adulto: alteraciones del crecimiento, enfermedades cardiovasculares, metabolismo, diabetes y obesidad, sistema neurológico, enfermedades respiratorias, riesgo oncológico y otros. El conocimiento de estos determinantes es fundamental para definir grupos de riesgo y establecer posibles intervenciones.
Enfermedad cardiovascular
La vida fetal es un período crítico para el desarrollo de factores de riesgo de este grupo de patologías. La desnutrición y la excesiva disponibilidad de nutrientes afectan al individuo en la etapa fetal y postnatal, y está claro que los niños PEG tienen mayor riesgo de patología cardiovascular, aunque en los cinco últimos años se ha demostrado que los grandes para la edad gestacional (GEG) también muestran riesgo aumentado. La alteración persistente del eje somatotrófico cumpliría un papel fundamental (JCEM 2005;90:5672-6).
En Europa y en Japón se han efectuado interesantes estudios de cohorte que han generado grandes bases de datos de miles de pacientes cuya información está registrada desde el período de recién nacido hasta los 60 años. Los principales estudios de este tipo se han hecho en 13.249 hombres, en el Reino Unido; 7.012, en Suecia; 3.641 nacidos entre 1924 y 1933, en Helsinski; y 5.162 hombres y mujeres, en Japón (35 a 66 años) Todos estos estudios relacionan en forma clara el bajo peso de nacimiento con el mayor riesgo de enfermedad coronaria y el grupo con mayor riesgo es el de los recién nacidos con bajo peso de nacimiento cuyo IMC aumentó en forma rápida durante la niñez y adolescencia (BMJ 1999; 318: 427-31, Circulation J 2006;70:262-7). Pequeños aumentos en la masa corporal en la infancia, incluso un par de kilos demás, pueden significar grandes diferencias durante la etapa adulta y esto es lo que los pediatras debemos evitar. El mayor riesgo de enfermedad coronaria lo tiene el niño desnutrido prenatal con exceso de alimentación postnatal; y un grupo especial de riesgo son las madres con sobrepeso, que ofrecen a su hijo un ambiente intrauterino inadecuado y, probablemente, mayor oferta de alimentos (New Engl J Med 1992; 327: 1350-5).
Hipertensión arterial
En seguimientos de más de 15 años se ha visto que los hijos de madre diabética tienen mayor riesgo de hipertensión arterial que los hijos de mujeres cuya curva de tolerancia a glucosa es normal, con PA sistólica promedio 8 mmHg más alta y PA media 4 mmHg mayor. El mal control metabólico al final del embarazo se asocia con mayor presión arterial diastólica y media en el niño (J Pediatr 2000; 136: 587-92). En el caso de los niños PEG, se ha demostrado que: a menor peso de nacimiento, mayor presión arterial, tanto en la infancia como en la edad adulta, por lo que es importante tomar la presión arterial a todos los pacientes y, con mayor razón, a los PEG. Por otra parte, cuanto mayor es la ingesta de calcio en la madre, menor presión arterial tiene el niño en la infancia y en la etapa adulta; y el ácido fólico disminuye el riesgo cardiovascular, tanto si la madre consume una cantidad adecuada de ácido fólico como si el niño, posteriormente, tiene buenos niveles de este nutriente.
En cuanto a los mecanismos de la hipertensión arterial, se ha planteado que los niños GEG e hijos de madre diabética podrían tener un exceso de insulina o una alteración del eje HHA y de la actividad adrenomedular, con mayores niveles de cortisol postnatal; o que habría aumento de la dehidroepiandrostenediona sulfato (DHEA-S) y la epinefrina. No están claros los mecanismos, pero se sabe que los PEG, GEG e hijos de madre diabética tienen mayor riesgo de desarrollar hipertensión arterial (J Pediatr 2002; 141: 477-82, Circulation 2004;110:1990-5, Hypertension 2006;47:1-6).
Metabolismo, diabetes y obesidad
La compleja adaptación intrauterina que sufre el feto afecta su crecimiento, esto se perpetúa en una programación patológica que genera mayor riesgo de síndrome metabólico, el que antes se denominaba síndrome X y que se compone de cuatro elementos: obesidad, hipertensión arterial, dislipidemia e hiperinsulinemia.
La insulinorresistencia, que es el resultado de factores genéticos y ambientales, es el factor clave para el desarrollo de síndrome metabólico y diabetes mellitus tipo 2 en la adultez. El fenotipo ahorrativo, propio del niño PEG, tiene menor sensibilidad a insulina y estos individuos, al año de vida, presentan niveles más altos de insulina y triglicéridos en sangre que los que nacieron con peso adecuado para la edad gestacional. Los niños con mayor riesgo son aquellos con RCIU que en la vida postnatal presentan un crecimiento compensador exagerado (J Clin Endocrinol Metab 2003; 88: 3645-50, Horm Res 2006;65:123-30). Los niños GEG, sobre todo si son hijos de madre diabética, tienen 3,6 veces más riesgo de desarrollar síndrome metabólico a los 11 años de edad (17% en comparación con 4,8%); y la obesidad materna sin diabetes también determina mayor riesgo de síndrome metabólico en los niños que fueron GEG (J Pediatr 2000; 136: 567-8, Pediatrics 2005;115:290-6). En suma, existen sujetos con un genotipo predispuesto; los niños PEG con crecimiento compensatorio exagerado tienen el mayor riesgo; la insulinorresistencia puede aparecer ya al año de vida; y los mecanismos subyacentes aún no están claros, pero hay muchos grupos de investigadores trabajando en este aspecto.
Alteraciones neurológicas
Numerosos seguimientos demuestran que los niños PEG tienen alteraciones cognitivas, mayor frecuencia de síndrome de déficit atencional y, según estudios con resonancia nuclear magnética, disminución del volumen cerebral (Pediatr Res 2004;56:132-8). Sin embargo, el niño PEG puede serlo por alcohol, por tabaco u otras causas, y es difícil determinar cuánto han influido dichas causas en el daño neurológico.
El consumo materno de alcohol durante el embarazo es la primera causa ambiental de retardo mental en el mundo. Si se lograra que las mujeres embarazadas no bebieran durante el embarazo, se reduciría mucho el número de niños con retardo mental. La incidencia de síndrome de alcohol fetal es de 0,3 a 3/1000 recién nacidos vivos y la tasa de efectos menos graves es de 1/300 recién nacidos vivos. El consumo continuo e intermitente también puede dañar el cerebro, pero lo más perjudicial para el sistema nervioso central es el consumo de grandes cantidades de alcohol en forma episódica. Las alteraciones estructurales o funcionales dependerán del momento de la exposición. No se ha establecido una dosis definida; por eso, la Academia Americana de Pediatría recomienda la abstención del consumo de alcohol en mujeres embarazadas o que se propongan un embarazo.
En cuanto a los mecanismos de daño, el consumo de alcohol aumenta el estrés oxidativo, el IGF-1 aumenta para compensarlo y se origina una reprogramación en el feto expuesto a alcohol (Sulik KK, Charness ME. 1998, Recent Dev Alcohol 1998;14:97-134, Alcohol Clin Exp Res 2001;24:544-52). Además, se ha comprobado que el alcohol causa alteración de proteínas cerebrales de neuronas presinápticas, por lo que las alteraciones neurológicas provocadas por el alcohol en el feto ocurren en algunas áreas cerebrales: así se explica que el alcohol no cause retardo mental global sino que sólo afecte áreas más complejas, por alteración selectiva de algunas de estas proteínas (Alcoh Clin Exp Res 2005;29:1915-20). Algunos trabajos demuestran que se podría intervenir cuando nace un niño que ha estado expuesto a alcohol, mediante la administración de alguno de los factores protectores, como IGF-1, que está disponible para tratamiento, y otros factores que están aún en estudio, como el factor de crecimiento básico de fibroblastos (bFGF), estrógenos y factor de crecimiento neuronal (NGF), que podrían revertir o reducir el daño que produjo el alcohol, aunque esto es aún experimental (Brain Res Bulletin 2005;67:459-65).
En cuanto al cigarrillo, se sabe que también es neuroteratógeno, debido a que utiliza los receptores nicotínicos de acetilcolina del cerebro fetal, lo que causa mal desarrollo de la actividad sináptica, altera el patrón de proliferación y diferenciación celular, y ocasiona daño neuronal; por lo tanto, fumar durante el embarazo puede producir alteraciones nerviosas en el feto (Levin ED. Handbook of Dev Neurotoxicity 1998).
La cocaína-pasta base bloquea la recaptación de aminas, especialmente dopamina, y aumenta su concentración sináptica. La dopamina regula las respuestas genómicas que determinan el desarrollo y plasticidad neuronales y tiene que ver con el equilibrio de neuronas excitatorias e inhibitorias. La cocaína causa pérdida de neuronas y alteración de la laminación de la corteza cerebral, cuando el consumo se realiza durante el primer trimestre del embarazo, que es cuando ocurre la neurogénesis cortical (Harvey JA. Neurosci and Biobehav Rev 2004). A largo plazo, se ha visto que causa alteración del rendimiento escolar, menor capacidad de concentración y mayor distractibilidad. Aunque no es claro aún, algunos de los efectos que produce la cocaína podrían ser reversibles, a diferencia de los que produce el alcohol, que son permanentes (Frank DA et al. JAMA 2001).
En cuanto a la marihuana, si bien hay pocos trabajos, se hizo un metaanálisis en el que se compiló todo lo que había sobre la relación entre marihuana y cerebro desde 1970 a 2005, relación que no sería tan inocua como se dice. Este metaanálisis sólo incluyó los trabajos que cumplían con los requisitos de seguimiento y se comprobó que el consumo de marihuana de la madre se asocia con problemas de atención, impulsividad, trastornos de aprendizaje, memoria y déficit de las funciones ejecutivas en el hijo (J Ginecol Obstet Biol Reprod (Paris) 2006;35:62-70).
Otros elementos tóxicos para el sistema nervioso central son el plomo, que disminuye el coeficiente intelectual y origina trastornos de conducta; el mercurio, que es neurotóxico; y los pesticidas, que se asocian claramente con daño prenatal (Environ Health Perspect 2000; 108: 373-4).
En suma, el consumo de tabaco, alcohol y drogas pueden no asociarse siempre con efectos muy graves, pero sí con elementos sutiles que probablemente alteren la inserción del niño en la vida social y escolar. Muchas veces la causa de esta situación pasa inadvertida y nadie sabe por qué al niño le va mal en el colegio o tiene problemas conductuales y puede terminar presentando problemas delictuales.
Se sabe que la administración preconcepcional y precoz de ácido fólico en el embarazo disminuye el riesgo de disrafia y defectos del tubo neural en 40% a 80%; en Chile, en 31%. También reduce el riesgo de cardiopatía congénita, ano imperforado y fisura labiopalatina, aunque es probable que la dosis necesaria para disminuir la fisura sea un poco mayor que para las demás patologías, pero es algo que aún está en estudio. Investigaciones en grandes cohortes plantean que las madres que consumen ácido fólico tendrían menos riesgo de trisomía 21; y a largo plazo, se protegerían de riesgo cardiovascular y cáncer. Se recomienda administrar a la embarazada 0,4 mg/día adicional a la dieta. En una persona que no está embarazada bastaría con el pan enriquecido que se consume en Chile (dos unidades al día), pero en la embarazada se debe agregar ácido fólico como medicamento, porque los estudios están diseñados de esta manera y no se puede asegurar que la fortificación de la harina sea una medida suficiente. En Chile, Cortés comunicó en 2004 una disminución de 30% de los defectos del tubo neural y en una revisión del Lancet de 2006 se menciona que los tres países pioneros en fortificar la harina con ácido fólico son Estados Unidos, Canadá y Chile.
Alteraciones del sistema respiratorio
El asma bronquial estaría determinada en la etapa fetal. En un estudio efectuado en 4.578 adolescentes gemelos, cuyo objetivo era limpiar el factor genético, se observó que 3,9% de los sujetos tenían asma y que cuanto mayor era el peso al nacer, mayor era el riesgo de asma; además la madre fumadora presentaba un riesgo 50% mayor de tener un hijo asmático. Por lo tanto los dos grandes factores de riesgo de esta enfermedad eran el mayor peso al nacer y el tabaquismo materno (Thorax 2000; 55: 25-31). En otra cohorte de 4.089 niños se comprobó que si la madre fumaba durante el embarazo aumentaba el riesgo de sibilancias recurrentes en los dos primeros años de vida (odds ratio=2.2) y el riesgo de asma (OR=2.1), y que la exposición a tabaco ambiental, aunque la madre no fumara, también aumentaba el riesgo de asma, efecto que también se ha demostrado en otros estudios (Respir Res 2006; 7: 3-6). En un seguimiento, las niñas adolescentes de 14 años cuyas madres fumaron 20 cigarrillos o más al día durante el embarazo y en los seis primeros meses del nacimiento, tenían mayor riesgo de presentar asma que las hijas de madres no fumadoras (OR=1.96). El riesgo fue mayor con la exposición in utero que postnatal (Epidemiology 2006;17:138-44). Se ha descrito que ciertas alteraciones de regiones cromosómicas, inducidas por la exposición a tabaco, dañan enzimas detoxificantes y disminuyen la capacidad del pulmón para metabolizar sustancias dañinas, con lo que aumenta el riesgo de asma (Toxicol Lett 2006;162: 43-8).
Patología oncológica y otros
Se ha descrito que el consumo materno de café, alcohol y tabaco podrían elevar el riesgo de leucemia y se ha establecido claramente que los niños GEG tienen mayor riego de leucemia y tumores en los dos primeros años de vida, probablemente por alteraciones de IGF-1, y, a más largo plazo, de cáncer de mama, próstata, endometrio, riñón y colon (Cancer Causes Control 1996; 7: 553-9, Best Pract Res Clin Endocrinol Metab 2002:16: 225-41). Las niñas GEG y gemelas, que estarían expuestas a un alto nivel circulante de estrógenos, tienen mayor riesgo de desarrollar cáncer de mama. También se ha dicho que el ácido linoleico (omega-6) puede modificar membranas y alterar la transducción de señales, facilitando la aparición de tumores mamarios, pero que los omega-3 inhibirían el crecimiento de estos tumores (Lancet 1996; 348:1542, Nutrition 1999;15:392-401). Por otra parte, la niña GEG, con rápida ganancia ponderal precoz y talla alta a los 14 años de edad, tendría claramente mayor riesgo de cáncer mamario, según una publicación de 2004 (NEJM 2004;351:1679-81).
Por último, un estudio realizado en 3.740 mujeres relacionó el estrés materno con mayor riesgo de fisura labiopalatina y cardiopatía congénita, lo que se ha vuelto a mencionar en otros trabajos. También se ha dicho que la presencia de un gran estrés, como el fallecimiento inesperado de un hijo, durante el primer trimestre del embarazo, desencadenaría aumentos de cortisol y catecolaminas endógenas que serían capaces de producir malformaciones (Lancet 2000; 356: 875-80). Y un estudio reciente plantea que el metabolismo de la vitamina D de la madre, durante el tercer trimestre del embarazo, puede predecir la masa ósea del hijo durante la infancia; o sea, si la madre consume vitamina D en forma adecuada el niño tendría menor riesgo de osteopenia. Este trabajo está recién publicado, de modo que no hay seguimiento de largo plazo, pero sería probable que la osteoporosis también disminuya (Lancet 2006;367:36-43).
En cuanto al papel paterno, se sabe que el semen puede contener cocaína, alcohol, nicotina y sus metabolitos, solventes tóxicos, diversos contaminantes y algunos teratógenos. No se sabe cuál es la cantidad dañina, porque es algo difícil de estudiar. Los tóxicos ambientales pueden alterar el ADN de los espermios (Environ Health Perspect 2004;112: 69-78).
En resumen, hay evidencias claras de una relación entre el ambiente intrauterino al que es expuesto un feto y el desarrollo de enfermedades en ese adulto; la mayor frecuencia de patologías se observa en los niños PEG, que son más vulnerables, pero los niños GEG también tienen un mayor riesgo.
Recomendaciones
- Las mujeres en edad fértil deben recibir educación preventiva y tener el mejor entorno ambiental, social y psicológico posible, lo que va mucho más allá de las acciones médicas.
- En el control prenatal se debe: evitar tanto el déficit como el exceso de peso en la embarazada; promover la alimentación equilibrada; asegurar la ingesta de ácido fólico, fierro y calcio; suprimir la ingesta de alcohol, uso de tabaco y drogas; y mantener un buen control de la glicemia, el colesterol y la presión arterial.
- En el control pediátrico, no se debe permitir la ganancia ponderal rápida ni la obesidad; y se debe hacer un seguimiento especial en los niños de riesgo (PEG y GEG); se debe fomentar los hábitos saludables y se debe detectar precozmente las patologías mencionadas, ya que las intervenciones tempranas podrían revertir algunos de los efectos de la programación.

