Publicado el 1 de mayo de 2008 | http://doi.org/10.5867/medwave.2008.04.408
Registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas (fase II)
Spanish registry of adverse events of biological therapies in rheumatic diseases (Phase II)
Resumen
Actas Reuniones Científicas Sociedad Chilena de Reumatología.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Reumatología.
Presidente SOCHIRE: Dr. Pedro Miranda.
Coordinadora Reuniones Científicas: Dra. Marta Aliste.
Introducción
En esta presentación se describirá BIOBADASER, el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas. El investigador principal es el Dr. Juan Gómez-Reino, del Hospital Clínico Universitario de Santiago; los investigadores colaboradores son la Dra. Loreto Carmona, reumatóloga epidemióloga formada en San Francisco, Estados Unidos, de la unidad de investigación de la sociedad española (SER), que lidera la base de datos; el Dr. Francisco de Abajo, que pertenece a la división de farmacovigilancia del gobierno español (AEMPS); el Dr. Miguel Ángel Maciá, de la misma división; y Beatriz Pérez Zafrilla, químico farmacéutico, especialista en farmacovigilancia, como coordinadora y monitora. La sociedad española tiene un programador informático, Don Juan Barrio, de la Fundación Española de Reumatología y un Estadístico, Don Miguel Ángel Descalzo, de la Unidad de Investigación de la Fundación Española de Reumatología; ellos están a cargo del manejo y supervisión de todos los problemas que surjan en la base de datos on line.
En el año 2000, la agencia española de medicamentos y productos sanitarios autorizó por primera vez el uso de un producto biológico en humanos y estableció la necesidad de llevar un registro de los tratamientos biológicos, para tener información sobre la seguridad y efectividad de éstos. Se invitó a todos los centros de España a participar de este proyecto; en la primera versión del BIOBADASER participaron 14 centros hospitalarios de España y en la actualidad se está utilizando una segunda versión. La base de datos chilena se llamará BIOBADASER Chile; el Dr. Pedro Miranda estuvo en la reunión realizada en la ciudad de Boston sobre este sistema.
Objetivos
Los objetivos de este proyecto de investigación son:
- Identificar los acontecimientos adversos relevantes que aparezcan durante el tratamiento de enfermedades reumáticas con terapias biológicas, y estimar su frecuencia de aparición. El médico debe reportar todos los hechos, porque no puede decidir en ese momento si están o no relacionados con el tratamiento.
- Identificar los efectos adversos inesperados que se presentan con estos nuevos tratamientos.
- Identificar los acontecimientos adversos relevantes que aparecen una vez que se ha suspendido el tratamiento.
- Estimar el riesgo relativo de aparición de todos los acontecimientos adversos en pacientes que están sometidos a terapias biológicas y en una cohorte de pacientes que no esté expuesta a biológicos.
- Identificar factores de riesgo de padecer reacciones adversas con estos tratamientos.
- Evaluar, en condiciones no experimentales, el tiempo transcurrido hasta la suspensión de terapias biológicas en pacientes con patología reumática, no solamente con artritis reumatoide (AR), así como los motivos que llevan a dicha interrupción.
El grupo que diseñó el proyecto decidió que no se iba a recoger de manera sistemática ninguna variable de efectividad, y que la interrupción de tratamiento por ineficacia se puede considerar como una variable de efectividad.
Diseño del estudio
BIOBADASER es un registro de tratamiento en el que se incluyen los pacientes a medida que comienzan con cualquier terapia biológica, siendo seguidos en forma indefinida, al menos para acontecimientos adversos concretos, como cáncer o infecciones lentas. Los pacientes que entran en el registro no son evaluados a intervalos regulares de forma específica para el registro, sino que sus médicos introducen las modificaciones en el registro a medida que se producen acontecimientos adversos o cambios en el tratamiento; es decir, no existe un registro formal de los pacientes cada cierto tiempo, sino que el médico debe preocuparse de introducir las modificaciones necesarias en el registro. Gracias a este registro se reportaron los primeros casos de tuberculosis secundarios al uso de biológicos.
El análisis estadístico se realiza con medidas de tendencia central y dispersión; se obtienen curvas y tablas de Kaplan Meier para describir los tiempos de utilización de las terapias. Cuando se detecta infranotificación en un centro, se censuran los datos de los pacientes de dicho centro a partir de la fecha de la última notificación fiable. Esto, porque al principio todos los centros mostraron buena disposición, entre 2000 y 2007 algunos de ellos fueron perdiendo pacientes; en ese momento se implementó una monitorización telefónica y/o in situ para revisar las fichas y se detectó de que en muchos casos los datos no eran verídicos, por lo que se decidió sacar a los centros no confiables del sistema. Por eso en el registro actual, BIOBADASER II, participan menos centros.
Se utiliza como grupo de comparación o control una cohorte externa, paralela: la cohorte EMECAR (Estudio de Morbilidad y Expresión Clínica de la Artritis Reumatoide), que consta de 789 pacientes con artritis reumatoide sin exposición a biológicos, que fueron seguidos en el tiempo con todo tipo de variables. Las variables principales de este estudio fueron los acontecimientos adversos relevantes, el tiempo hasta la interrupción del tratamiento y la frecuencia de acontecimientos adversos. El principal objetivo de EMECAR es tener una visión general del estado del paciente con artritis reumatoide en España, mediante una cohorte representativa de pacientes, seguida durante al menos 5 años consecutivos, en la que se observa actividad clínica, capacidad funcional media, gravedad clínica media y daño radiológico, prevalencia puntual y acumulada, incidencia anual de procesos relacionados a AR, comorbilidad, remisiones y evolución de la calidad de vida.
Los criterios de selección de pacientes para incluir en la segunda fase del BIOBADASER son los siguientes:
- Todos los pacientes que inicien terapias biológicas desde el 20 de octubre de 2006, independientemente de la enfermedad reumatológica para la que se indique, es decir, uso aprobado o compasivo. La lista de patologías reumatológicas ha ido en aumento.
- Pacientes que se encuentren en tratamiento con terapias biológicas o que hayan suspendido el tratamiento por cualquier causa, siempre y cuando no haya transcurrido más de un año desde que tomaron por última vez el tratamiento y se disponga de todos los datos necesarios para el registro (del paciente, del tratamiento y de los acontecimientos adversos).
- Los pacientes que autoricen la recogida prospectiva de datos, según fórmula indicada en consentimiento informado. Los pacientes que están en un protocolo de drogas previo se pueden incluir en el estudio, siempre y cuando dicho tratamiento sea conocido.
Los datos se recogen en una aplicación on line diseñada ad hoc; todos ocupan la misma plataforma. No se establecen momentos protocolizados de recogida de datos, sino que las notificaciones tienen lugar en el momento en que se producen los acontecimientos. Los datos son monitorizados semanalmente on line por un técnico con experiencia en farmacovigilancia, quien se preocupa que sean correctos. Se realiza una monitorización más detallada en una selección aleatoria de 10% de los registros, directamente con los responsables. En España, la químico-farmacéutica viaja a distintos hospitales y realiza una auditoría de las fichas clínicas para ver si corresponden a los datos ingresados en la base; esta profesional tiene un perfil y un código de acceso que le permite tener una visión de todos los hospitales o centros que están participando.
En la Fig. 1 se muestra el esquema de BIOBADASER que está on line. Cada centro, cada hospital tiene un código determinado; cada paciente tiene un código que corresponde a ese centro y cada paciente tiene un registro inicial. Se debe identificar todos los acontecimientos adversos (AA), así como cualquier cambio que exista, si existe un suceso fatal. Se realiza un seguimiento y cada 12 meses el estadístico descarga toda la información, la analiza mediante el programa estadístico STATA y elabora un informe anual y semestral sobre lo que ha pasado con las terapias (Fig. 1).
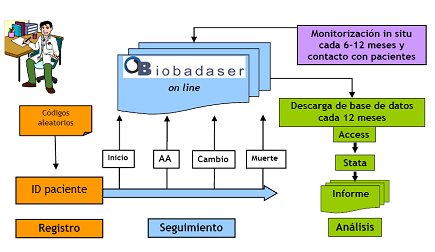 Tamaño completo
Tamaño completo Para el financiamiento del proyecto se solicitó ayuda económica a los siguientes laboratorios farmacéuticos: Schering-Plough SA, Wyeth Farma SA, Abbott Laboratorios SA, Bristol-Myers Squibb SL y Roche Farma SA. Todos han contribuido con la misma cantidad, que no sobrepasa al doble de la aportada por la SER o por la AEM y PS. En los contratos de colaboración firmados con la SER se especifica la independencia del registro para el análisis y la difusión de los datos y resultados. Cada laboratorio tiene acceso a información sobre sus productos, de los acontecimientos adversos, cuántos pacientes han suspendido la terapia, etc.; cada centro tiene acceso on line a su centro; sólo los monitores y la sociedad española tienen acceso completo a todos los datos. Lo mismo va a pasar con PANLAR (Pan-American League of Associations for Rheumatology): la sociedad española no va a llevar un registro de lo que se esté haciendo en Chile; potencialmente lo puede hacer, pero es más correcto que cada sociedad tenga sus registros en forma independiente.
En el año 2006 se había registrado 6.969 pacientes, gracias a un gran trabajo y el compromiso de todos los centros que participan. De estos pacientes, 64% presentan AR, 12,9%, espondilitis anquilosante y 11,8%, artritis psoriática. En cuanto a los acontecimientos adversos, se puede obtener el detalle; por ejemplo, si se quiere saber cuántas amigdalitis hubo por tal producto, se puede acceder a la base de datos y ver el número exacto de amigdalitis. La mayor cantidad de acontecimientos siguen siendo las infecciones, seguido por reacciones infusionales y alteraciones cutáneas, entre otras. Los medicamentos más utilizados en España son: infliximab (Remicade), anakinra (Kineret), adalimumab (Humira) y etanercept (Enbrel). Todavía no se comienza a prescribir abatecept (Orencia) y recién se está partiendo con rituximab (Rituxan). El número de acontecimientos adversos es 2.503 y se puede encontrar el detalle de todos los acontecimientos adversos que presenta el paciente (Tabla I).
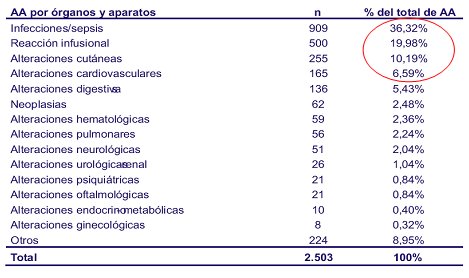 Tamaño completo
Tamaño completo Desde 2001 a enero de 2006, el número de pacientes ha ido aumentando en el registro español, pero el número de centros se ha mantenido. Se decidió que el aporte mínimo debía ser de 100 pacientes por centro. Colaboraron todos los centros que tuvieron disposición a participar en el registro y se decidió que deben tener un porcentaje de fallos inferior a 25% para evitar su retiro de la base de datos.
Se puede obtener del registro el número de tratamientos iniciados por semestre y año de cada uno de los agentes biológicos. La prescripción de infliximab aumentó, pero luego ha disminuido; el segundo biológico que más se prescribe en España es el etanercept, y en menor cantidad, por los tiempos de aprobaciones, está el rituximab. En mayo 2007 anakinra pidió un informe y se le entregó el detalle de las suspensiones del tratamiento (Fig. 2).
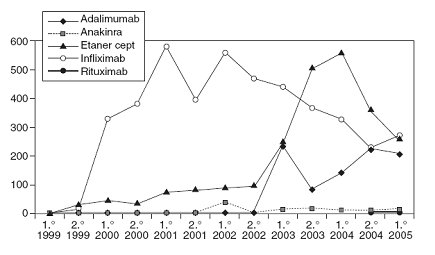 Tamaño completo
Tamaño completo Se puede acceder rápidamente al protocolo de BIOBADASER que está en Internet a través de Google y obtener en detalle el protocolo, las descripciones, los aspectos éticos, etc., pero para acceder al registro se necesita una clave, que está asignada para cada centro y permite entrar a un registro de pruebas. Una vez que se ingresa la clave se abre una página que tiene el identificador de cada centro y luego el nombre del paciente, la fecha de nacimiento, diagnóstico, sexo y la monitorización. (Fig. 3).
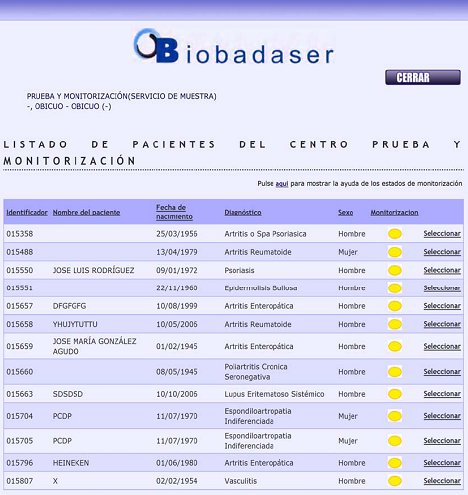 Tamaño completo
Tamaño completo Luego se puede ingresar al registro individual de cada paciente para agregar otro diagnóstico. Al pedir “seleccionar diagnóstico” se despliegan todas las enfermedades que se han ido incluyendo; si el diagnóstico no está dentro de la lista, el interesado se debe comunicar directamente con España para lograr la inclusión de esta nueva enfermedad (Fig. 4).
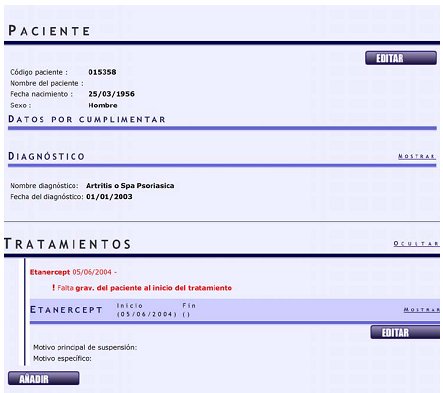 Tamaño completo
Tamaño completo Se debe indicar la fecha y luego se solicitan las especificaciones, por ejemplo, si la paciente tiene una afectación periférica, si los anticuerpos antinucleares son positivos o negativos, si el B27 es indeterminado, positivo o negativo y si hay alguna observación (Fig. 5).
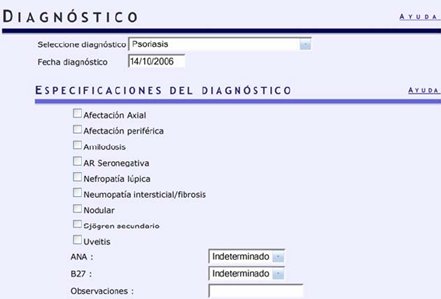 Tamaño completo
Tamaño completo También interesan las comorbilidades que presenta el paciente en el momento del diagnóstico. Por ejemplo, ésta paciente es diabética, se pone la fecha de inicio de la diabetes; les interesa el antecedente de linfoma y de hepatitis B y C. Luego se coloca aceptar y se continúa con el ingreso del tratamiento (Fig. 6).
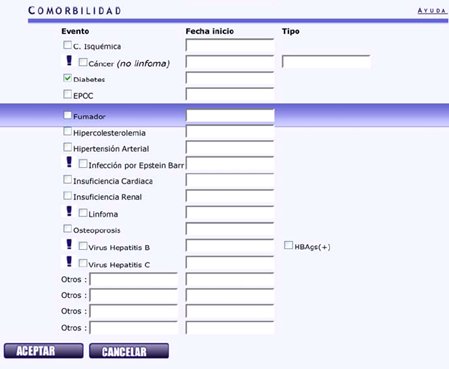 Tamaño completo
Tamaño completo Por ejemplo, si un paciente inicia tratamiento con adalimumab, interesa conocer los motivos del inicio del tratamiento y de la suspensión, datos que deben ser registrados por cada médico que esté a cargo de ese centro. Se debe elegir el fármaco biológico, la gravedad de la enfermedad, la fecha de fin del tratamiento y el motivo principal de la suspensión: acontecimiento adverso, embarazo, ineficacia, pérdida de la paciente, remisión, otras causas. Además es importante colocar con qué fármaco está en forma concomitante, por ejemplo, metotrexato o glucocorticoides. Interesa conocer la historia de tuberculosis: si hay historia previa, antecedente de vacuna y la probabilidad de contacto, lo que queda a criterio de cada médico, no está establecido cómo se define un contacto, y la radiografía de tórax: hallazgos claramente relacionados con la TBC, hallazgos no relacionados o sin hallazgos. Si se hace un booster, interesa saber la fecha.
Luego se puede añadir un acontecimiento adverso; por ejemplo, esta paciente hizo una exacerbación de la psoriasis con el adalimumab (Fig. 7).
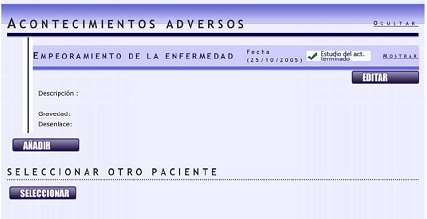 Tamaño completo
Tamaño completo Posteriormente se preguntará si el acontecimiento está aún en estudio o si ya está tratado, así como todos los detalles sobre el AA (Fig. 8).
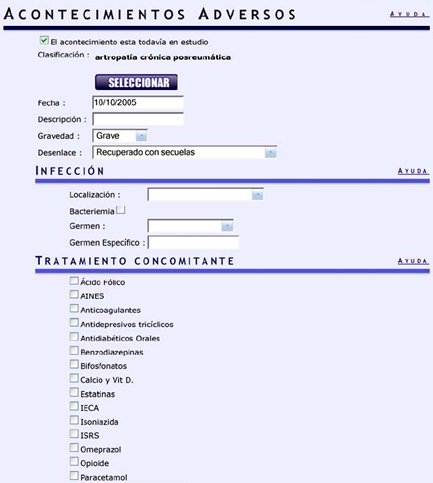 Tamaño completo
Tamaño completo Existen distintas bases de datos, y cada país en Europa y en América tiene diferentes maneras de notificar sus acontecimientos adversos. En Europa se ha tratado de unificar los criterios a través del MedDRA (Medical Dictionary for Regulatory Activities), un diccionario que reúne todos los acontecimientos adversos. Es un eje multiaxial que permite el acceso directo a una serie de circunstancias sociales, embarazo, infecciones, etc., todo lo que le puede pasar al paciente y se abren nuevas opciones hasta que queda registrado el acontecimiento adverso, por ejemplo, una depresión posparto. Si no se ponen los datos la base los solicita en forma automática, y es obligatorio escribir la fecha del acontecimiento adverso.
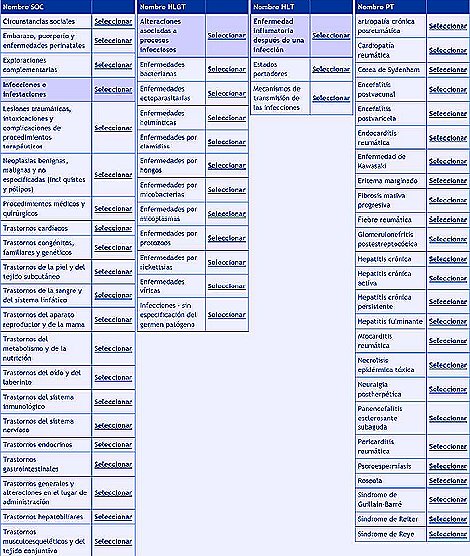 Tamaño completo
Tamaño completo Existe un acápite para infecciones, en donde interesa que se localice el sitio de la infección, si existe bacteremia, cuál es el germen, si es grampositivo o gramnegativo y qué tratamientos concomitantes estaba recibiendo el paciente en el momento de presentar la infección. La cantidad de datos a ingresar por paciente no es muy grande: el inicio, la gravedad y si se realizó las pruebas de tuberculosis, porque la base de datos está diseñada para registrar los acontecimientos adversos y las suspensiones de tratamiento.
El número de pacientes registrados es 8.866, el número de tratamientos que se han realizado a estos pacientes es 11.264 y el registro de acontecimientos adversos de esta base de datos alcanza a más de 5.000. Existe una estadística por sexo, edad, diagnóstico del paciente, duración de la enfermedad; con sólo un clic se puede obtener la duración de la enfermedad, el máximo, el mínimo, la media y la desviación estándar. En este momento están en tratamiento 47% de pacientes con infliximab y 32% de pacientes con etanercept. Los datos que se solicitan son: motivos de finalización del tratamiento, presencia y tipo de comorbilidad, tipos de fármacos que utilizan, tipos de tratamientos concomitantes y cuál ha sido la gravedad de los acontecimientos adversos. Se ha registrado 2,5% de acontecimientos mortales y 22% de acontecimientos adversos.
Se puede saber la etiología de las enfermedades: virales, bacterianas; la localización de la infección; cuántas infecciones urinarias hubo por cada tratamiento, endocarditis, meningitis, prótesis articulares, dengue, brucelosis y el más completo detalle de todos los acontecimientos adversos. Es una fuente inagotable de publicaciones.
BIOBADACHILE
Para finalizar, se hace una invitación extensiva a todos los reumatólogos y a los responsables de cada institución, a recibir capacitación por Internet.
En Chile se debe crear una cohorte sin biológicos, lo que debería ser fácil porque hay muchos pacientes sin terapia biológica.
La primera reunión del Biobadamerica va a ser en PANLAR, en Guatemala y es importante participar, ya que en la medida en que se desarrolle un buen registro se podrá hacer presión en el Ministerio de Salud (MINSAL) para que el tratamiento con fármacos biológicos se incluya en las Garantías Explícitas en Salud (GES).

