Introducción a la medicina basada en evidencias
← vista completaPublicado el 1 de agosto de 2011 | http://doi.org/10.5867/medwave.2011.08.5110
Estudios sobre el tratamiento de las enfermedades
Studies on the treatment of diseases
Resumen
En la sección Series, Medwave publica artículos relacionados con el desarrollo y discusión de herramientas metodológicas para la investigación clínica, la gestión en salud, la gestión de la calidad y otros temas de interés. En esta edición se presentan dos artículos que forman parte del programa de formación en Medicina Basada en Evidencias que se dicta por e-Campus de Medwave. El artículo siguiente pertenece a la Serie "Introducción a la Medicina Basada en Evidencias".
Diseños para medir efectividad de terapias
La efectividad de las terapias puede ser evaluada a través de distintos métodos.
Series de casos
La evidencia de menor nivel la proporciona este tipo de estudios, en los que simplemente se describen los efectos de un tratamiento en un grupo de pacientes. Pese a las limitaciones de no disponer de un grupo control, las series de casos han servido al desarrollo y difusión de nuevas técnicas quirúrgicas y de otros procedimientos no farmacológicos, cuando los ensayos clínicos son difíciles de llevar a cabo, o se consideran un método demasiado complejo para evaluar esa técnica o procedimiento.
También es posible encontrarlas como método preferente de investigación en el tratamiento de enfermedades extremadamente raras, porque no es posible reclutar suficientes pacientes para un ensayo controlado.
Estudios de cohorte
En ocasiones encontrará usted estudios en los que se analizan retrospectivamente dos o más grupos de pacientes (cohortes) sometidos a distintas formas de tratamiento que se pretende comparar entre sí, por ejemplo: Hato N, Matsumoto S, Kisaki H, Takahashi H, Wakisaka H, Honda N, Gyo K, Murakami S, Yanagihara N. Efficacy of early treatment of Bell's palsy with oral acyclovir and prednisolone. Otol Neurotol. 2003 Nov;24(6):948-51.
En otras, el estudio se plantea de modo prospectivo: Prat M., Hernán. Antihypertensive effects of valsartan: Results of a national multicentric study. Rev. méd. Chile, May 2000, vol.128, no.5, p.475-482. ISSN 0034-9887.
Ya sean prospectivos o retrospectivos, este tipo de estudios observacionales que pretenden comparar la efectividad de dos formas de tratamiento tienen un alto potencial de sesgo, por lo que sólo debieran ser considerados en situaciones muy especiales y después de un análisis crítico riguroso de los mismos y del resto de la evidencia disponible en torno al tema.
Sin perjuicio de lo anterior, a veces los estudios de cohorte han servido a la evaluación de la efectividad de ciertas terapias, complementando la información aportada por los ensayos clínicos. Algunos autores han hecho la distinción entre la evaluación de la efectividad de las intervenciones a escala individual, cuyo patrón en cuanto a diseño son los ensayos clínicos, y aquellas de nivel poblacional, representadas por distintas variedades de estudios de cohorte. La medición de la efectividad a nivel poblacional difiere de la evaluación individual en cuanto busca proporcionar una estimación de la reducción producida en la carga de la enfermedad en una población después de que el tratamiento ha sido introducido en la misma a gran escala.
Las limitaciones y ventajas de utilizar estudios de cohorte bajo estas condiciones han sido analizadas muy claramente por Sabin en el siguiente artículo: Sabin CA, Phillips AN. Treatment comparisons in HIV infection: the benefits and limitations of observational cohort studies. J Antimicrob Chemother. 2001 Apr;47(4):371-5
Ensayos clínicos
Los ensayos clínicos son el método de excelencia para investigar la efectividad de las terapias. No obstante, existe una variedad de diseños y subcategorías dentro de ellos. En un extremo de la escala -en cuanto a la calidad de la evidencia que proveen- se encuentran los clásicos ensayos aleatorizados doble ciego de alto poder (de gran tamaño muestral) y en el otro podríamos situar los estudios de intervención no controlados. Algunos sostienen que todo ensayo clínico debe poseer un grupo control contemporáneo, o simplemente no constituye un ensayo clínico. Dejaremos ese análisis para otra ocasión, y nos limitaremos a mostrarle un ejemplo de estudio sin grupo control.
Estudios de intervención no controlados
Esta es una variedad de ensayo que se encuentra con bastante frecuencia en la literatura médica, en el que a un grupo de pacientes se le mide una variable en condiciones basales, luego se le administra el tratamiento experimental y, más tarde, se vuelve a medir la misma variable para detectar si se ha modificado (antes-después). Ejemplo: Karpov YA, Vilchinskaya MY, Sorokin EV, Podinovskaya VA. Efficacy and tolerability of cilazapril in patients with essential hypertension. J Cardiovasc Pharmacol. 1994;24 Suppl 3:S86-8.
Las limitaciones de no disponer de un grupo control independiente ya las hemos comentado. No obstante, los resultados de este tipo de estudios pueden ser de utilidad -en ausencia de un estudio controlado- cuando el efecto es de gran magnitud, se produce de manera consistente en la mayoría de los pacientes y, por lo tanto, es poco probable que se deba al azar o a las fluctuaciones naturales de la enfermedad.
Nota: En estudios como el del ejemplo anterior (Karpov), los investigadores suelen señalar que los pacientes tratados fueron controles de sí mismos. Esto puede llevar a confundir estos estudios con los ensayos “cruzados” [cross-over], que son una forma de ensayo clínico controlado metodológicamente distinta y más rigurosa, que abordaremos más adelante.
Estudios experimentales con controles externos
En ocasiones, al no disponer de un grupo contemporáneo de pacientes que les sirva de control, los autores deciden comparar los resultados obtenidos en sus pacientes con un grupo control “externo”, es decir, un grupo de individuos distintos a los de la población del estudio. La comparación puede hacerse con los resultados de otro estudio ya publicado, o con una serie anterior (histórica) de pacientes tratados en la misma institución. Como imaginará, los problemas con este tipo de comparaciones derivan de:
- Diferencias en las características basales de los pacientes
- Las diferencias de entorno, tipo de atención, e intervenciones adicionales recibidas en cada caso.
Generalmente, los estudios que utilizan controles externos tienden a sobreestimar la efectividad de los tratamientos. He aquí un ejemplo de este tipo de estudios: Tacchino RM, Mancini A, Perrelli M, Bianchi A, Giampietro A, Milardi D, Vezzosi C, Sacco E, De Marinis L. Body composition and energy expenditure: relationship and changes in obese subjects before and after biliopancreatic diversion. Metabolism. 2003 May;52(5):552-8.
Estudios experimentales con controles contemporáneos
Son propiamente los ensayos clínicos. Básicamente, lo que hacen estos estudios es comparar una terapia (o una intervención preventiva, en cuyo caso los principios son los mismos) con:
- Administrar un placebo
- Administrar un tratamiento efectivo establecido (tratamiento alternativo)
- La misma intervención en una dosis o intensidad distinta
- No hacer nada.
Para ello se identifica una muestra de pacientes con la enfermedad que se desea tratar y se les divide en dos o más grupos. Al grupo de tratamiento (grupo “activo”) se le aplica el tratamiento experimental y al otro(s) las intervenciones alternativas. Al cabo de un período preestablecido, se miden los desenlaces en ambos grupos y se comparan, para evaluar si existe alguna asociación entre el tratamiento aplicado y el riesgo de ocurrencia del desenlace. Ver esquema:
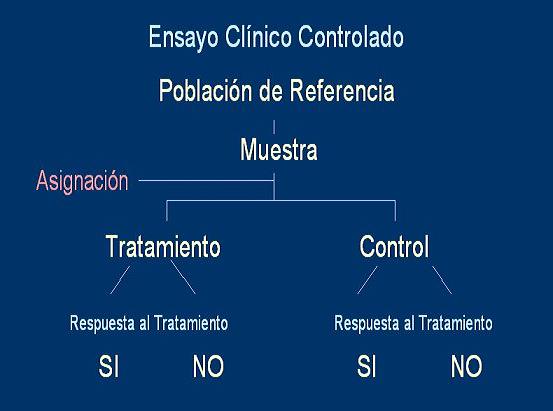
Los resultados se expresan en los mismos términos de un estudio de cohorte, mediante medidas de riesgo relativo (RR, OR, Hazard Risk) o curvas de sobrevida.
Aspectos relevantes para analizar un ensayo clínico
El método de asignación de los pacientes a los grupos
Es importante que los grupos sean lo más homogéneos posibles en aquellas variables que pueden influir, además del tratamiento aplicado, en el desenlace de los pacientes. En los estudios observacionales, podíamos utilizar técnicas como el pareo -ejemplo: por sexo y edad, por estado de avance de la enfermedad- y/o ajustar los resultados mediante análisis multivariado. Los estudios experimentales, por su parte, ofrecen la oportunidad única de manipular el proceso de conformación de los grupos, para lograr este objetivo.
Una vez que se ha constatado que el paciente satisface los criterios de inclusión y exclusión –ejemplo: tiene un diagnóstico claro de la patología, está en el rango de edad y no tiene ninguna de las contraindicaciones fijadas en el protocolo-, se le invita a participar y a dar su consentimiento informado. Si acepta, se incorpora al ensayo y debe ser asignado a uno de sus grupos o ramas.
Una forma de resolver qué pacientes van a la rama de tratamiento y a la de control es que el investigador lo decida directamente. Esta no es la forma apropiada; el problema está en que, consciente o inconscientemente, podría producirse una tendencia a acumular pacientes con mejor o peor pronóstico de base en un grupo del estudio más que en otro (sesgo de selección). Por ejemplo, producto del interés por demostrar la efectividad de la terapia, el investigador podría verse tentado –aún inconscientemente, vamos a pensar bien de los investigadores en general- a acumular pacientes con cuadros clínicamente más benignos, de aspecto “más saludable” y con menores enfermedades asociadas en el grupo de tratamiento, con lo cual su evolución será mejor por ese solo hecho, sin perjuicio del efecto que pueda ejercer la terapia. Al revés, podría asignar al grupo de tratamiento a aquellos pacientes más afectados, porque piensa que se van a beneficiar de la terapia más que con el tratamiento alternativo o el placebo.
La primera conclusión entonces, es que la asignación de los pacientes a un grupo u otro no debe ser discrecional. ¿Cuáles son las alternativas? Fundamentalmente dos:
1. Cuasialeatorización (cuasirandomización)
Consiste en asignar los pacientes por métodos que remedan el simple azar, tales como: a) Alternancia: el primer paciente va al grupo tratamiento, el segundo al control y así sucesivamente. b) Según el día de la semana en que es reclutado el paciente (ejemplo: los lunes y miércoles se asignan a tratamiento y los martes y jueves al control). c) Según el número de ficha clínica: los pares al tratamiento y los impares al control.
En la aleatorización verdadera, la asignación ocurre estrictamente por azar. Esto implica que todos los pacientes tienen igual posibilidad inicial de ser asignados a cualquiera de los grupos. En la cuasirandomización, esto no se cumple: si se está aplicando alternancia el destino del paciente está determinado por la asignación del paciente anterior a él; si es el número de ficha y la suya es par, el paciente no tiene opción, será asignado al grupo que le corresponde a los números pares de acuerdo al protocolo. Ello introduce un cierto potencial de sesgo del estudio. Si el investigador no está ciego al tratamiento, sabrá de antemano a qué grupo va a ser destinado el paciente: bastará mirar el número de ficha, o recordar a qué grupo fue asignado el paciente anterior. En tal caso, podría decidir no reclutarlo para el estudio, porque el grupo al que le corresponde asignarlo no es el que hubiera preferido para ese paciente. Más allá de esta limitante teórica –su importancia práctica es discutible- la cuasi aleatorización de los pacientes tiende a producir el efecto que estamos buscando, es decir, grupos homogéneos en todas aquellas variables que pueden influir sobre los desenlaces además del tratamiento.
2. Aleatorización (randomización)
En este caso la asignación ocurre estrictamente por azar y por definición es impredecible. A medida que avanza el proceso de asignación, el azar tiende a producir grupos totalmente homogéneos, no sólo en las variables confusoras conocidas, sino también en otras variables desconocidas que pudieran tener efecto sobre los desenlaces y que no tenemos identificadas de antemano. Cuando ya se ha randomizado 200 pacientes o más, se puede asumir que no existirá ningún desbalance importante entre los grupos (en estudios con poco número de pacientes podríamos encontrar de todas formas diferencias que afecten la validez de los resultados).
¿Cómo se puede realizar la randomización? He aquí algunos métodos:
- Lanzar una moneda al aire (cara tratamiento, sello control) o dados (si la suma es par tratamiento, si es impar control)
- Utilizar una tabla de números aleatorios como la de la figura. Consecutivamente, cada nuevo paciente que ingresa al estudio se asigna a los grupos según el número que le correspondió de la tabla (por ejemplo, si el número es par va a tratamiento y si es impar a control). La tabla se va leyendo de acuerdo a un orden preestablecido.

Utilizar secuencias creadas por computador. Existen programas para ello:
La secuencia se puede administrar desde una central distante (el investigador llama y se le indica a qué grupo va el paciente según la secuencia). También se pueden crear sobres sellados con la asignación en su interior, que se ordenan de acuerdo a la secuencia aleatoria original. Una vez registrado el paciente en el estudio, se abre el sobre y se asigna al grupo que le corresponde.
El ensayo clínico aleatorizado (Randomised Controlled Trial) es considerado el método de excelencia para la investigación sobre la efectividad de las intervenciones, el que aporta los resultados de mayor validez, “la mejor evidencia”.
El uso de enmascaramiento (ciego)
Consiste en ocultar a los participantes del estudio, a qué grupo fue asignado el paciente. En teoría, el ciego puede alcanzar hasta quien analiza los datos, inclusive hasta quien redacta el artículo y sus conclusiones. En la práctica, la mayoría de los estudios que utilizan enmascaramiento son ciegos simples (afecta sólo a uno de los participantes) o doble ciego (dos participantes).
El enmascaramiento sólo es posible cuando existe un placebo u otra terapia de control de iguales características externas que el tratamiento activo, o éstas se pueden ocultar a la vista de los participantes del estudio (ejemplo: colocando una bolsa opaca sobre el sistema de infusión endovenosa). Si la comparación es entre un tratamiento médico y uno quirúrgico difícilmente podremos cegarlo.
Las ventajas del ciego incluyen:
- Si quien ejecuta la intervención no sabe qué es lo que le está administrando al paciente, el énfasis y cuidado que pondrá en el proceso será el mismo entre los grupos.
- Si el paciente no lo sabe, no se dejará influenciar por ello para relatar sus síntomas, su percepción de bienestar, la respuesta subjetiva al “tratamiento”, o la identificación de eventos adversos.
- Si quien mide los desenlaces no lo sabe, recogerá los datos en ambos grupos con la misma objetividad y acuciosidad.
Principalmente entonces, la falta de ciego expone al estudio a sesgo de medición, es decir, que los desenlaces sean evaluados de forma distinta entre el grupo activo y el control, haciendo aparecer una asociación inexistente o modificando la magnitud de una asociación real.
Por cierto, en estos casos el estudio es especialmente vulnerable a sesgo cuando el desenlace tiene un componente subjetivo, por ejemplo:
- El promedio de días de estada, si el alta la decide un médico participante en el estudio de acuerdo a su criterio (si conoce el grupo al que pertenece el paciente, su actitud para el alta quizás no sea la misma con ambos grupos).
- Respuesta analgésica: si el paciente sabe que está recibiendo sólo un placebo y no un fármaco activo lo más probable es que se declare insatisfecho con el control del dolor. Si no lo sabe, quizás perciba un efecto mayor o lo considere aceptable.
La proporción de pérdidas de seguimiento
Tal como comentamos previamente, las pérdidas de seguimiento generan incertidumbre sobre la validez de los resultados. Cuando las pérdidas se relacionan de alguna manera con las variables en estudio –no siempre lo hacen-, pueden además producir sesgo (error).
Por ejemplo: supongamos que las pérdidas en el grupo bajo tratamiento activo corresponden principalmente a pacientes que no respondieron bien a la terapia y decidieron cambiar su lugar de atención por este motivo. En tal caso, la proporción de respuestas exitosas en los pacientes que quedaron en el estudio será más alta de lo real y se producirá una sobreestimación de la efectividad de la terapia.
La mayoría de los estudios tiene algún grado de pérdidas de seguimiento. Usted debe evaluar en cada caso hasta qué punto las pérdidas reportadas son significativas. Si el estudio no especifica si hubo pérdidas y no es posible deducirlo de la lectura del artículo, está en su derecho a cuestionar la validez de los resultados.
Los artículos de la Serie "Introducción a la Medicina Basada en Evidencias" provienen del curso Introducción a la Medicina Basada en Evidencias y a la Investigación Clínica. Si le interesa ahondar en estos contenidos, le invitamos a tomar el curso en el siguiente link.

