Publicado el 1 de abril de 2008 | http://doi.org/10.5867/medwave.2008.03.2567
Neuroplasticidad y dolor: hacia nuevos rumbos de tratamiento
Neuroplasticity and pain: new directions for treatment
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión científica de la Asociación Chilena para el Estudio del Dolor (ACHED). Presidenta ACHED: Dra. Juana Jaque.
Misión del dolor
Por millones de años, el dolor ha protegido a los humanos y otras criaturas alertándolos de la existencia de un riesgo o peligro de daño; es decir, el dolor avisa al organismo que está sufriendo daño o que está en riesgo de sufrirlo. Sherrington definió el dolor como una ayuda psíquica para un imperativo reflejo protector; en neurofisiología siempre se ha considerado al dolor como un proceso intrapsíquico que deriva de un estímulo dañino y determina una respuesta o conducta motora adecuada para ponerse a salvo.
Para que se produzca dolor debe haber: estímulo dañino, que se conoce como nociocepción; modulación central; percepción e interpretación como dolor; cambio emocional, generalmente una sensación desagradable conocida como sufrimiento; y por último, una reacción o conducta dolorosa acorde con el estímulo, que permite al individuo huir o golpear y derrotar al agresor. Por lo tanto, el dolor siempre provoca una conducta.
Cuando el dolor se mantiene por tiempo prolongado o cuando, por alguna circunstancia, quien sufre el dolor no lo encuentra adecuado a la situación, según su sistema de comparación de experiencias, se le produce un trastorno emocional o disforia, término psiquiátrico que describe aquella situación en que toda la organización conocida por el individuo se transforma en un sufrimiento, un estado de ánimo, una emoción negativa que, como se decía antiguamente, es la verdadera pasión del alma: el dolor (Fig. 1).
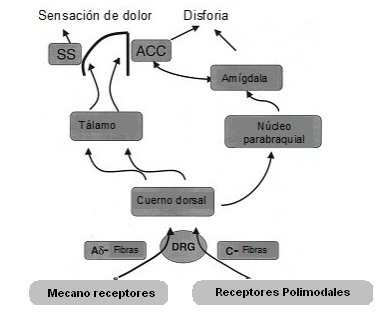 Tamaño completo
Tamaño completo Figura 1. Vías del dolor. SS = cortex somatosensorial; ACC = cortex cingulado anterior; DRG = ganglio dorsal
Síndrome de dolor crónico
A lo largo de la historia, los seres humanos se han preguntado porqué un dolor se puede convertir, de algo bueno que ayuda a reaccionar y salir de la situación de peligro y daño para el organismo, en algo que hace sufrir, más aun si persiste en el tiempo y llega a constituir un dolor crónico, que se caracteriza por la presencia de:
- dolor intratable que dura más de 4-6 meses,
- asociado a profunda alteración conductual,
- reducción de actividades diarias,
- excesiva medicación y múltiples consultas a especialistas,
- ausencia de organicidad,
- historia de múltiples exámenes, tratamientos y cirugías.
Lo que más llama la atención es que, tras múltiples estudios y entrevistas con el paciente, no se encuentra una causa orgánica clara que explique el sufrimiento que describe el paciente, por lo que se solicitan innumerables exámenes sin lograr resultados, lo que es malo para el paciente y para la relación médico-paciente y frustrante para el médico.
En cuanto al control del dolor, el Gold Standard es el antiguo opio, que se usó en Sumeria hace 5000 años, y su derivado moderno, la morfina; sin embargo, estas sustancias provocan sensación de impotencia y desconocimiento en los médicos tratantes y suelen ser utilizados sólo por los especialistas en el manejo del dolor.
La forma en que se modulan las señales que llegan al organismo todavía no se conoce con precisión; por ejemplo, no se sabe porqué las fibras se conectan y ordenan para constituir una vía táctil epicrítica o protopática, ni porqué el mismo estímulo puede ocasionar o no una sensación desagradable en distintos individuos, porqué unos resisten más el dolor, porqué mujeres y hombres sienten el dolor de manera distinta. Más aún, entre las mujeres, las pelirrojas con efélides tienen una sensibilidad distinta al dolor, genéticamente determinada, que hace que respondan de manera distinta a analgésicos y anestésicos: por ejemplo, tienen un umbral del dolor más alto, pero la lidocaína no les hace tanto efecto como a otras mujeres en los tratamientos dentales. Jeffrey Mogil, de Canadá, descubrió que esta característica se relaciona con la melanocortina, sustancia que puede modular la expresión de los melanocitos. Las mujeres colorinas son despigmentadas y por eso tienen pecas: el color de las pecas iba a ser el color normal de su piel, pero, como se despigmentaron, se ven blancas con efélides. El pelo es rojizo porque les falta melanina, hecho que reduce su susceptibilidad al dolor, pero también reduce la capacidad de responder a algunos anestésicos; lo anterior tiene que ver con la vía de la dopamina, que es un neurotransmisor y participa en la modulación descendente del dolor. Entonces, ciertos genes presentes en la población general se manifiestan en fenotipos de color de pelo y de umbral del dolor, lo que se debe a diferencias en la constitución de las vías dolorosas y, por ende, en las emociones que va a generar el estímulo doloroso (1).
Se ha demostrado que los determinantes genéticos se expresan en la corteza cerebral. En la Fig. 2 se muestra un estudio de resonancia magnética funcional, que sirve para determinar los tipos de proteína presentes en la corteza, mediante el cual se realizó un mapeo proteico de ésta. El estudio demostró que en individuos sin conexión genética directa, distantes por más de tres generaciones, no había elementos de coincidencia proteica en la corteza, mientras que en hermanos o gemelos heterocigotos aparecían coincidencias en los componentes estructurales de la corteza, los que finalmente se traducen en el tipo de sinapsis y de vías. Los gemelos idénticos univitelinos, homocigotos, tenían gran cantidad de áreas coincidentes en la conformación proteica de la corteza cerebral, que aparecen en rojo en la figura.
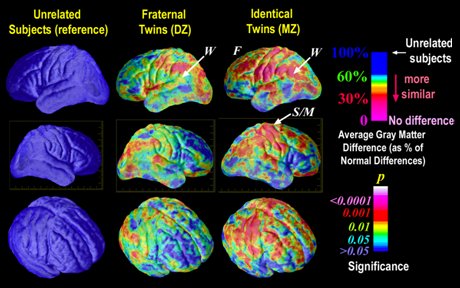 Tamaño completo
Tamaño completo Figura 2. Determinantes genéticos en la corteza cerebral
Lo mismo pasa con otros genes que se expresan con otros fenotipos que incluyen, por ejemplo, la presencia de Alzheimer, corea, epilepsia o un mejor desarrollo intelectual; de modo que las conformaciones proteicas de las distintas estructuras cerebrales no solamente van a determinar la forma en que cada individuo tolera o siente el dolor y su respuesta a analgésicos y anestésicos, sino que también van a tener que ver con el desarrollo del lenguaje y de las aptitudes matemáticas, musicales, etc. La manera en que la red de neuronas se interconecta tiene una clara relación con la carga genética y con factores ambientales presentes durante el desarrollo fetal del individuo. A las 16 semanas de gestación, el ser humano tiene más o menos 30.000 millones de células nerviosas; al nacer tiene alrededor de 10.000 millones de neuronas; los 20.000 millones restantes se perdieron durante la migración y conforman la neuroglia. En ese momento de la gestación se conforman todas las vías nerviosas, bajo la dirección de los determinantes genéticos; si la madre está expuesta a alcohol, tabaco o contaminantes ambientales, como los organofosforados, la migración neuronal y el desarrollo de las distintas vías se altera. Las últimas migraciones celulares tienen lugar a los 18 años de edad, en las mujeres y a los 25 años, en los hombres; hasta esa edad todavía se están modulando todos estos circuitos (Fig. 3).
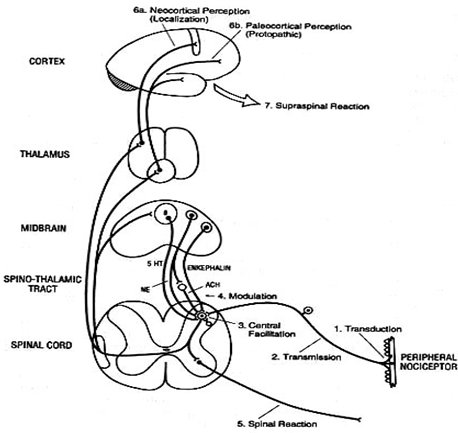 Tamaño completo
Tamaño completo Figura 3. Vías del dolor
Amplificación del dolor
El complejo de expresión genética, ubicado en el núcleo de la neurona, responde a muchos estímulos desde la etapa intrauterina hasta la vida actual del individuo. Se puede identificar más de 200 tipos de RNA mensajero (RNAm) que se sintetizan en forma aguda después de un estímulo doloroso en neuronas de segundo orden de la médula espinal; se sabe que estos RNAm son expresiones de 200 genes distintos ubicados en el DNA, en el núcleo de las neuronas, pero no se sabe qué determina que este RNAm sea captado por los ribosomas, determinando en ellos la síntesis de determinadas proteínas que van a cumplir distintas funciones en organelos, vesículas de secreción de neurotransmisores y membranas. Además estas proteínas ejercen una retroalimentación en el núcleo, informando a éste que debe detener la síntesis. Todas las vías que se conocen, que están involucradas en la cascada fisiológica normal que se produce frente a un estímulo sensitivo doloroso, están codificadas por proteínas cuya síntesis nuclear se activa frente a estímulos exógenos o endógenos (Fig. 4).
 Tamaño completo
Tamaño completo Figura 4. Cascada fisiológica normal del dolor
El fenómeno de la sensibilización periférica consiste en que la presencia de un estímulo doloroso no genera el envío de información hacia el núcleo, de modo que en la respuesta no hay participación del RNAm nuclear, sino que en el terminal dendrítico de la neurona hay suficiente RNAm y ribosomas para iniciar la síntesis de una serie de sustancias que van a potenciar la inflamación, de las cuales la más conocida es la COX-2, que termina en la cascada de las prostaglandinas y es uno de los factores de amplificación de dolor local en la misma terminación dolorosa libre. Ahí hay un aumento en la síntesis de COX-2 sin que ninguno de estos estímulos haya llegado al núcleo y sin que éste haya enviado RNAm de vuelta hasta la dendrita (Fig. 5).
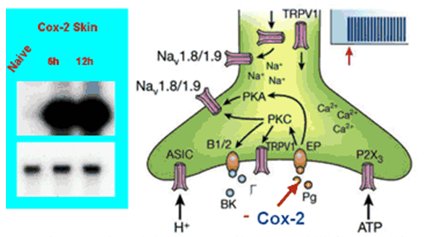 Tamaño completo
Tamaño completo Figura 5. Sensibilización periférica (adaptado de Scholz J, Wolf CJ. Nat Neurosci 2002; 5 (suppl 1): 1062-7)
La reorganización estructural es un fenómeno similar al que ocurre cuando una neurona muere por algún tipo de efecto tóxico: otras van a reemplazarla, de modo que la sinapsis que se establece en las distintas capas de las astas posteriores de la médula se altera. En la médula ocurre lo mismo: la COX-2 aumenta 20 veces cuando se mantiene un estímulo doloroso en la periferia, pero en este caso se está cerca del núcleo, de modo que los somas neuronales sintetizan mucho más rápidamente sustancias que van a favorecer la aparición de otras proteínas que, a su vez, perpetúan el dolor (Fig. 6).
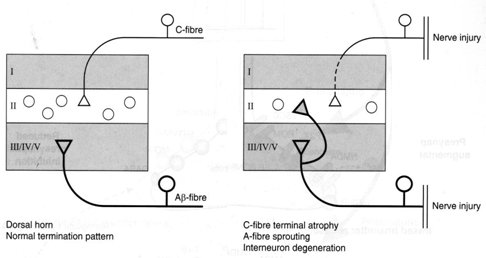 Tamaño completo
Tamaño completo Figura 6. Reorganización estructural: conexiones aberrantes con transmisión facilitada
Sensibilización central (wind up)
Las membranas de una fibra aferente y de una neurona postsináptica de segundo orden contienen una gran cantidad de proteínas que se unen a lípidos e hidratos de carbono complejos para formar los receptores y poros. Los receptores más importantes para el dolor son el de GABA y el de NMDA (N-methyl D-aspartate). Cada una de las pequeñas arborizaciones de la neurona, que le sirven para aumentar la superficie sináptica, contiene receptores cuya expresión va a estar regulada, por ejemplo, por la rapidez con que se secreta el glutamato; debido a eso, la segunda neurona también será más eficiente en esa sinapsis, que puede estar transmitiendo dolor. Si se estimula la corteza con glutamato, aparte de la síntesis normal de una serie de neurotransmisores se logrará una inducción genética, apareciendo otros neurotransmisores y otros receptores. La neurona puede resistir estos cambios o morir; los cambios estructurales de la membrana y la efectividad con que logre hacer sinapsis con su neurona anterior pueden destruir a la misma neurona que está tratando de adaptarse a los cambios estimulatorios; entonces los circuitos, que antes funcionaban en forma ordenada, se alteran y desaparecen. De esta forma se producen memorias a largo plazo del dolor, no porque una sinapsis se haya vuelto más eficiente, sino porque se ha eliminado el circuito inhibitorio (Fig. 7).
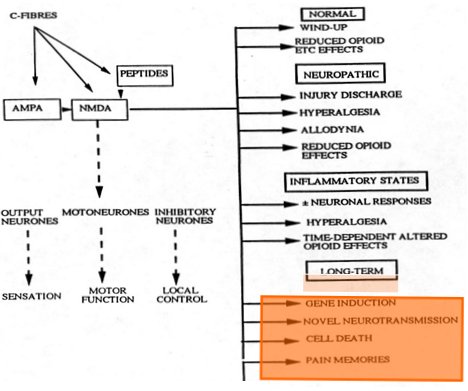 Tamaño completo
Tamaño completo Figura 7. Interacciones receptor NMDA
Los receptores de glutamato están formados por dos grandes unidades, tipo 1 y tipo 2; la segunda se puede expresar en cuatro modalidades distintas, dadas por cuatro genotipos distintos, que se expresarán en otros tantos fenotipos; a su vez, las dos unidades pueden tener ocho variantes de unión. Por eso la glicina, que es un inhibidor y el glutamato, que es excitador para la entrada de calcio en este poro, actúan de distinta manera en cada persona según el gen que se exprese en ésta. Incluso, una misma persona puede cambiar en el tiempo su sensibilidad a glutamato (Fig. 8).
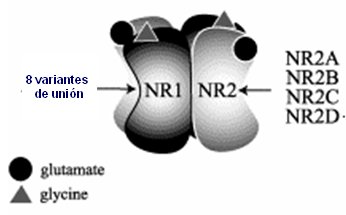 Tamaño completo
Tamaño completo Figura 8. Receptores ionotrópicos (NMDA)
El glutamato es uno de los principales participantes en las vías del dolor; el mismo glutamato puede determinar la expresión de una serie de genes dentro del DNA nuclear, pero también del DNA no nuclear, en las mitocondrias, que están tanto en las terminaciones axonales como en las dendritas. Por otra parte, cuando hay exceso de glutamato se produce atrofia neuronal.
La amplificación genética del dolor ocurre de la siguiente manera: el material genético que está en la neurona postsináptica de segundo orden es estimulado por las señales que llegan, lo que aumenta la transcripción de proteínas que causan más dolor desde sus propios genes; en otras palabras, aparece UNAM, material genético que, a nivel de los ribosomas, se traduce en proteínas activas en procesos de amplificación y perpetuación del dolor. El efecto en los neurotransmisores es de alteración de la neurosecreción, con disminución del transcriptor que codifica las proteínas que regulan la trasmisión sináptica y alteración de un grupo de genes que regulan las proteínas relacionadas con la función secretora presináptica (PSYN), en especial las relacionadas con los mecanismos de liberación del neurotransmisor. Así se obtiene una neurona más eficiente en liberar cierta categoría de neurotransmisor. En el postsináptico se puede obtener que las neuronas sean menos eficientes en depolarizarse frente a este estímulo.
Sistemas proteicos en la mira
Se sabe que el sexo y los genes interfieren con la respuesta a los analgésicos; diferentes patrones de expresión de receptores opioides explicarían por qué algunos pacientes no mejoran con estas sustancias. Las mujeres soportan el dolor mejor que los hombres y esto tiene una base genética. Existen mapas de los patrones de expresión de todos estos receptores, sobre todo de los receptores opioides; los investigadores pueden tomar cepas de ratas con distintas características genéticas y ver cómo se expresan y de esta forma se ha demostrado que se expresan de modo diferente según el sexo.
El metabolismo y la biodisponibilidad de numerosos fármacos, incluyendo tricíclicos, codeína, tramadol y el antiglutamato dextromethorphan, dependen del polimorfismo alélico del sistema monooxygenasa cytochromo P450 hepático, de modo que son influidos por variables generales como el estado de salud y las alteraciones de la función hepática. Por lo tanto, un tratamiento de dolor puede fracasar en pacientes que consumían alcohol antes de presentar la enfermedad actual.
En lo que se refiere a la cuantía de los cambios, las investigaciones revelan que varios cientos de genes cambian su expresión en las neuronas sensoriales después del daño de un nervio periférico, o al exponerse a mediadores inflamatorios. Estos incluyen genes nunca antes descritos en el sistema nervioso, cuya función es aún desconocida. Desde la clínica, sólo se puede señalar que tal grupo de pacientes reacciona bien con meloxicam o con paracetamol, por ejemplo, lo que indica que la COX-2 no funcionó en unos y funcionó en los otros.
Síntesis de los blancos farmacológicos
La falta de eficacia de analgésicos que se administran en forma empírica es habitual, si se dirigen a targets que no se están expresando en un paciente dado; los inhibidores Cox2 solo funcionan, por ejemplo, si la Cox2 ha sido inducida. Algunos investigadores han logrado establecer un factor llamado BH4 (tetrahydrobiopterin), que aumenta la cantidad o intensidad del dolor que se percibe y han demostrado que alrededor de 25% de la población tiene una sola copia para producir esta sustancia y 3% de la población no tiene ninguna: estas personas no sienten dolor. Si se inhibe el BH4 en el 75% de la población que normalmente lo produce, estos sujetos sienten tan poco dolor como si nunca lo hubieran tenido (2).
En lo que se refiere a suprimir las redes del dolor, experimentos realizados en ratones sugieren que, si se lograra descifrar lo que los investigadores llaman el Control Central del Dolor (Master Genetic Switch), se podría obtener que los animales no tengan dolor. Esto se estudió en una línea genética de ratones que carecen de una cadena de genes, por supresión de un trozo de cromosoma llamado Runx1, como resultado de lo cual los animales no sienten dolor y tienen retardo mental, porque no solamente se alteran sus vías de dolor, sino que se altera estructuralmente todo el sistema nervioso central. Existe un síndrome similar en niños que presentan un comportamiento autodestructivo sin sentir dolor, asociado a déficit cognitivo.
Hay una serie de genes relevantes en la producción de la sensación dolorosa. Los investigadores están buscando los genes que codifican interleuquinas, sintetasa de óxido nítrico neuronal, TNF alfa, receptor de glutamato (kainato) y muchas otras sustancias que pueden modular respuestas distintas de dolor en los humanos. Por ejemplo, se sabe que la sintetasa de oxido nítrico participa en la cascada del proceso inflamatorio, por medio de las prostaglandinas; por lo tanto, las personas que tienen este gen alterado sentirán menos dolor que los individuos sin esta alteración.
Neuroplasticidad
La neuroplasticidad se refiere al fenómeno mediante el cual el núcleo sintetiza proteínas que alteran las características de la neurona, frente a lo cual ésta tiene dos opciones: seguir igual, o morir. El cerebro humano es plástico; así se adapta a las circunstancias; forma memorias de experiencias (en este caso, de dolor) a largo plazo; aprende programas motores y complejas estrategias conductuales; puede producir trastornos psicopatológicos discapacitantes; pero puede recuperarse, gracias a la neuroplasticidad, que es la propiedad que permite que los pacientes que han sufrido un accidente vascular o un traumatismo encefalocraneano se recuperen. La célula es resistente, evita moverse desde el centro de equilibrio que logró durante tantos años de neurodesarrollo; pero la neuroplasticidad es tan potente que puede llegar a destruir la neurona.
En la Fig. 9 se resume el funcionamiento cerebral. Se sabe que las dendritas forman circuitos para dar estabilidad a las neuronas a largo plazo y que la plasticidad de las sinapsis depende de que se siga produciendo el estímulo, es decir, de la experiencia. La potenciación sináptica prolongada permite el desarrollo de la memoria a largo plazo, que puede durar toda la vida y estos circuitos pueden facilita el crecimiento o la muerte de algunas neuronas. Este hecho permite el aprendizaje.
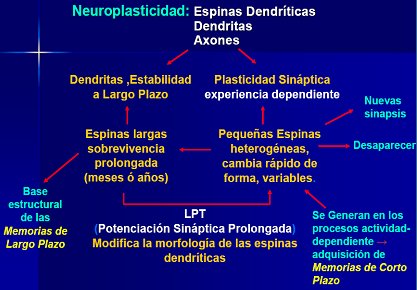 Tamaño completo
Tamaño completo Figura 9. Funcionamiento cerebral y neuroplasticidad
Es importante recordar que dentro del cerebro no solamente hay neuronas, sino también glía. Si bien la sinapsis es la base de todo lo que se ha expuesto, la glía tiene mucho que aportar a la expresión del material genético dentro del SNC.
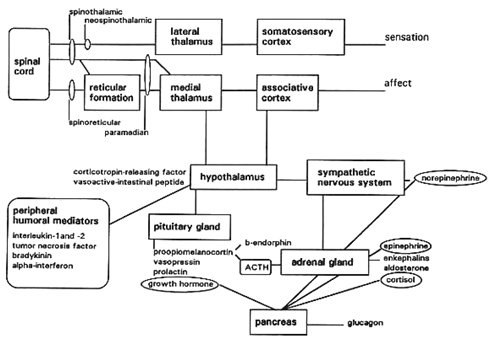
Estado actual del conocimiento del dolor
La evidencia actual demuestra que el dolor es una experiencia creada por el sistema nervioso central y que su expresión va a ser distinta en cada persona, porque la conformación de cada cerebro es diferente. Lo importante es evitar la expresión de dolor en un niño, por ejemplo, al realizar procedimientos médicos sin anestesia. Las personas responden a sustancias endógenas y exógenas, y la respuesta es distinta en cada individuo: ante un estímulo doloroso estándar, las personas presentan distintos grados de dolor. La sensación desagradable y la intensidad del dolor dependen de la conformación de las áreas mediales de los hemisferios, conformación que es heredada y luego modulada por el ambiente. El giro cingulado, en la parte anterior, indica cuánto dolor se puede sentir.
Las nuevas técnicas de neuroimagen han permitido avanzar en el estudio de la respuesta al dolor. En un estudio efectuado en sujetos sanos de una Universidad de Estados Unidos, se registró su reacción frente al contacto con un tubo de ensayo que contenía agua a 60 grados, puesto sobre el muslo y se correlacionó la percepción de estos sujetos con los cambios en una resonancia magnética funcional. Se encontró que los sujetos que toleraban mejor el dolor y no se quejaban mostraban activación de las áreas talámicas, mientras que los que comunicaron gran dolor, incomodidad, angustia y sufrimiento por este estímulo, tenían activación de todo el cíngulo.
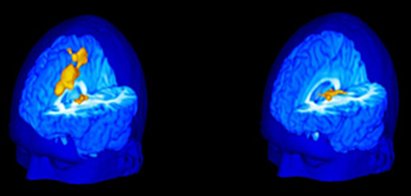 Tamaño completo
Tamaño completo Figura 10. Activación cerebral inducida por dolor en sujetos muy sensibles (izquerda) y poco sensibles (derecha)
Otro estudio interesante es el que hizo un grupo de anestesistas en un trabajo clásico, hace diez años, en una serie de individuos con miembro fantasma. Los investigadores trataron este síndrome mediante bloqueo con anestésicos del plexo braquial del miembro amputado y evaluaron a tres sujetos que respondieron al tratamiento y a tres que no respondieron. En la figura 11 se muestra la representación cortical de la respuesta al dolor del miembro fantasma, en la resonancia funcional. En los pacientes que respondieron, los puntos rojos y celestes muestran cómo las zonas sensitivas de la corteza cerebral se volvieron a agrupar, mientras que en aquellos pacientes que no respondieron al procedimiento de bloqueo del plexo, las áreas corticales no se modifican y se ven mucho más patológicas y desplazadas hacia abajo y hacia delante: el surco rolándico posterior, en la primera circunvolución parietal, está desplazado y todas esas zonas se han hecho difusas. En cambio, en los que respondieron al bloqueo, estas áreas vuelven a hacerse más precisas, como si no hubiera habido amputación (3).
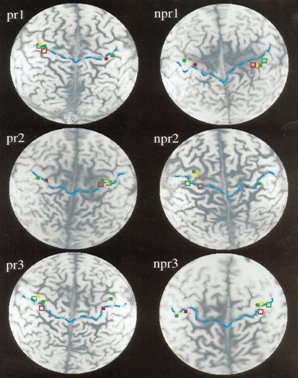 Tamaño completo
Tamaño completo Figura 11. Representación cortical de la respuesta al dolor del miembro fantasma
Manipulando la neuroplasticidad
Según las nuevas teorías, si se lograra localizar el switch general de un dolor, se podría tomar material genético, ponerlo dentro de sondas no rechazables por el cerebro humano y modular la expresión de proteínas asociadas a la producción de ese dolor. Actualmente se están usando dos tipos de sondas genéticas en ratas; una de ellas es el virus herpes simple tipo 6, que es muy neurotropo y soporta cargas genéticas grandes, genes completos; con esto se ha logrado alterar la expresión de ciertas proteínas, en estos casos. En humanos se está estudiando con grandes expectativas la posibilidad de que las propias células madres (stem cells) de la piel, que están fácilmente disponibles, se puedan cargar con estos genes para luego ser instaladas directamente dentro del sistema nervioso central, bloqueando la sensación de dolor (Fig. 12).
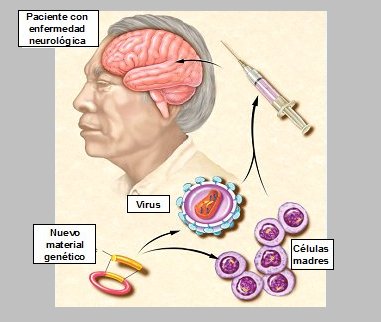 Tamaño completo
Tamaño completo Figura 12. Manipulación futura de la neuroplasticidad
Las investigaciones en esta materia podrían permitir, en el futuro, que se bloquee la expresión genética que hace que los individuos perciban la sensación de dolor, por medio de estas sondas génicas; y se podría llegar a entender porqué hay tanta variabilidad en esta percepción entre los individuos. Esto es muy importante, ya que el dolor es la principal causa de consulta médica.
Resumen
El dolor crónico es una enfermedad que compromete múltiples funciones del sistema nervioso central; se relaciona con la pérdida de la homeostasis de los procesos neuroplásticos; cursa con procesos de neurodegeneración que oscurecen el pronóstico; el tratamiento debe estar dirigido a recuperar la resiliencia neuronal y la homeostasis del sistema nervioso central, la médula y las terminaciones nerviosas libres; finalmente, el uso de dosis apropiadas de fármacos garantiza una mejor respuesta clínica.
El estudio molecular del dolor es un campo de investigación relativamente nuevo y en rápida expansión, que representa un paso adelante de las investigaciones tradicionales. Los estudios moleculares acerca de la fisiopatología a nivel celular, subcelular y molecular, integran la investigación del dolor con la biología molecular, genética y proteómica, así como con electrofisiología y la neurobiología modernas. Este campo, que está en veloz desarrollo, es una gran promesa para la identificación de nuevas dianas específicas y efectivas para el alivio del dolor intratable.

