Estudios originales
← vista completaPublicado el 1 de mayo de 2011 | http://doi.org/10.5867/medwave.2011.05.5035
TNF-α e IL-1β ¿son los causantes del daño de la cicatriz patológica posquemadura al año de evolución?
Are TNF-α and IL-1β the cause of post-burn hypertrophic scar tissue one year later?
Resumen
Introducción. La cicatriz hipertrófica posquemadura se caracteriza por presentar un incremento en la síntesis de colágena, hiperplasia y un aumento en el intercambio celular. Sus aspectos clínicos muestran aspectos de una inflamación local crónica, pero el mecanismo de su patogénesis no ha sido claramente entendido. En la inflamación cutánea crónica, las citocinas proinflamatorias y profibrogénicas participan de manera importante para producir disfunción cutánea. El objetivo de este trabajo fue estudiar los cambios en la expresión de los ARN mensajeros de TNF-α y de IL-1β, así como su localización en cicatriz hipertrófica posquemadura. Se compararon los resultados obtenidos con cicatrices normotróficas y con piel normal. Material y Métodos. Las biopsias de piel fueron obtenidas de 15 pacientes con cicatriz hipertrófica posquemadura, que presentaron más del 10% de la superficie corporal quemada y más de un año de evolución. Las cicatrices normotróficas fueron obtenidas de 17 pacientes que cicatrizaron en condiciones óptimas. Y las pieles normales fueron obtenidas de 11 pacientes sometidos a cirugía plástica o reconstructiva. Se realizó un análisis histopatológico con procesamiento de rutina. Los niveles de expresión de los ARN mensajeros de TNF-α y de IL-1β en los tres tipos de biopsias fueron cuantificados por RT-PCR semicuantitativo y por hibridación in situ. Resultados. Por lo que respecta al análisis histopatológico, las células del infiltrado inflamatorio se diagnosticaron como leves; y nosotros no encontramos correlación entre el número de células del infiltrado inflamatorio presentes y la producción de citocinas. Al cuantificar la expresión de los ARN mensajeros por la técnica de RT-PCR semicuantitativo, se observó que el cociente TNF-α/β-actina y el cociente IL-1β/β-actina fue menor en cicatriz hipertrófica posquemadura en comparación con la cicatriz normal. Pero cuando se analizó la expresión de los ARN mensajeros de TNF-α y de IL-1β por hibridación in situ, se observaron diferencias significativas en la intensidad [ng/Ci] de hibridación para IL-1β localizada en la epidermis de la cicatriz hipertrófica al compararla contra la epidermis de la cicatriz normotrófica y de la piel normal. Para TNF-α no se encontraron diferencias en la intensidad [ng/Ci] de expresión entre epidermis y dermis de los tres tipos de muestras. Conclusiones. En conjunto los resultados nos sugieren que no existe una sobreexpresión en el contenido de citocinas estudiadas en la cicatriz hipertrófica, al año de evolución. Sin embargo la cicatriz hipertrófica puede deber su formación a un mayor número de queratinocitos que expresan menor cantidad del mensajero de IL-1β al compararse con cicatriz normal.
Introducción
Las quemaduras son un campo de investigación de gran interés debido a la gran extensión de piel involucrada, además de que pueden generar las más grandes y significativas cicatrices en la patología humana. Las consecuencias psicológicas, funcionales y estéticas de las cicatrices posquemaduras pueden influenciar dramáticamente la calidad de vida del paciente1.
El examen clínico es el método común y mayormente utilizado para diagnosticar las cicatrices patológicas. Los análisis de laboratorio y los instrumentales no están disponibles para predecir la evolución, el tiempo y el resultado final de las cicatrices. Los estudios de ciencia básica (histología, inmunología, bioquímica, etc.) proveen nuevos conceptos en los diferentes aspectos de la patogenia de las cicatrices; y a futuro, la correlación de la información básica con las características clínicas puede resultar en un avance en la prevención, resolución y tratamiento de las cicatrices patológicas.
Anteriormente, debido a que no existían criterios estándar, resultaba difícil clasificar a las patogenias cutáneas. Fue recién en 1990 cuando el grupo de Muir2 propuso una clasificación específica para las cicatrices hipertróficas, principalmente se basaba en criterios clínicos y se relacionaban con el tiempo de evolución de la cicatriz. Nueve años después Magliacani y colaboradores3 propusieron una nueva clasificación basándose también en criterios clínicos, además de la contractura y atrofia tisular. Esta clasificación se continúa utilizando, y se sugiere categorizar a las cicatrices hipertróficas en activas (AHS: Active Hypertrophic Scars) o en remisión (RHS: Remission Hypertrophic Scars).
Los diferentes perfiles de cicatrices hipertróficas pueden ayudarnos a comprender el origen de la patogenia. Dentro de las características4 5 6 importantes para conocer el estado de activación de una cicatriz se ha propuesto que la cantidad de células T y macrófagos presentes en el infiltrado inflamatorio son determinantes para el desarrollo de la cicatriz7. Asimismo se ha planteado como hipótesis una relación entre la cantidad y función de las células inmunes del infiltrado inflamatorio, y la actividad y diferenciación de fibroblastos a miofibroblastos a través de la producción y liberación de diferentes citocinas que estarían influenciando el desarrollo de las cicatrices patológicas8 9 dando como resultado la alteración irreversible de la arquitectura tisular10 11.
La cicatriz hipertrófica posquemadura se caracteriza por presentar un incremento en la síntesis de colágena, un aumento celular (hiperplasia) y un aumento en el intercambio celular (shedding: reemplazar células muertas por jóvenes)1. Sus aspectos clínicos (eritema, dolor, disestesia, prurito, elevación) muestran una inflamación local crónica, pero el mecanismo de su patogénesis no ha sido claramente entendido3.
La sobreproducción de las fibras de colágena es la característica más importante de esta variedad de desórdenes dérmicos, algunas citocinas bien documentadas como IL-1β, TNF-α, PDGF, FGF y TGF-β12 activan directamente la proliferación de fibroblastos y/o estimulan la producción de tejido conjuntivo13 14. Estas citocinas se producen principalmente por macrófagos activados, pero algunos de estos mediadores también se producen por otros tipos celulares como linfocitos, células endoteliales y los mismos fibroblastos.
Particularmente el Factor de Necrosis Tumoral alfa (TNF-α) regula una gran variedad de respuestas celulares como la cicatrización, proliferación, diferenciación, inflamación y muerte. TNF-α se encuentra presente en dos formas: como una proteína membranal (mTNF) de 26-kDa y como una proteína soluble (sTNF) de 17-kDa, derivada de la forma membranal por liberación proteolítica, gracias a la enzima convertidora de TNF-α (TACE: TNF Alfa Convertidore Enzyme)15. Para ejercer su función biológica, TNF-α se une a los receptores tipo I (TNFR1: 55-kDa) y tipo II (TNFR2: 75-kDa), los cuales reclutan a proteínas que permitan activar diferentes rutas de señalización16. A través de sus dominios de muerte citoplásmicos, TNFR1 recluta a TRADD (TNFR1-Associated Death Domain protein) y a TRAF-2 (TNF Receptor-Associated Factor 2), para finalmente activar a la vía de las MAP cinasas (MAPK’s: Mitogen-Activated Protein Kinase)17.
Interleucina 1 beta (IL-1β) es una citocina mediadora de la regulación inmune y de la respuesta inflamatoria, incluyendo también la regulación de la cicatrización, crecimiento, diferenciación y varios procesos metabólicos; producida predominantemente por macrófagos activados, pero también se expresan en linfocitos B y T, células epiteliales, endoteliales y mesenquimáticas18 19. Pro-IL-1β se genera como un precursor, el cual se convierte en una forma madura por la enzima convertidora de IL-1β (caspasa 1 ó ICE). Se cree que IL-1β sólo es activa como proteína madura; se une al receptor tipo I (IL-1R1) y a la proteína IL-1RAcP (IL-1R Accessory protein), quienes en conjunto forman el complejo de señalización del receptor. IL-1R heterodimeriza y recluta a MyD88, subsecuentemente este complejo se une a TOLLIP (Toll Interacting Protein), IRAK (IL-1R-Associated Kinase) e IRAK4. La proximidad de estas moléculas y del receptor puede llevar a su interacción a través de la asociación de su dominio de muerte. La señalización involucra su unión a TRAF6 (TNF Receptor Associated Factor 6); activación de MAP cinasas, (TAK1, MKK6) y eventualmente desencadena la activación de NFκB, JNK y p3820.
Se ha demostrado que IL-1β coopera con TNF-α (a pesar de sus diferencias estructurales)21 para ejecutar algunos efectos, entre los que se encuentra el control de la síntesis de colágena dependiente de concentración22 23.
En este trabajo se investigó el papel de los ARN mensajeros de TNF-α y de IL-1β en cicatrices hipertróficas posquemaduras (H). Se compararon los resultados obtenidos con cicatrices normotróficas (N), y con piel normal (NS) mediante las técnicas de RT-PCR semicuantitativo e hibridación in situ. También se correlacionó la expresión de los ARN mensajeros de TNF-α e IL-1β con el número de células del infiltrado inflamatorio presentes y con el número de células positivas en el tejido.
Métodos
Pacientes
Separamos por histopatología a las cicatrices hipertróficas activas (AHS) de las cicatrices hipertróficas en remisión (RHS), de acuerdo al número de células inmunes infiltradas4 14 21 y encontramos que no necesariamente correlacionaban con la clasificación de las características clínicas3.
Las cicatrices hipertróficas fueron obtenidas con el consentimiento de los pacientes, 15 presentaron cicatriz hipertrófica posquemadura (H), con 10% de la superficie corporal quemada (SCQ) y con más de un año de evolución (Tabla 1).
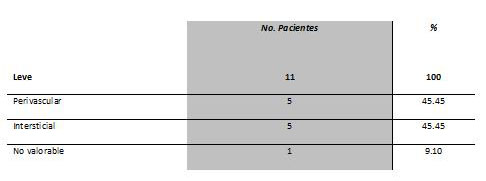 |
| Tabla 1: Análisis histopatológico del infiltrado inflamatorio en cicatriz normotrófica. |
Las cicatrices normotróficas se obtuvieron de 17 pacientes cuyas lesiones sanaron óptimamente, y finalmente las biopsias de piel normal se obtuvieron de 11 pacientes, sometidos a procesamientos quirúrgicos cosméticos. Los pacientes no tuvieron evidencia de infección o de algún tipo de cáncer. Ninguno de ellos se trató con inmunomoduladores, al menos tres meses antes de la cirugía.
Microscopía de luz en los tejidos de piel
Las biopsias fueron fijadas en safe fix por 24 horas, procesadas rutinariamente y embebidas en paraplast con una temperatura de 56°C. Las secciones de tejido (5 μm de grosor) se tiñeron con hematoxilina-eosina, y se examinaron por especialistas en dermatopatología en el Hospital General de México. Se analizó densidad, composición y localización del infiltrado inflamatorio (perivascular, perianexial, perineural o intersticial), presencia de hemorragia, cambios vasculares (dilatación, necrosis, trombosis), anexos cutáneos (folículos pilosos, glándulas sudoríparas), alteraciones (necrosis, espongiosis), edema dérmico, fibrosis y/o esclerosis.
Preparación de ARN
El ARN fue extraído del tejido previamente almacenado en RNA later (AM7020, Applied Biosystems) con el método de Tripure (11667165001, Roche Applied Science). La calidad de las preparaciones de ARN fue analizada en Nanodrop y Bioanalizador (Agilent Technologies).
Síntesis de ADN
El ARN total fue transcrito a ADN complementario (ADNc) de acuerdo al protocolo de SuperScript First-Strand Synthesis System para RT-PCR (Catalog No. 11904-018, Invitrogen). Brevemente 1 μg de ARN total, 1μl dNTPs mix, 1μl Oligo(dT)12-18 (0,5 μg/μl) se llevaron a un volumen final de 10μl con agua-DEPC, se preincubaron por 5 minutos a 65°C, se congelaron en hielo por 5 minutos. Se le agregó 2μl de buffer de RT 10x, 4μl de 25 mM de MgCl2, 2μl 0,1 M DTT, 1μl de inhibidor de Rnasas, se incubó a 42°C por 2 minutos. Se le adicionó 1μl de SuperScript II RT a cada tubo, se mezcló e incubó a 42°C por 50 minutos. Se terminó la reacción a 70°C por 15 minutos. Se colocaron los tubos a 4°C; y se colectó la reacción con una breve centrifugación. Finalmente se le adicionó 1μl de RNasa H a cada tubo, y se incubó por 20 minutos a 37°C antes de proceder a la amplificación del ADN blanco.
Reacción en Cadena de la Polimerasa (PCR)
Cinco μl de ADN complementario se amplificaron con oligonucleótidos para TNF-α, IL-1β y β-actina en un termociclador, Palm cycler (Corbett Life Science CG1-96). En un volumen total de 50μl que contenía 5μl de buffer de PCR 10X, 1,5μl de 50 mM de MgCl2, 1μl de 10 mM dNTP mix, 1μ del sense oligonucleótido a una concentración de 10 mM, 1μl de antisense oligonucleótido a una concentración de 10 mM, 0,3μl de Taq DNA Polymerasa (5 units/μl), 5μl de ADN complementario (de la primera reacción) y finalmente se agregaron 35,2μl de agua DEPC. Los oligonucleótidos para TNF-α (Gen bank accession: NM_000594) fueron los siguientes: sense CCTGTAGCCCATGTTGTAGCAA y antisense CCTTGGTCTGGTAGGAGACG (TIB, MOL BIOL, LLC). Los ciclos de amplificación consistieron en 35 con las siguientes características: 94°C por 2 minutos (94°C por 30 segundos, 61°C por 1 minuto, 68°C por 1 minuto), 68°C por 7 minutos.
Los oligonucleótidos para IL-1β (gen bank accession: NM_000576) fueron los siguientes: sense CTGTCCTGCGTGTTGAAAGA y antisense GAAGTCAGTTATATCCTGGC, para β-actina (Gen Bank accession: NM_001101) fueron: sense CCAAGGCCAACCGCGAGAAGATGAC y antisense AGGGTACATGGTGGTGCCGCCAGAC. Y las condiciones de PCR para IL-1β fueron 2 minutos a 94°C, (95°C por 1 minuto, 1 minuto a 50°C, 5 minutos a 72°C) y una post-extensión de 72°C por 10 minutos, también en ese caso se realizaron 35 ciclos de PCR.
Los ciclos de amplificación para β-actina fueron de 35 ciclos con las siguientes características: 2 minutos a 94°C, (30 segundos a 94°C, 30 segundos a 66°C, 1 minuto a 68°C) y 7 minutos a 68°C. Las muestras amplificadas se corrieron por electroforesis, en geles de agarosa al 2%, los productos de PCR se tiñeron con 2,5μl de gel red (41002, Biotium).
Las fotografías de los geles se obtuvieron en un transiluminador de luz ultravioleta acoplado a una computadora con el programa Dolphin 1D (Wealtec). Se realizaron las densitometrías con los parámetros establecidos por el software.
Hibridación in situ para detectar el ARN mensajero de TNF-α y de IL-1β
Secciones múltiples de las biopsias de piel fueron cortadas a 5μm en condiciones libres de dnasas y rnasa, colectadas en laminillas tratadas, y se hibridaron con cada sonda por separado. Se utilizaron sondas complementarias a los ARN mensajeros de TNF-α humano (GeneDetec Company, GD1177-OP), IL-1β humano (GD1104-OP) y controles (GD5000-OP). Ver los protocolos de hibridación in situ usando las sondas Gen Detec disponibles en la página web.
Brevemente el procedimiento fue el siguiente: las secciones de tejido fueron desparafinadas a través de xileno y alcoholes graduales (100, 95 y 50%), se colocaron en 0,2 N HCl (Merck 10114) a temperatura ambiente para remover las proteínas básicas. Se lavaron con agua destilada y se sometieron a una digestión enzimática con proteinasa K (1μg/ml, Sigma 2308) en 0,05M Tris-HCl, (Sigma, T1535), pH 7,4 por 5 minutos a temperatura ambiente y después se lavaron con agua destilada suplementada con 0,1% de dietil pirocarbonato (DEPC, Fluka, 32490) por 5 minutos28. Se transfirieron las laminillas a 0,1M de buffer de TEA (Sigma T1377) preparada en fresco con anhídrido acético (Sigma, A6404) por 5 minutos. La solución de equilibrio consistió en formamida 100% (Promega H5052), 2M NaCl, 1M Tris]HCl, pH 7.4, 0.5M EDTA, 1.59M DTT (Sigma, D8906), 52μg/μl heparina (Biochemika, 51550) en agua DEPC (Invitrogen 750023), (Sigma D2532), ARN transferencia (Sigma, R5636), 10% dextran sulfato (Sigma, D8906) y 500μg/ml ADN de esperma de salmón desnaturalizado (Sigma, 15632]011). Finalmente, se le agregó el DTT a la solución de prehibridación a una concentración de 10mM. La temperatura de hibridación para todos los casos fue de 35°C.
Al día siguiente se lavaron en condiciones de alta astringencia para reducir el background o señales de hibridación no específicas (secuencialmente en buffer de citratos 2x y en 100mM Tris-HCl, 150mM NaCl pH 7,5)29.
La detección final se realizó de acuerdo con el proveedor (Cat. nº HKD47 Rembrandt). Brevemente a las laminillas se les agregó de 2 a 3 gotas del anticuerpo conjugado, se incubaron toda la noche a 4°C, se lavaron con agua desionizada y se les aplicó la solución de trabajo AEC 1X (aminoetilcarbazol, Sigma A6926) y se incubaron de 5 a 15 minutos. Se contratiñeron con hematoxilina de 5 a 10 minutos. Las secciones se montaron para su evaluación microscópica. Se tomaron las fotos con el microscopio Leica y cámara Nikon, se evaluaron con el programa MCID Imagine Research Inc.). El tejido control positivo usado fueron dos muestras de pacientes con gingivitis, donde su característica principal es el proceso inflamatorio agudo. Y en el caso del control negativo se utilizó la sonda sense.
Análisis cuantitativo de la expresión de los ARN mensajero en epidermis y dermis humana
Las imágenes de epidermis y dermis se digitalizaron como TIFF (usando PhotoShop V9.0) y se analizaron cuantitativamente con el programa de análisis de imágenes MCID/M2 (Imaging Research). Brevemente, áreas rectangulares que contenían células epidermales lineales (10 células de ancho aproximadamente) fueron seleccionadas. Asimismo la dermis también fue seleccionada y seccionada por debajo de la epidermis. Se analizó la intensidad de hibridación [ng/Ci] a varios niveles desde la base a la altura del rectángulo; tomando el análisis de la sección completa de la piel.
En el análisis también se incluyó el número de células positivas por μm2. Cabe mencionar que se evitó el background al adquirirse la foto y también se tomó como control para cada tejido de piel el número de células negativas presentes en el corte.
Resultados
Los cambios histopatológicos21 observados en las biopsias de piel no tuvieron gran variación (Tabla I y Tabla II). En la secciones de las biopsias de piel normal se observó ocasionalmente un pequeño número de linfocitos alrededor de los vasos sanguíneos dérmicos, y la densidad del infiltrado fue leve (Figura 1A).
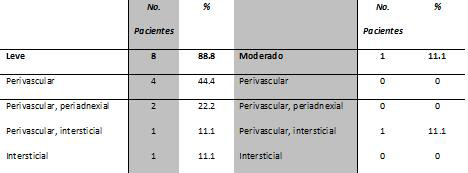 |
| Tabla 2: Análisis histopatológico del infiltrado inflamatorio en cicatriz hipertrófica. |
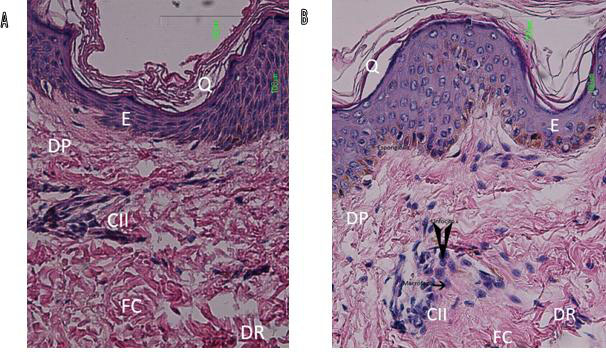 |
| Figura 1a: Se observa una fotomicrografía de una piel normal donde la epidermis (E) no presenta cambios histológicos, en la capa más superficial de esta se encuentra la queratina (Q). Por debajo de la Epidermis (E) también puede observarse la dermis papilar (DP) y la reticular (DR) en donde las fibras de colágena (FC) están bien organizadas. Las células del infiltrado inflamatorio (CII) también presentes en una piel normal se caracteriza por escasos linfocitos. |
| Figura 1b: biopsia de cicatriz normotrófica, en la epidermis (E) se observa una leve espongiosis y en la dermis un leve infiltrado inflamatorio (CII), donde predominan linfocitos y con ocasionales macrófagos en la unidad perivascular dérmica. Las fibras colágenicas (FC) en general bien orientadas. La barra representa 100μm, (40 X). |
Particularmente en la cicatriz normotrófica (Figura 1B) el infiltrado fue predominantemente linfocítico, con ocasionales histiocitos o células tipo epiteloide entre las fibras de colágena. La epidermis en general no se vio afectada, aunque en ocasiones las papilas dérmicas fueron más pronunciadas y tuvieron signos de espongiosis. En las Figuras 2A y 2B, dos pacientes con cicatriz hipertrófica, presentaron reminiscencias de anexos cutáneos y acantosis en la capa epidérmica, sólo una biopsia de cicatriz hipertrófica se caracterizó por un moderado infiltrado inflamatorio con linfocitos presentes alrededor de los vasos sanguíneos y células histiocíticas o macrófagos entre las fibras de colágena. La epidermis en general no se vio afectada excepto por un grado medio de exocitosis o espongiosis, pero no contenían queratinocitos necróticos (Figura 2C).
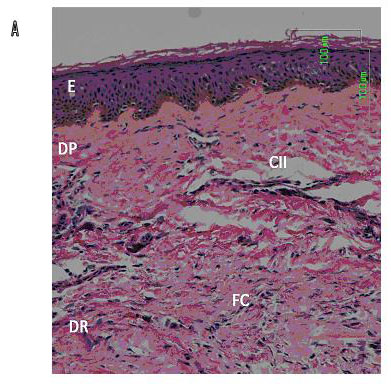 |
| Figura 2: En A, cicatriz hipertrófica predominan las células del infiltrado inflamatorio (CII) y la arquitectura tisular se pierde por las fibras de colágena (FC) localizadas en espiral en la dermis reticular (DR). |
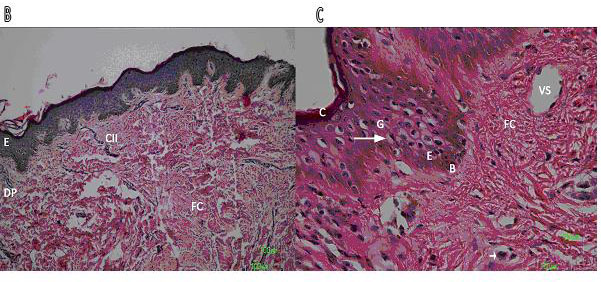 |
| Figura 2b: La cicatriz hipertrófica de otro paciente presentó un leve infiltrado inflamatorio y la epidermis no mostró cambios contundentes. |
| Figura 2c: La epidermis de otro paciente con cicatriz hipertrófica se observan las capas normales de una epidermis (C) capa córnea, (G) capa granulosa, capa espinosa (E) y la capa basal (B), en la capa espinosa existen signos de vacuolización en los queratinocitos. En la dermis papilar se observan vasos sanguíneos (VS) y CII dentro de estos. La barra representa 100μm. |
RT-PCR
La expresión especifica de los ARN mensajeros para TNF-α, IL-1β y β-actina fueron determinadas por la técnica de RT-PCR semicuantitativa, en biopsias completas de piel normal, cicatrices normotróficas e hipertróficas. El análisis se realizó en 43 biopsias, 11 piel normal (Figura 3), 17 fueron cicatrices normotróficas (Figura 4) y 15 fueron cicatrices hipertróficas posquemaduras (Figura 5).
 |
| Figura 3: Expresión del ARN mensajero de TNF-α e IL-1β en biopsias de piel normal. El cDNA se obtuvo de pacientes con piel normal (líneas 1 -11) y se amplifico con primers específicos para TNF-α, IL-1β y β-actina se utilizó como control positivo. |
 |
| Figura 4: Expresión del ARN mensajero de TNF-α e IL-1β en biopsias de cicatriz normal. El cDNA se obtuvo de 17 pacientes con cicatriz normal (líneas 1 -17) y se amplifico con primers específicos para TNF-α, IL-1β y β-actina se utilizó como control positivo. |
 |
| Figura 5: Expresión del ARN mensajero de TNF-α e IL-1β en biopsias de cicatriz hipertrófica. El cDNA se obtuvo de 15 pacientes (línea 1- línea 15) con cicatriz hipertrófica y se amplifico con primers especifícos para TNF-α, IL-1β y β-actina se utilizó como control positivo. |
Como se muestra en la Figura 3, aparentemente no hubo diferencia en la señal de los ARN mensajeros de TNF-α o de IL-1β. En la Figura 4, los valores de los ARN mensajeros son muy similares entre los diferentes pacientes. En el caso de los mensajeros obtenidos de las cicatrices hipertróficas, tampoco se observó gran diferencia entre estos (TNF-α ó IL-1β), pero cuando comparamos el promedio de los pacientes de los ARN mensajeros obtenidos de pacientes con cicatrices hipertróficas (Figura 5) con el de los pacientes de cicatrices normotróficas (Figura 4), los primeros valores son menores (Figura 6), y estadísticamente diferentes. TNF-α (p≤0,02) y para IL-1β (p≤0,04) cuando se comparan cicatrices hipertróficas versus cicatrices normotróficas.
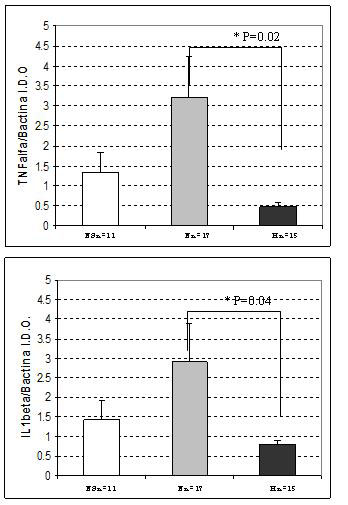 |
| Figura 6: En A se observa la comparación de la expresión de los ARN mensajeros para IL-1β en los tres tipos de muestras, piel normal (PN), cicatriz normotrófica(N) y cicatriz hipertrófica (H). Observándose una diferencia significativa (p≤ 0.04) al comparar la N vs la H. En B observa la comparación de la expresión de los ARN mensajeros para TNF-α en los tres tipos de muestras, piel normal (PN), cicatriz normotrófica(N) y cicatriz hipertrófica (H). Observándose una diferencia significativa (p≤ 0.02) al comparar la N vs la H. I. D. O., se refiere a unidades arbitrarias de Intensidad de Densidad Óptica, al obtener el cociente del ARN mensajero problema/ARN mensajero de un gen housekeeping. |
El ARN mensajero de TNF-α se expresa en Epidermis y Dermis sin cambios en la cicatriz hipertrófica posquemadura
La expresión específica para cada una de las capas de la piel del ARN mensajero de TNF-α se determinó por hibridación in situ en 28 biopsias, incluyendo 5 de piel normal, 11 de cicatriz normotrófica y 12 de cicatriz hipertrófica. Se determinó la intensidad de hibridación y no se encontraron diferencias en la intensidad de la señal entre epidermis y dermis en los tres tipos de biopsias (Figura 7).
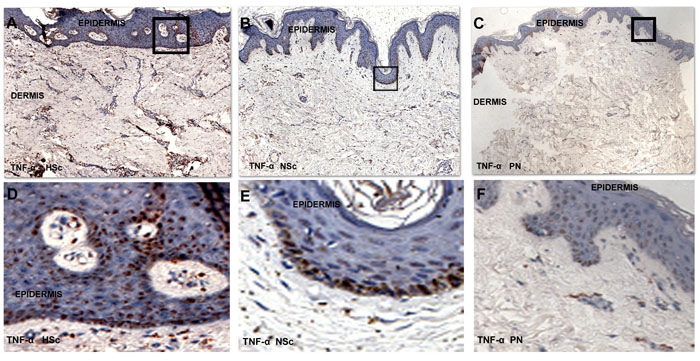 |
| Figura 7: Microfotografías de la hibridación in situ para TNF-α en biopsias de Hsc, Nsc y PN. A. B y C son fotografías tomadas a 100X, D E y F son aumentos de los recuadros señalados respectivamente para enfatizar la expresión del mensajero en los queratinocitos de las biopsias tomadas de pacientes con cicatriz hipertrófica. |
Pero al comparar estadísticamente la dermis de la cicatriz normotrófica (133±2,6) con la dermis de la cicatriz hipertrófica, se observaron más células positivas, (60±0,8) en secciones de 1.000μm2, aunque no hubo diferencias estadísticamente significativas (Figura 8).
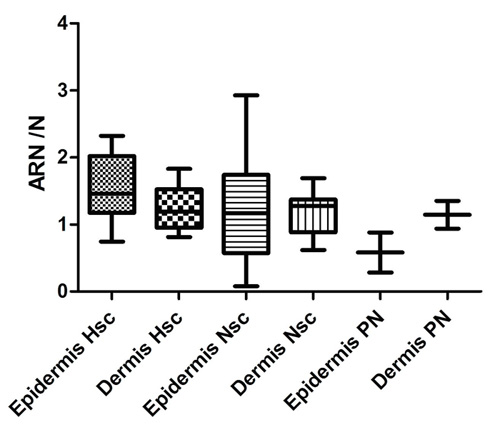 |
| Figura 8: Cuantificación de las secciones de piel procesadas por ISH con sondas para TNF-α marcadas bioquímicamente con AEC. Muestran el cociente de la cantidad de ARN / N, donde N son los Núcleos. Las barras indican desviación estándar. No hubo diferencias significativas. |
Respecto al patrón de distribución de células positivas, la expresión se observó en todas las capas de la epidermis (basal, espinosa, granulosa y córnea) y en diferentes tipos de queratinocitos e incluso algunos melanófagos. Las células del infiltrado dérmico también fueron positivas sobre todo aquellas que forman grupos pequeños de células perivasculares en la dermis papilar y reticular, algunas células también fueron positivas al encontrarse intersticialmente entre las fibras de colágena (Figura 7).
El ARN mensajero de IL-1β se expresa en Epidermis y Dermis con cambios en la cicatriz hipertrófica posquemadura
La expresión para el ARN mensajero de IL-1β se determinó en 24 biopsias incluyendo 4 de piel normal, 9 de cicatriz normotrófica y 11 de cicatriz hipertrófica (Figura 9). Se determinó la intensidad de hibridación y se encontraron diferencias significativas entre la intensidad de la señal en la epidermis de cicatriz hipertrófica, cuando se comparó con la dermis de piel normal (Figura 10).
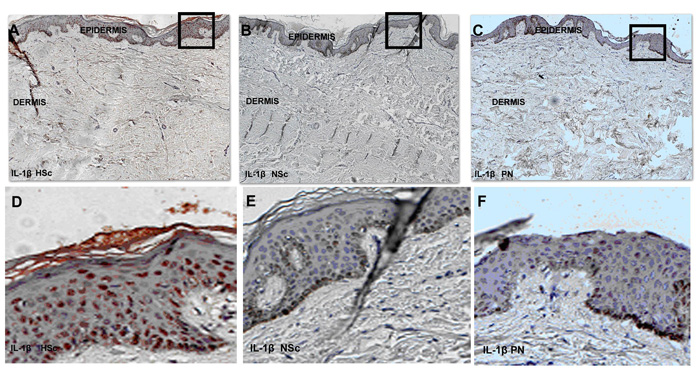 |
| Figura 9: Microfotografías de la hibridación in situ para IL-1β en biopsias de HSc, NSc y PN. A. B y C son fotografías tomadas a 100X, D E y F son aumentos de los recuadros señalados respectivamente para enfatizar la expresión del mensajero de IL-1β en los queratinocitos en las biopsias tomadas de pacientes con cicatriz hipertrófica posquemadura. |
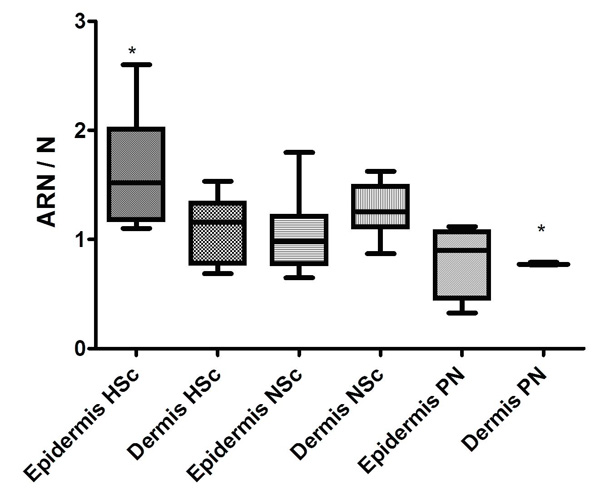 |
| Figura 10. Cuantificación de las secciones de piel procesadas por ISH con sondas para IL-1β marcadas bioquímicamente con AEC. Muestran el cociente de la cantidad de ARN / N, donde N son los Núcleos. Las barras indican desviación estándar. * P ≤ 0.05 Epidermis HSc vs Dermis PN. |
Pero en epidermis (184±6,5) y dermis (109±1,5) las cicatrices hipertróficas tuvieron más células positivas cuando se compararon con la epidermis (73±1,4) y la dermis (21±2) de cicatrices normotróficas, o bien incluso cuando se compararon con la epidermis (28±7,9) y la dermis de piel normal (15±0,5). Datos no mostrados.
Respecto al patrón de distribución de células positivas, todas las capas epidérmicas presentaron células positivas (queratinocitos en su gran mayoría) y en la dermis sólo escasas células del infiltrado inflamatorio tanto en la papilar como en la reticular también lo fueron, sobretodo alrededor de los vasos sanguíneos, en zonas perivasculares (Figura 9).
Discusión
Durante este trabajo experimental se analizó el papel de los ARN mensajeros de IL-1β y de TNF-α en la cicatriz hipertrófica posquemadura, por considerarse citocinas proinflamatorias y profibrogénicas21.
Lo primero que encontramos al analizar histopatológicamente24 las biopsias de piel normal (NS), cicatriz normotrófica (N) y cicatriz hipertrófica posquemadura (H), es que las muestras no presentaban un infiltrado inflamatorio abundante, es decir la cantidad de células del infiltrado inflamatorio presentes en las cicatrices hipertróficas era leve, muy similar a las muestras de cicatriz normal (N) e inclusive piel normal (NS). Estos hallazgos difieren del grupo de Castagnoli que menciona que las cicatrices hipertróficas son causa de un proceso inflamatorio crónico donde las células del sistema inmune presentes abundantemente serían las encargadas de secretar citocinas proinflamatorias y profibrogénicas que perpetuarían el proceso volviéndolo crónico. Nuestros hallazgos nos hacen suponer que es posible considerar la existencia de diferentes perfiles de cicatrices hipertróficas. Esta propuesta concuerda con Santucci en 2001.
A pesar de que nuestro primer hallazgo es morfológico: pocas células inflamatorias (linfocitos en su mayoría y algunos macrófagos en zonas perivasculares), nosotros no podemos afirmar nada acerca del grado de activación de estas células ya que no las marcamos con moléculas membranales como las del complejo mayor de histocompatibilidad MHCII o bien con moléculas accesorias CD3, CD4 o CD8 positivas.
Nuestro segundo hallazgo fue que se encontró una disminución en la expresión de las citocinas proinflamatorias propuestas como causantes de perpetuar el daño (TNF-α e IL-1β) mediante la técnica de RT-PCR semicuantitativa en las cicatrices hipertróficas posquemadura (H). Estos datos encontrados coincidieron con los reportes de Peruccio25 y de Zhang26 para TNF-α, quienes también demostraron una disminución en el ARN mensajero de TNF-α. Zhang y colaboradores26 proponen que a pesar de observar una disminución del cociente TNF-α/β-actina en las cicatrices hipertróficas, el ARN mensajero de TNF-α aumenta conforme va madurando la cicatriz y se resuelve.
A la fecha no existen datos de la expresión génica de IL-1β, a pesar de conocerse que tiene propiedades biológicas similares a TNF-α27, y que inclusive presentan un efecto sinergístico para poder degradar matriz extracelular en procesos fibróticos27 28. Nosotros encontramos mediante la misma técnica, RT-PCR semicuantitativo, que el ARN mensajero de IL-1β también disminuye en las cicatrices hipertróficas posquemaduras (H). Por lo que suponemos que puede tener un efecto sinergístico con TNF-α (debido a las evidencias en la literatura) para degradar matriz extracelular, y que dicho proceso se encuentra alterado en la patología de las cicatrices hipertróficas posquemaduras (H).
In situ para la cicatriz hipertrófica posquemadura (H), TNF-α está presente en más células positivas dérmicas que epidérmicas con un nivel constante en la intensidad de expresión, sin embargo en una cicatriz normal la presencia de células dérmicas positivas a TNF-α es mayor si se compara con la cicatriz hipertrófica. Por lo que la patología de la hipertrofia cutánea puede asociarse con menos células dérmicas que expresan niveles constantes de ARN mensajero.
Para IL1-β disminuye la intensidad de expresión del ARN mensajero, pero tiene más células positivas en epidermis que en dermis. Este proceso no fue diferente a lo encontrado en las cicatrices normales, sino que se observó incrementado en las cicatrices hipertróficas. Esto último nos hace suponer que las secuelas hipertróficas pueden deber su formación a un mayor número de queratinocitos que expresan menor cantidad del ARN mensajero de IL-1β. Esto concuerda con Niessen29 en darle un papel predominante a la epidermis en cuanto a la fisiopatogenia de la hipertrofia cutánea se refiere.
En este trabajo nosotros observamos un papel principal para los queratinocitos que conforman la epidermis, ya que suponemos que presentan una transcripción activa, debido a que la marca que localizamos se encuentra tanto en el citoplasma, como en el núcleo de nuestras células. Hoy día es bien demostrado que para TNF-α e IL-1β, existe una regulación transcripcional y traduccional regulada de manera excluyente, así que nuestros datos sugieren que in situ hay una transcripción de novo en las cicatrices hipertróficas y que estas citocinas pueden tener una regulación postranscripcional alterada en la patología, que no siempre concuerde con la proteína funcional resultante30.
Por otro lado se ha propuesto que TNF-α regula el proceso de cicatrización participando en la degradación y remodelación adecuada de las fibras de colágena, y nuestros datos en conjunto muestran una disminución en la expresión del gen de TNF-α para la cicatriz hipertrófica, por lo que inferimos que efectivamente el mensajero de TNF-α participa en el proceso de cicatrización normal, y una alteración en éste puede provocar disfunción cutánea.
Para IL1-β, se ha reportado que participa en la primera fase de la cicatrización31. Lo que nos lleva a suponer que la liberación de citocinas en las primeras fases de cicatrización no sólo amplifica la reacción inflamatoria, sino que media la pleiotropía del tejido dañado activando la inmunidad humoral32. Nosotros consideramos que es necesario evaluar a nivel sistémico la producción de estas citocinas ya sea en suero o en células de sangre periférica, y monitorear a los pacientes conforme la cicatriz va madurando.
En general existe una variabilidad de los pacientes para producir citocinas debido a que intervienen procesos no sólo de transcripción de la citocina, sino también la regulación post-transcripcional, intercambio del proteasoma mediado por citocinas, el procesamiento de las citocinas por sus enzimas convertidoras, la regulación del receptor de citocinas, receptores solubles de citocinas, receptores accesorios, antagonistas naturales de las citocinas, todos estos procesos participan en concierto para determinar la disponibilidad funcional de una citocina cualquiera.
IL-1β y TNF-α tienen efectos inhibitorios sobre el gen de la colágena I, sin embargo no se conocen exactamente los mecanismos de estos efectos, pero probablemente se encuentren mediados por segundos mensajeros como el AMP cíclico, el calcio intracelular y por proteínas reguladoras de la transcripción. O bien también se ha propuesto un lenguaje cruzado (cross-talk) entre IL 1-β y TGF-β33, y entre TNF-α y TGF-β34, por lo que es posible considerar que existe un control cruzado dosis-dependiente de la expresión de estos tres genes, los cuales al parecer tienen importantes efectos en sistemas biológicos. Finalmente, si se encontraran hallazgos relativos a los polimorfismos de la región promotora de ambos genes de IL-1β y de TNF-α que inciden directamente en los niveles de síntesis de estas citocinas, podríamos postular que una regulación postranscripcional podría ser de utilidad terapéutica.
Conclusión
- El análisis histopatológico se caracterizó por un infiltrado inflamatorio leve en las cicatrices hipertróficas. Lo que nos hace suponer que los linfocitos no son las células encargadas de perpetuar el daño.
- Existe una disminución del mensajero de TNF-α e IL-1β en cicatriz hipertrófica posquemadura en biopsia de piel completa, mediante la técnica de RT-PCR semicuantitativo.
- In situ sugerimos que existe una transcripción de novo o activa tanto para IL-1β como para TNF-α en epidermis de cicatrices hipertróficas.
- La cicatriz hipertrófica puede deber su formación a un mayor número de queratinocitos que expresan menor cantidad del mensajero de IL-1β al compararse con cicatriz normal.
- In situ para TNF-α no se muestran diferencias en la intensidad de expresión entre epidermis y dermis en la cicatriz hipertrófica.
- La cicatriz hipertrófica posquemadura no se atribuye a una sobreexpresión de los mensajeros de IL-1β y TNF-α.

