Congresos
← vista completaPublicado el 1 de mayo de 2006 | http://doi.org/10.5867/medwave.2006.04.1006
Terapia en la hepatitis autoinmune
Therapy in autoimmune hepatitis
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
Introducción
En el tratamiento de la hepatitis autoinmune, los conceptos están relativamente claros, sin embargo, con cierta frecuencia se produce confusión en el momento de aplicarlos. A continuación se tratará de presentar el estado actual del tratamiento de la forma más clara posible.
Generalidades
La hepatitis autoinmune no tratada es una enfermedad grave, progresiva, que progresa a cirrosis a los 6 – 12 meses, en 40% a 50% de los casos. Desde el punto de vista histológico, la necrosis erosiva, antiguamente llamada necrosis de la lámina limitante, es el predictor más importante de la evolución hacia cirrosis: 80% de los pacientes con esta característica histológica tendrán cirrosis a los 5 años si es que no se tratan, y un poco menos de la mitad de los pacientes (40%) debutan de manera aguda, que no es lo mismo que debutar de manera fulminante.
La prednisona ha sido, es y seguirá siendo, probablemente, la base del tratamiento de todas las formas de la enfermedad; y alrededor de dos tercios (65%) de los pacientes tratados entran en remisión clínica, bioquímica e histológica, a los 18 meses, proporción que aumenta a los 24 y 36 meses de tratamiento.
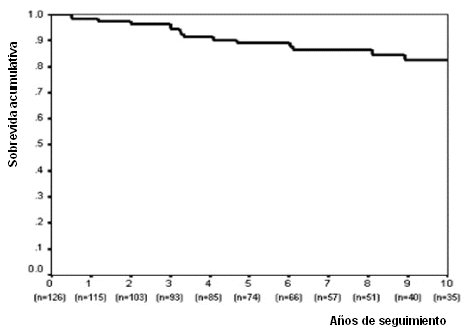
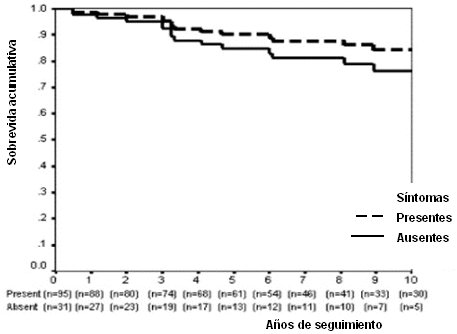
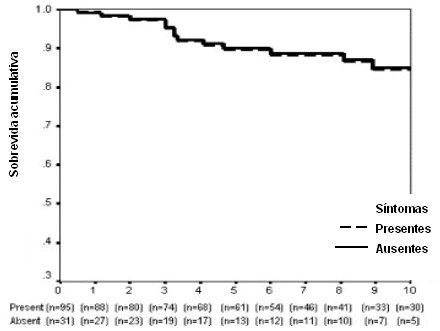
Esta enfermedad tiene muy buena sobrevida cuando se trata en forma adecuada. Así, en la mayoría de las series, la sobrevida a 10 años, en todas las formas clínicas de la enfermedad, es de alrededor de 80%, como se puede ver en una de las curvas clásicas de análisis de sobrevida (Fig. 1). Por otra parte, desde el punto de vista de la sobrevida, da lo mismo que el debut de la enfermedad sea sintomático o asintomático (Fig. 2), de modo que no se debe esperar hasta que haya síntomas floridos para tratar precozmente. De la misma manera, la mortalidad atribuible a enfermedad hepática propiamente tal es igual en los sintomáticos y en los no sintomáticos, a 10 años (Fig. 3).
 Tamaño completo
Tamaño completo Figura 1. Análisis de sobrevida a 10 años: 83% (IC 75-91%)
 Tamaño completo
Tamaño completo Figura 2. Análisis de sobrevida actuarial a 10 años: sintomáticos vs asintomáticos
 Tamaño completo
Tamaño completo Figura 3. Análisis de sobrevida a 10 años: sintomáticos vs asintomáticos (mortalidad por enfermedad hepática relacionada)
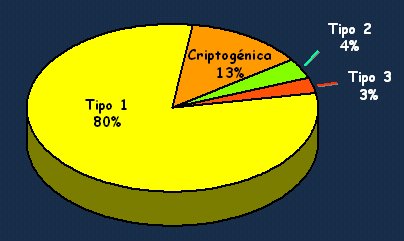
La hepatitis autoinmune tipo 1 corresponde a más de 80% de los casos, de modo que es el escenario más frecuente en la práctica clínica. La hepatitis tipo 2, que puede ser más frecuente en los niños, y la tipo 3, o criptogénica, no se ven casi nunca. La hepatitis criptogénica, es decir, aquella hepatitis probablemente autoinmune, con marcadores negativos desde el punto de vista serológico o con marcadores que no se pueden identificar o medir en nuestro laboratorio, corresponde a alrededor de 10% a 13% de los casos; pero es importante tenerla presente, porque con un tratamiento empírico puede tener una evolución favorable (Fig. 4).
 Tamaño completo
Tamaño completo Figura 4. Frecuencia de los tipos de hepatitis autoinmune (Czaja AJ et al. Gastroenterology 103:1290, 1992)
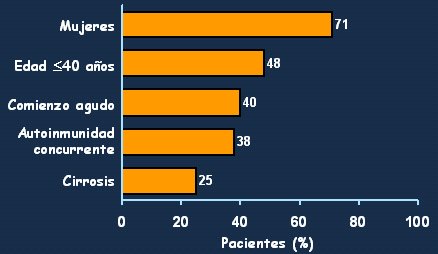
Las características clínicas de este cuadro (Fig. 5) señalan que la mayor parte de los pacientes (71%) van a corresponder a mujeres jóvenes, de 40 a 45 años de edad (48%) y, si bien la enfermedad se puede presentar en todas las edades, el subgrupo mayor de 65 años tiene características especiales. El debut agudo se ve en 40% de los pacientes, con transaminasas elevadas, y son frecuentes los síntomas autoinmunes (38% de los pacientes) y los síntomas generales. Por eso es muy importante, en aquellos casos más difíciles, buscar otros síntomas de autoinmunidad, tales como ojo seco, artralgias, manifestaciones cutáneas, hipotiroidismo, vasculitis, etc. Por último, no se debe olvidar que, independiente de que el debut sea sintomático o asintomático, un 25 - 30% de los pacientes va a tener cirrosis en el momento del diagnóstico.
 Tamaño completo
Tamaño completo Figura 5. Hepatitis autoinmune tipo 1: características clínicas (Czaja AJ et al: Gastroenterology 85:713, 1983)
Las formas clínicas de presentación son múltiples y es importante conocerlas. La forma clásica es la sintomática, con cirrosis o sin ella. Otras formas son: la forma asintomática o hepatitis crónica asintomática; la hepatitis aguda aparente, porque, en realidad, es una hepatitis crónica de debut agudo; la cirrosis descompensada, que es la menos frecuente, pero la más grave, en la cual el tratamiento, cuando se logra instaurar, tiene la menor eficacia; la hepatitis fulminante, que es la forma más dramática. Además están los síndromes de sobreposición, con elementos de cirrosis biliar primaria o colangitis esclerosante primaria; la recurrencia postrasplante o la hepatitis de novo; y no olvidar nunca la hepatitis criptogénica, con marcadores negativos.
Mecanismo de acción de los inmunosupresores clásicos
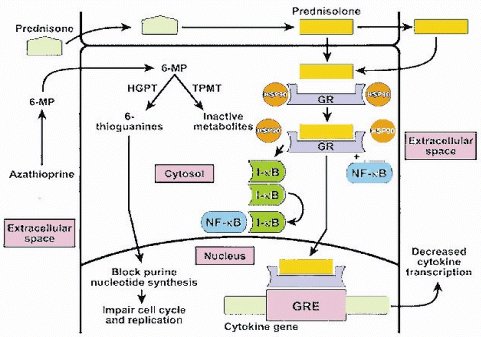
El mecanismo de acción de los dos principales inmunosupresores (Fig. 6) es el siguiente: la prednisona se convierte, dentro del hígado, en prednisolona, que es el metabolito activo, ya que es una molécula lipofílica, capaz de atravesar las membranas sin ninguna dificultad y de unirse al receptor de glucocorticoides en el citoplasma para producir dos efectos; en primer lugar, este receptor se estabiliza a través de la liberación de las heat shock proteins y de la unión de un factor nuclear específico, y pasa al núcleo, para unirse de manera muy intensa a la región promotora (5’) del gen o de los genes que regulan la liberación de citoquinas; por lo tanto, la inmunodepresión que producen los corticoides, mediante la inhibición de los linfocitos T, es intensa: disminuye la producción de una gran cantidad de interleuquinas, interferón gamma, factor de necrosis tumoral, etc. Además, inhibe la formación de un factor citoplasmático que también actúa como potenciador de la acción promotora de la producción de interleuquinas.
La azatioprina se convierte, en el plasma, en 6-mercaptopurina, la que entra al citoplasma donde, mediante la hipoxantina-guanin-fosforribosiltransferasa, se transforma en su metabolito activo, las 6 tioguaninas, que producen un profundo bloqueo de los nucleótidos de purina e impiden el desarrollo del ciclo celular y la activación de los linfocitos, a través de la vía de la TPMT (tiopuril-metil-transferasa). Es una etapa limitante de la activación del metabolito de la 6-mercaptopurina hacia sus metabolitos inactivos y esta vía tiene importancia sólo teórica, puesto que es muy raro que una vía enzimática lenta pueda aumentar notoriamente la concentración de los metabolitos activos y por ende, producir toxicidad. En la práctica personal y colectiva de nuestro centro, es algo muy infrecuente.
 Tamaño completo
Tamaño completo Figura 6. Mecanismos de acción de prednisona y azatioprina
Los corticoides inhiben la activación de los linfocitos T y disminuyen la producción de citoquinas y la expresión de moléculas de adhesión, por medio del metabolito activo, que es la prednisolona, cuya fracción libre da cuenta de la acción terapéutica y también de las reacciones adversas. En la actualidad no hay ninguna evidencia de que exista alguna diferencia, desde el punto de vista de la eficacia del tratamiento, entre administrar prednisolona (o metilprednisolona) o prednisona, la que tiene una gran ventaja desde el punto de vista de los costos, pero es posible que en los pacientes con daño más grave, que tienen hipoalbuminemia o hiperbilirrubinemia, pueda aumentar la fracción libre y esto aumente la aparición de acciones tóxicas. Las dosis son empíricas y fijas. Se ha intentado medir concentraciones plasmáticas de prednisolona en función del peso corporal y ningún estudio ha demostrado que haya alguna diferencia con esta dosis fija y empírica, independiente del peso; sin embargo, es probable que los pacientes probablemente cirróticos y mayores de 65 años requieran dosis menores.
Tratamiento
Las indicaciones absolutas de tratamiento son: aumento de las transaminasas sobre 10 veces lo normal; aumento de las transaminasas sobre 5 veces lo normal y de gamma globulinas sobre 2 veces; presencia de necrosis erosiva, necrosis en puente, necrosis multiacinar o hepatitis lobulillar multiacinar, independiente de que haya necrosis; debut fulminante, en que siempre se deben utilizar todos los fármacos disponibles, para tratar de sacar al paciente de esa situación y liberarlo del trasplante; síntomas incapacitantes, aunque el paciente no esté tan enfermo desde el punto de vista bioquímico; presencia de cirrosis activa, desde el punto de vista histológico; y en niños, que normalmente presentan una enfermedad mucho más agresiva, con mayor frecuencia de cirrosis al momento del debut y con respuesta al tratamiento tan buena como en los adultos.
Entre las indicaciones relativas, es decir, situaciones frente a las cuales se deberá aplicar un juicio clínico y un tratamiento individual, está la presencia de síntomas moderados; pacientes con transaminasas menores de 3 veces el valor normal o gammaglobulina menor de 1,5 veces, es decir, menores que los criterios de indicación absoluta; y biopsia con alteraciones mínimas: hepatitis portal o de interfase mínima, sin fibrosis.
Es perfectamente razonable, según la edad del paciente y sus condiciones, decidir no tratar a un paciente que cumpla este perfil. No se debe tratar a los pacientes que tienen transaminasas prácticamente normales; gammaglobulinas con elevación mínima, menor de 1,5 veces lo normal; cirrosis inactiva avanzada, sin necrosis erosiva; y a los que tienen una tuberculosis previa y reúnen alguna de estas tres condiciones. En pacientes con comorbilidad relevante, como psicosis, obesidad grave, osteopenia sintomática (fractura vertebral), citopenia grave, diabetes de difícil control y neoplasia actual, la decisión debe ser individualizada.
Hay dos opciones de tratamiento y ambos regímenes tienen exactamente la misma eficacia a mediano y largo plazo. La primera estrategia es usar prednisona en monoterapia, en dosis altas, partiendo con 60 mg/día en la primera semana y reduciendo a 40 mg/día en la segunda semana, y a 30 mg/día en las semanas tercera y cuarta, para luego llegar a 20 mg diarios, que es la dosis de mantención indefinida. Esta estrategia no se aplica en forma habitual, por el efecto indeseable de los corticoides, en especial en mujeres jóvenes, excepto en dos situaciones, que son la presencia de una citopenia grave que contraindique el uso de azatioprina, o de una neoplasia actual. El embarazo se analizará aparte.
El tratamiento más razonable (Tabla I) es el tratamiento asociado, en el que se parte con 30 mg/día de prednisona y rápidamente, a la cuarta semana, se llega a 10 mg/día, sin prolongar excesivamente la dosis de 30 mg, como en el régimen anterior. Desde el comienzo se asocia azatioprina, alrededor de 0,7 a 0,8 mg/kg. Está indicado en hepatitis autoinmune en pacientes que tengan osteoporosis, obesidad, diabetes, hipertensión, acné, labilidad emocional, post-menopausia, cirrosis activa, y en mujeres jóvenes.
 Tamaño completo
Tamaño completo Tabla I. Tratamiento de la hepatitis autoinmune: régimen sólo a base de prednisona o asociado con azatioprina
Una vez que se logra la remisión, se pueden suspender los corticoides a largo plazo sin que haya recaídas, pero manteniendo la azatioprina a dosis de 2 mg/kg, como lo demostró el Dr. Roger Williams en un grupo de pacientes que estaban en remisión después de un año de tratamiento, en quienes, al suspender los corticoides, la probabilidad de mantenerse en remisión en forma sostenida sólo con azatioprina fue muy alta (sobre 80%). Por lo tanto, después de un tiempo prolongado de tratamiento, con una paciente inactiva, esta alternativa es perfectamente sustentable.
Complicaciones
La principal complicación del tratamiento son los cambios cosméticos atribuibles a los esteroides: 80% de los pacientes los han presentado a los dos años. Los pacientes que se mantienen por más de dos años con 10 mg diarios tienen alto riesgo de osteoporosis, compresión vertebral, diabetes, cataratas e hipertensión; por eso se debe tratar de mantener con 10 mg diarios o menos, siempre que persista la remisión bioquímica e histológica. En 10% a 15% de los casos, los pacientes deben reducir o suspender los corticoides por obesidad o cambios cosméticos inaceptables (50%), compresión vertebral (30%) o diabetes (20%). En los cirróticos se sugiere utilizar dosis menores, porque la fracción de prednisolona libre puede ser mayor debido a la hipoalbuminemia prolongada (menor de 3 gr por más de 6 meses) o hiperbilirrubinemia (mayor de 2 mg por más de 6 meses).
La azatioprina, en cambio, es una droga extremadamente segura en las dosis que se utilizan habitualmente; sin embargo, en 2% a 3% de los casos se puede presentar colestasia atribuible a este fármaco y más raro es que el paciente presente una enfermedad veno-oclusiva, pancreatitis o rash. Tal vez lo más frecuente, en especial con el uso del genérico (Imuran vs genérico), sean náuseas y vómitos, los que a veces impiden partir con el tratamiento. La mielosupresión se monitorea con la medición de tiopurina metiltransferasa: sólo 0,3% tienen baja actividad y 10% tienen actividad intermedia. No más de 10% de los pacientes que reciben 50 mg/día deben disminuir la dosis o suspenderla; si esto ocurre, se puede reinstalar el tratamiento después de un tiempo, con dosis bajas, y el paciente puede tolerarlo sin problemas.
Se ha debatido bastante sobre el riesgo de oncogenicidad al mantener un tratamiento inmunosupresor por largo tiempo, pero la incidencia de neoplasia extrahepática es muy baja: no va más allá de 2% a 3% después de 10 años de tratamiento y su incidencia es de 1/194 pacientes por año de sobrevida. El hepatocarcinoma depende, fundamentalmente, de la presencia de cirrosis subyacente, pero es menos frecuente que lo que se ve en hepatitis de etiología viral o en la hemocromatosis. Su incidencia es de 1% luego de 10 años de seguimiento; por lo tanto, es muy poco frecuente en la hepatitis autoinmune y no es una razón de peso para no tratar, aunque sí para controlar.
Grupos especiales
Las mujeres posmenopáusicas tienen consideraciones especiales. Alrededor de 20% de las pacientes debutan después de los 50 años de edad y, por lo tanto, tienen alto riesgo de osteopenia. Ellas tienen el mismo patrón clínico y bioquímico que las mujeres premenopáusicas y la misma respuesta al tratamiento, aunque se agregan recomendaciones generales, como evitar el sobrepeso, realizar ejercicio regular y utilizar suplemento de calcio (1 a 1,5 gr/día), vitamina D (50 mil U por semana) y, eventualmente, alendronato, en caso de que exista osteopenia (70 mg por semana). Entonces, deben ser tratadas de la misma forma, procurando utilizar la dosis mínima de corticoides y, después de lograda la remisión, idealmente suspenderlos y mantenerse sólo con azatioprina.
Las mujeres embarazadas constituyen el segundo grupo especial. Desde luego, el embarazo no contraindica el tratamiento y a su vez, la hepatitis autoinmune bien controlada, como muchas otras enfermedades autoinmunes, no contraindica el embarazo, aun en presencia de cirrosis, si bien este caso es muy poco frecuente. Se ha demostrado en animales que la azatioprina sólo es teratogénica en dosis 4 a 5 veces mayores que las que se utilizan en forma habitual; por lo tanto, es una droga perfectamente utilizable en el embarazo. Si la paciente está muy angustiada al respecto, se puede utilizar prednisona en monoterapia, pero no es lo que se recomienda como primera elección. De todos modos, es un embarazo de alto riesgo, porque hay un aumento, aunque pequeño, de las tasas de prematuridad, retraso del crecimiento intrauterino y aborto, pero todo lo anterior es controlable. Las pacientes jóvenes con hepatitis autoinmune y sexualmente activas pueden utilizar anticonceptivos orales sin problemas.
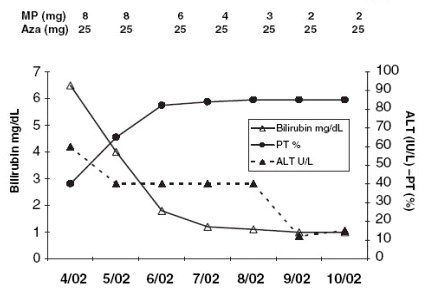
El tercer grupo relevante es el de mayores de 65 años, en quienes hay suficiente evidencia de que se debe utilizar dosis menores, porque, aparentemente, la generación de un estado de inmunotolerancia es más frecuente en este grupo etáreo. En una experiencia publicada recientemente se logró una rápida remisión bioquímica partiendo con dosis muy bajas, por ejemplo, 8 mg de metilprednisolona y 25 mg de azatioprina, con una respuesta exactamente igual que en los casos más clásicos (Fig. 7).
 Tamaño completo
Tamaño completo Figura 7. Tratamiento con dosis bajas en mayores de 65 años
Evolución a largo plazo
Las posibilidades a largo plazo, una vez instalado el tratamiento, son: remisión; respuesta incompleta; fracaso del tratamiento; recaída post suspensión de tratamiento y
toxicidad por el tratamiento
Lo más frecuente es que el paciente entre en remisión, que se define como un paciente asintomático, con transaminasas prácticamente normales, esto es, nivel menor de 2 veces lo normal; bilirrubina y gammaglobulina normales; y biopsia prácticamente normal a los 2 años; sin hepatitis de interfase. La remisión histológica no ocurre prácticamente nunca antes del año, por lo que no tiene sentido adelantar la biopsia antes de los 2 años, aunque la paciente esté sana desde el punto de vista clínico y bioquímico. La biopsia es relevante para tomar la decisión sobre el tipo de tratamiento que se va a seguir o si se va a suspender, pero la gran mayoría de los pacientes (80% a 90%) logran la remisión completa a los 2 a 3 años de tratamiento. Como ya se dijo, en teoría es factible retirar los esteroides y aumentar la dosis de azatioprina a 2 mg/kg/día, en forma indefinida (I. McFarlane y R. Williams; NEJM 1995; 333(15): 958).
El segundo grupo es el de respuesta incompleta, que se caracteriza por un paciente generalmente asintomático, que ha mejorado clínica y bioquímicamente, pero, por lo general, de manera más tardía. En la gran mayoría de los pacientes, la bilirrubina ha caído dramáticamente y las transaminasas han caído a más de la mitad, al mes de tratamiento, y ése es un criterio precoz de remisión: los que demoran más de 3 a 4 meses en mejorar, desde el punto de vista bioquímico y clínico, si entran en remisión, es probable que lo hagan de manera más tardía y sin lograr la remisión histológica completa luego de 2 a 3 años de tratamiento.
En un 10% de los casos, las pacientes logran remisión parcial después de 2 años de tratamiento y en estos casos, entonces, se puede aumentar la dosis de azatioprina a 2 mg/kg y disminuir la prednisona lentamente, hasta la mínima dosis que mantenga el nivel de transaminasas menor de 5 veces lo normal. No hay que olvidar que a veces la remisión se logra más tardíamente, entre el segundo y el cuarto año, por lo que hay que tener paciencia, siempre que no aparezca una descompensación.
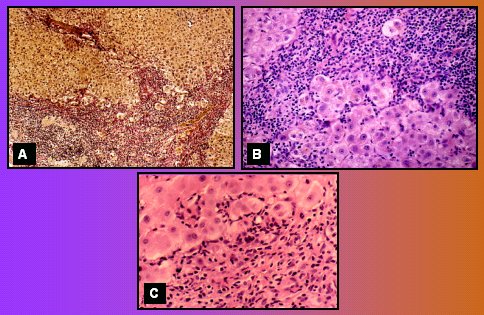
En la actividad de interfase, (Fig. 8A) la membrana limitante entre el espacio porta y el lobulillo tiene células que protruyen hacia el lobulillo, algunas conformando pequeñas rosetas, que es lo que se encuentra habitualmente en la primera biopsia. Otros casos (Fig. 8B), con mayor actividad interfase, muestran una gran cantidad de infiltrado inflamatorio en el espacio porta, saliendo hacia la interfase. Esta paciente, a los dos años de tratamiento, estando clínica y bioquímicamente sana, todavía tenía actividad de interfase, aunque menor que la primera (Fig. 8C).
 Tamaño completo
Tamaño completo Figura 8. Actividad de interfase linfocítica (detalles en el texto)
Se debe evitar (Fig. 9) que se generen puentes de necrosis que, finalmente, van a ir a fibrosis. Este es el escenario más complejo y es exactamente lo que no debe ocurrir.
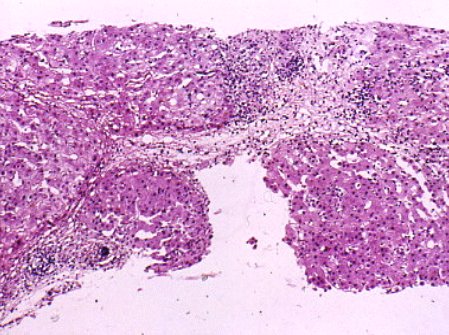 Tamaño completo
Tamaño completo Figura 9. Necrosis confluente
El fracaso de tratamiento consiste en que el paciente empeora desde el punto de vista clínico, bioquímico o histológico, pese a un tratamiento bien llevado, lo que ocurre en menos de 10% de los casos. Esta situación se debe manejar con un tratamiento agresivo, con dosis altas de esteroides y de azatioprina (prednisona 60 mg/día o 30 mg/día, más azatioprina 150 mg/día) durante un mes, con lo que 70% de los pacientes logran entrar en remisión clínica y bioquímica en ese lapso, pero sólo 20% de ellos llegan a la remisión histológica. Después se disminuye mensualmente la dosis de prednisona (10 mg) y de azatioprina (50 mg), hasta llegar a la dosis de mantención habitual. Una alternativa es usar otros fármacos y, desde luego, se debe pensar en el trasplante, según el estado clínico o las complicaciones. En la biopsia (Fig. 10) de una paciente que nunca logró entrar en remisión y que requirió un cambio de tratamiento se observa la fibrosis en puente.
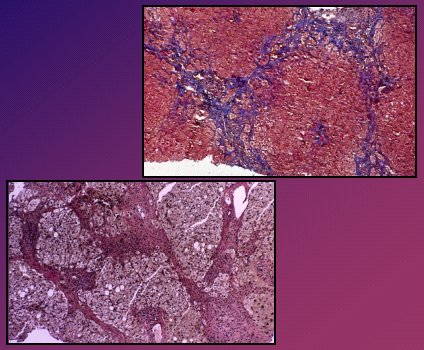 Tamaño completo
Tamaño completo Figura 10.Fibrosis en puente
Con respecto a si se debe suspender el tratamiento después de que se logra la remisión, con una biopsia hepática casi normal, hay dos escuelas en el mundo, pero, en general, pienso que no se debe retirar el tratamiento, puesto que entre 25% y 30% de las pacientes van a recaer, aunque inicialmente hayan logrado una mejoría completa, y las recaídas pueden ser tanto o más graves que el debut inicial. La recaída se define como la reaparición de actividad de la enfermedad después de que se ha suspendido el tratamiento, que se manifiesta por la presencia de transaminasas aumentadas 3 veces o gammaglobulina mayor de 2 gr, y reaparición de hepatitis de interfase, lo que requiere biopsia confirmatoria. La recaída ocurre desde un 20% hasta un 100% de los casos post inducción de remisión y suspensión del tratamiento.
En cuanto a la toxicidad del tratamiento, en el 13% de los pacientes se debe discontinuar o modificar la dosis del tratamiento convencional, en cuyo caso la terapia se debe ajustar al fármaco mejor tolerado y en dosis adecuadas. Los problemas más frecuentes, como se dijo anteriormente, son citopenias, náuseas, inestabilidad emocional, hipertensión arterial, cambios cosméticos y diabetes, los que típicamente son dosis dependientes.
Otros fármacos
Frente a una paciente que no tolera los corticoides o la azatioprina, se debe evaluar la posibilidad de utilizar otros fármacos. Entre ellos se dispone de dos nuevas formas de corticoides: primero, la budesonida, corticoide de segunda generación que tiene un gran efecto de primer paso y genera metabolitos inactivos, por lo que tiene una gran ventaja sobre la prednisona, desde el punto de vista del hueso y la osteopenia; pero hasta ahora no hay estudios que hayan demostrado la superioridad de la budesonida con respecto a la prednisona. El otro corticoide es el deflazacort, un derivado oxazolínico de la prednisona que tiene la ventaja de causar menos efectos glucocorticoides. Varios estudios demuestran que, una vez lograda la remisión del paciente y estando con dosis bajas de prednisona, por ejemplo 5 mg, se puede cambiar a deflazacort en dosis de 7,5 mg, con lo que disminuyen los efectos secundarios.
Los anticalcineurínicos (ciclosporina y tacrolimus) están indicados en casos muy graves que no responden a los esteroides, como tratamiento de salvataje. En algunas series se ha descrito cierta utilidad, pero son pocos casos, ya que son fármacos muy tóxicos. En los casos, que son menos de 15%, que presentan fracaso del tratamiento o que no toleran el medicamento, el micofenolato es una excelente opción para reemplazar la azatioprina, incluso como monofármaco, porque es mucho más potente. Varios estudios han demostrado que el micofenolato es una alternativa prometedora frente a este escenario; en el último estudio publicado se describe una remisión completa en más de 50% de las pacientes que habían presentado fracaso de tratamiento, con dosis de 1,5 a 2 gr/día.

