Acta de reunión clínica
← vista completaPublicado el 1 de agosto de 2009 | http://doi.org/10.5867/medwave.2009.06.3994
Listeria monocytogenes: bacteria antigua, desafío permanente
Listeria monocytogenes: an old bacteria, an ongoing challenge
Resumen
Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
Introducción
Listeria monocytogenes es una bacteria de amplia distribución en la naturaleza y muy resistente a las condiciones adversas del ambiente. Es un patógeno poco frecuente en la población general y puede causar enfermedad tanto en forma esporádica como en brotes. Afecta principalmente a personas en edades extremas de la vida, es decir, recién nacidos y ancianos, embarazadas e inmunosuprimidos. En la mayor parte de los casos la bacteria se adquiere por consumo de alimentos contaminados (1, 2).
Haciendo historia
Listeria debe su nombre a Joseph Lister (1827-1912), cirujano y microbiólogo inglés considerado como uno de los padres de la microbiología; junto a Koch y Pasteur también figura en la historia como el precursor de la antisepsia (3). Lister observó que los pacientes con fracturas expuestas desarrollaban infecciones y fallecían, lo que no ocurría con los afectados por fracturas no expuestas, de modo que decidió utilizar ácido carbólico, que hoy se conoce como fenol y en ese entonces se usaba para eliminar el mal olor de las cloacas, como antiséptico en las heridas operatorias. Su experiencia se publicó en Lancet en 1867 y demostró que la mortalidad disminuía en forma importante con esa medida. Además introdujo en la práctica clínica el catgut, desarrolló una vacuna antineumocócica en Sudáfrica y se dice que descubrió la penicilina antes que Fleming, en 1884. Sin embargo, Lister no tuvo relación con la Listeria, ya que ésta fue descubierta 14 años después de su muerte, en 1926, en conejos, por Murray, Webb y Swann, microbiólogos de la Universidad de Cambridge, quienes bautizaron a este nuevo agente como Bacterium monocytogenes. Casi simultáneamente James Pirie describió el mismo bacilo en un roedor con fiebre y monocitosis en Kenia y lo llamó Listerella hepatolyitica. Luego otros investigadores aislaron la misma bacteria y le dieron diferentes nombres. Esta confusión fue resuelta en 1957 por el alemán Heinz Seeliger, conocido taxónomo, quien en honor a Lister impuso el nombre Listeria monocytogenes, que se utiliza hasta hoy.
El agente
Listeria monocytogenes es la única especie del género Listeria que produce infección en humanos. Es un bacilo grampositivo, corto, anaeróbico facultativo, no formador de esporas y móvil debido a que posee flagelos peritricos, que se proyectan en todas las direcciones. En la tinción de Gram se puede presentar como diplococo similar a un neumococo o como difteroide, similar a Corynebacterium. Otra característica interesante es que puede tener un comportamiento variable frente a la tinción de Gram, al igual que el Haemofilus. Al microscopio la bacteria puede estar sola o formando cadenas cortas; las colonias se ven pequeñas, de color blanco grisáceo y rodeadas de una delgada zona de hemólisis. Esta bacteria es capaz de crecer a temperaturas entre -1,5 y 45° C, lo que incluye las temperaturas de refrigeración, entre 4° y 10° C. Crece bien en un amplio rango de pH, entre 4,3 y 9,1 y en altas concentraciones de sal. Existen 13 serotipos, pero la mayoría de las infecciones por Listeria son producidas por tres de ellos: 1a, 1b y 4b; el último se asocia a brotes. Listeria monocytogenes posee un ciclo vital intracelular, aspecto muy importante en su patogenia (4).
Fisiopatología
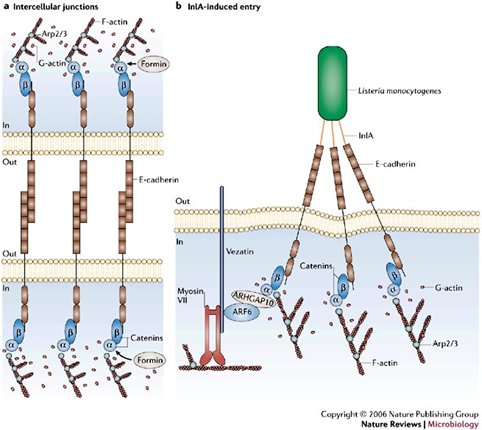
Para ingresar al medio intracelular Listeria utiliza proteínas de superficie conocidas como invasinas o Internalinas A y B, que interactúan con receptores celulares de transmembrana como E-Caderina, en el caso de Internalina A y Tirosin-kinasa Met-c, en el de Internalina B; estas interacciones favorecen la entrada de la bacteria mediante fagocitosis. Listeria Monocytogenes se adquiere por vía digestiva, es fagocitada por las células hospederas del epitelio intestinal y se traslada de célula en célula sin exponerse al ambiente extracelular. Una vez en el interior de la célula Listeria expresa la proteína Listeriolisina O, responsable de su capacidad de invasión y virulencia, ya que le permite escapar desde la vacuola hacia el citoplasma. Luego se comienza a dividir y expresa Act A, que utiliza los filamentos de actina celulares para mover a la bacteria, formando una verdadera “cola de cometa”. Cuando alcanza las fronteras celulares es capaz de inducir una fagocitosis por parte de otra célula vecina, lo que permite que el ciclo se repita mientras la bacteria se mantiene oculta para el sistema inmunológico (5, 6).
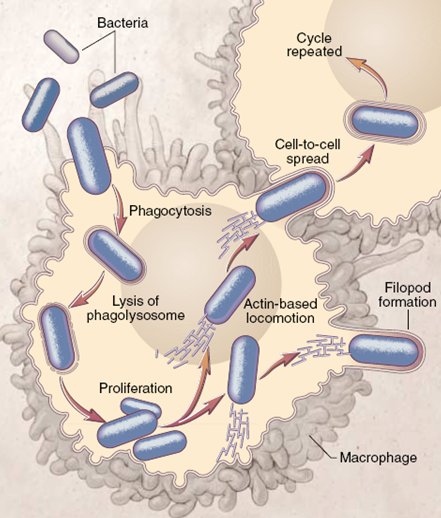 Tamaño completo
Tamaño completo La proteína E-Caderina tiene un rol fundamental en las uniones intercelulares. Se sabe que cuando se producen fenómenos de remodelación en la vellosidad intestinal esta proteína queda expuesta en la superficie del lumen, donde se encuentra Listeria; en ese momento se produce la interacción entre Internalina A y E-Caderina, que culmina en la fagocitosis de la bacteria (7). La expresión abundante de E-Caderina por parte del sinciciotrofoblasto explicaría el tropismo placentario de este patógeno. El otro receptor celular involucrado en su fagocitosis, la proteína tirosin-kinasa Met-c, tendría un rol en el paso de Listeria a través de la barrera hematoencefálica.
 Tamaño completo
Tamaño completo Desde el punto de vista inmunológico, Listeria es el modelo clásico para estudiar la respuesta inmune innata y adaptativa a organismos intracelulares. La respuesta innata es inmediata e involucra a monocitos y macrófagos, los que producen interleuquina uno (IL-1), IL-6 y factor de necrosis tumoral alfa (TNF alfa), que produce reclutamiento celular, principalmente de neutrófilos (5). A esta reacción inicial le sigue la respuesta inmune adaptativa, que llega a su máximo una semana después de la infección y se ejerce a través de los linfocitos T CD8 (+). Esta respuesta tiene dos objetivos principales: generar lisis de las células afectadas e inducir la producción de interferón (INF) gamma, que evita la diseminación de la bacteria y controla la replicación. La depuración de Listeria monocytogenes se atribuye a una respuesta de células Th 1; el INF gamma es un promotor de este tipo de respuesta y además inhibe la expansión de las células Th 2.
Epidemiología
El hábitat primario de Listeria es el suelo, la tierra y el material vegetal en descomposición; se ha aislado en agua, alcantarillado, deposiciones de animales y varios tipos de alimentos, principalmente leche cruda y derivados, carnes, embutidos, ensaladas y pescados ahumados; es capaz de infectar a varios tipos de animales, entre ellos mascotas, ganado, reptiles, roedores y aves. Si bien su principal mecanismo de transmisión es indirecto, a través de alimentos contaminados, también se considera a la listeriosis como una zoonosis, ya que ciertas poblaciones como veterinarios o trabajadores de granjas o mataderos se pueden contagiar por contacto directo con secreciones infectadas con Listeria. Incluso se ha demostrado que entre 1% y 5% de las personas sanas pueden excretar la bacteria a través de las deposiciones.
La mortalidad de los cuadros clínicos causados por este germen es variable dependiendo de la serie y el tipo de paciente, pero puede llegar a 50%. La incidencia anual varía entre 0,1 y 11,3 casos por millón de habitantes. En los Estados Unidos en 2007 la incidencia fue 0,27 por 100.000 personas; en Europa se describe 0,2 a 0,8 casos por 100.000, con cifras absolutas de 1.600 a 8.400 casos y 320 a 2.500 muertes anuales. La incidencia en embarazadas es mucho mayor, 12 por 100.000 y en pacientes inmunocomprometidos puede llegar hasta 145 por 100.000. En Chile la incidencia fue 0,25 por 100.000 hasta antes del brote de 2008; cada año se enviaron entre 44 y 50 muestras positivas al Instituto de Salud Pública hasta el año 2007 (8).
La listeriosis se presenta en forma esporádica en 95% de los casos; el resto se presenta en brotes que tienden a ocurrir en verano. En individuos inmunocompetentes la infección es no invasora y ocasiona un cuadro clínico similar a una gastroenteritis febril, mientras que en embarazadas, inmunocomprometidos, neonatos y ancianos adquiere una forma invasora y produce un cuadro clínico grave, durante el cual se puede aislar Listeria en sangre, líquido cefalorraquídeo (LCR) o cualquier otro líquido estéril. En ambas formas se encuentra el antecedente de consumo de un alimento contaminado, especialmente en los brotes.
La listeriosis se describió como una entidad asociada a brotes alimentarios en 1983, en Canadá; posteriormente se comunicó la ocurrencia de brotes en los Estados Unidos, Europa y Chile; en los Estados Unidos la listeriosis ocupa el segundo lugar en mortalidad entre las infecciones transmitidas por alimentos, con alrededor de 20% (9, 10). Lo habitual es que los brotes se asocien al consumo leche o lácteos no pasteurizados, especialmente quesos blandos, pero también se ha descrito brotes asociados a consumo de carnes, pescados y vegetales.
En Chile, Cordano y colaboradores estudiaron la presencia de Listeria monocytogenes en alimentos comunes en Santiago, entre 1990 y 1997; para ello tomaron 2.145 muestras de helados, quesos blandos, quesos duros, cecinas y mariscos, de las cuales 77 fueron positivas (3,6%). El porcentaje de muestras positivas para cada tipo de alimento fue: helados, 3,5%; quesos blandos, 0,8%; quesos duros, 0%; cecinas 3,6% y mariscos, 11,6%. En el año 2000 se desarrolló la segunda etapa del estudio, en la cual se estudiaron 709 muestras de ensaladas preparadas en supermercados; los análisis demostraron que 26% de las ensaladas congeladas y 10,5% de las ensaladas frescas contenían Listeria monocytogenes, lo que sugiere que esta bacteria se encuentra en cantidad significativa en alimentos que se comercializan como “listos para consumir” (12).
Como ya se mencionó, los grupos de mayor riesgo son las personas en los extremos de la vida, los inmunodeprimidos y las mujeres embarazadas. Este último grupo acumula un tercio de los casos de listeriosis y tiene un riesgo veinte veces mayor que la población general, sobre todo en el tercer trimestre. En personas no embarazadas el factor de riesgo más importante es el uso de corticoides, aunque cualquier patología que altere la inmunidad celular también aumenta el riesgo: tratamientos con antagonistas de TNF alfa, cánceres hematológicos o tumores sólidos, trasplantes de órganos sólidos, diabetes mellitus, insuficiencia renal crónica, enfermedades autoinmunes y VIH, entre otras. Los pacientes portadores de VIH tienen una probabilidad 100 a 1000 veces mayor de desarrollar listeriosis, pero en general no la presentan gracias al uso de cotrimoxazol como profiláctico (10).
Cuadro clínico
Las formas de presentación de la listeriosis son:
- Gastroenteritis aguda febril.
- Infecciones durante el embarazo.
- Sepsis sin foco evidente.
- Infección del sistema nervioso central.
- Otras infecciones más raras denominadas infecciones focales.
La gastroenteritis febril es la manifestación propia del inmunocompetente; ocurre durante los brotes y requiere de un gran inóculo bacteriano; la tasa de ataque puede variar entre 50 y 100%; el período de incubación oscila entre 6 y 240 horas, con un promedio de 24; los síntomas duran dos a tres días y la recuperación es completa. En un inmunocompetente no es necesario tratar el cuadro, que muchas veces es asintomático.
En embarazadas las infecciones son clínicamente leves o asintomáticas, pero cursan con bacteriemia de modo que se pueden presentar con fiebre, escalofríos, dolor lumbar o configurar un cuadro tipo gripal (flu-like syndrome), que es una de las manifestaciones más frecuentes. Por fortuna el compromiso del SNC es poco frecuente en las embarazadas, pero la infección fetal y neonatal es grave y su mortalidad puede llegar a 20 ó 30%. Los resultados perinatales son abortos, partos prematuros o recién nacidos infectados que desarrollan listeriosis neonatal precoz o tardía. La tardía se caracteriza por compromiso del SNC, no así la precoz que se manifiesta como una sepsis grave (6, 13).
La bacteriemia sin foco evidente es la manifestación más frecuente en inmunocomprometidos. Los síntomas son similares a los de cualquier otra causa de bacteriemia: fiebre, mialgias, pródromo con diarrea y náuseas. El período de incubación varía entre 6 horas y 90 días, con un promedio de 15 días (10).
La infección del SNC se manifiesta con mayor frecuencia como meningoencefalitis, pero se puede ver cerebritis, abscesos cerebrales y romboencefalitis, que es poco frecuente pero muy característico de Listeria. La meningoencefalitis ocurre especialmente en neonatos infectados de más de tres días, lo que se conoce como listeriosis neonatal tardía, en pacientes ancianos y en inmunocomprometidos debido a enfermedades malignas hematológicas o trasplante renal; la presentación clínica es variable, puede ser de curso agudo o subagudo y algunos pacientes no presentan signos meníngeos, de modo que el diagnóstico requiere alto grado de sospecha; puede haber signos focales tales como compromiso de pares craneanos, ataxia, temblor, hemiplejia, convulsiones y sordera debido al compromiso encefálico (10, 14). La romboencefalitis o encefalitis del tronco cerebral presenta un curso bifásico con cefalea, fiebre, náuseas y vómitos seguidos por parálisis de nervios craneales, ataxia, temblor, signos cerebelosos, compromiso de conciencia y convulsiones. Los cultivos de líquido cefalorraquídeo son positivos en 40% de los casos y los hemocultivos, en 60 a 70% de ellos.
Los siguientes elementos son sugerentes de meningitis por Listeria monocytogenes: presentación aguda o subaguda; signos meníngeos menos frecuentes; más frecuentes son los signos de focalidad, como movimientos anormales y la fluctuación del nivel de conciencia. Los hemocultivos a menudo son positivos y los niveles de glucosa en LCR son normales en dos tercios de los casos. La tinción de Gram es de baja sensibilidad y la mayoría de las veces resulta negativa. Las imágenes pueden ser útiles como se observa en la Fig. 3, donde la secuencia tomográfica muestra una hipodensidad extensa en lóbulos occipital, parietal y temporal con efecto de masa que capta irregularmente el contraste; se trata de una cerebritis en una paciente de 71 años infectada con Listeria. Abajo se observa el corte frontal de una resonancia magnética con gadolinio, que muestra lesiones en tronco cerebral con aspecto de microabscesos en un paciente de 40 años de edad, portador de lupus eritematoso sistémico, infectado con Listeria (15).
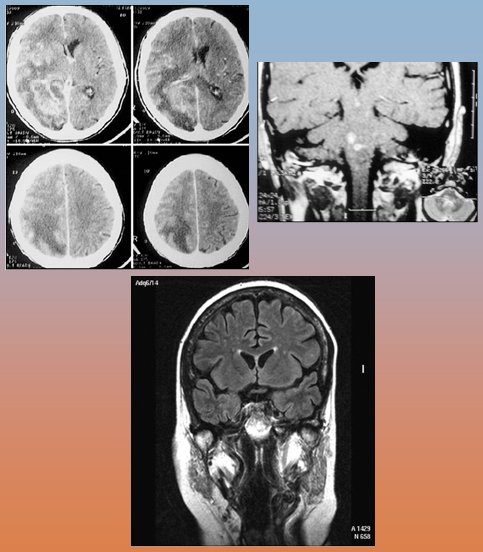 Tamaño completo
Tamaño completo Las infecciones focales por Listeria son muy poco frecuentes, entre ellas: infecciones de piel y ojo, que son raras y se deben a exposición ocupacional; linfadenitis, neumonías, empiemas, miocarditis, endocarditis, artritis séptica, osteomielitis, infecciones de prótesis, abscesos espinales y cerebrales, colecistitis, hepatitis y peritonitis en pacientes en diálisis peritoneal (10).
Diagnóstico de listeriosis
Para llegar al diagnóstico es importante tener un alto grado de sospecha clínica y buscar dirigidamente el antecedente epidemiológico de consumo de alimentos sospechosos, sobre todo lácteos, especialmente en el contexto de pacientes inmunodeprimidos o embarazadas. El cultivo de LCR es positivo en 40% de los casos, cifra que aumenta hasta 70% en el caso de los hemocultivos. También es útil el cultivo de líquido amniótico, la tomografía axial computada (TAC) y la resonancia nuclear magnética.
El LCR obtenido por punción lumbar puede tener aspecto claro o turbio, de modo que esta característica no es específica, al igual que la pleiocitosis, que puede variar desde 100% de mononucleares hasta 100% de polimorfonucleares. Las proteínas pueden estar moderadamente elevadas y la glucosa, normal o baja (39%); cuando hay predominio de mononucleares, generalmente en el recuento diferencial hay predominio de linfocitos (> 25%). Este elemento puede ser muy útil, ya que en el caso de una meningitis bacteriana con glucosa normal se debe pensar en Listeria monocytogenes. Como ya se mencionó, la tinción de Gram es de baja sensibilidad y ayuda sólo en un tercio de los pacientes, cuando se informa como Gram variable. En la romboencefalitis el análisis del LCR puede resultar normal o discretamente alterado, lo que puede dificultar el diagnóstico (10).
Tratamiento
Existen dos factores que dificultan el tratamiento de la listeriosis: primero, los pacientes afectados generalmente son inmunocomprometidos, por lo tanto presentan cuadros larvados o atípicos; segundo, el ciclo de vida intracelular y la formación de granulomas en los tejidos dificulta una rápida respuesta al tratamiento antibiótico, ya que se requiere de altas concentraciones intracelulares. Estas dos razones dificultan el diagnóstico precoz y el tratamiento oportuno.
Por otra parte no existen estudios controlados que hayan establecido la droga de elección ni la duración del tratamiento; las recomendaciones actuales se basan en estudios de sensibilidad in vitro, modelos animales y experiencia clínica en pequeños grupos de pacientes comparados con controles históricos. Si bien Listeria monocytogenes es sensible a muchos antibióticos y la resistencia es rara, no hay que olvidar que esta bacteria es intrínsecamente resistente a las cefalosporinas de tercera generación, que son los medicamentos de primera línea frente a las meningitis, debido a la presencia de una proteína ligadora de penicilina (PBP) específica conocida como PBP-3, que no interactúa con las cefalosporinas.
La terapia más recomendada combina dos drogas de efecto sinérgico: ampicilina 2 g c/4 horas o penicilina 4 millones UI c/4 horas, endovenosa, más gentamicina 3 mg/k/día dividida en 3 dosis endovenosas (6, 10). Este esquema se recomienda en pacientes con infección del SNC, endocarditis, bacteriemia e inmunocomprometidos. En caso de pacientes alérgicos a penicilina se recomienda cotrimoxazol en dosis de 5 mg/k de trimetroprim c/6 horas, que también se puede combinar con ampicilina si el paciente no es alérgico; algunos autores sugieren que esta combinación sería mejor que ampicilina más gentamicina. El cotrimoxazol no se puede usar en el primer trimestre del embarazo porque se asocia a problemas en el desarrollo del tubo neural, ni en el tercer trimestre por riesgo de kernicterus; en embarazadas se podría utilizar vancomicina o meropenem en dosis de 2 g c/8 horas por vía endovenosa.
En cuanto a la duración de la terapia, en pacientes inmunocompetentes se recomienda dos semanas en bacteriemias y entre dos semanas y cuatro semanas en caso de infección del SNC. En pacientes inmunocomprometidos el tratamiento se prolonga entre tres y seis semanas en cuadros de bacteriemia y entre cuatro y ocho semanas en infecciones del sistema nervioso central. Cuando se agrega gentamicina se recomienda administrarla sólo entre 10 y 14 días, tiempo en el cual el paciente debería lograr una mejoría evidente, pero se puede prolongar hasta 21 días si el paciente no presenta signos de nefro u ototoxicidad (10).
Descripción de un brote de listeriosis en la Región Metropolitana
En junio de 2008 se observó un aumento de los casos de listeriosis en la Región Metropolitana de Chile, especialmente en el sector oriente de la capital; en diciembre de ese año se habían notificado 119 casos, cifra cinco veces superior a lo descrito en los anteriores. El producto contaminado se retiró de mercado y a partir de la semana 51 del año 2008 la incidencia de casos nuevos se redujo marcadamente. En la Fig. 4 se grafica el número de casos de listeriosis notificados en la RM entre 2008 y 2009; el color naranja representa los casos producidos por el clon epidémico (clon 09) y su descenso luego de retirar los alimentos contaminados.
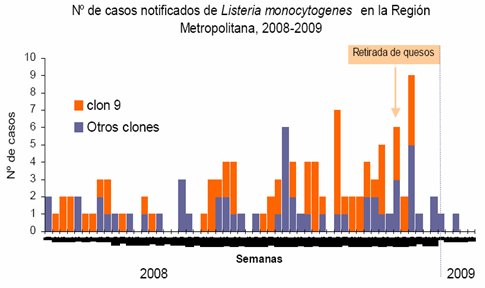 Tamaño completo
Tamaño completo 40% de los casos del brote ocurrió en mujeres embarazadas; 23% en adultos mayores con o sin patologías de base; 14% en recién nacidos; 15% en inmunocomprometidos y 8% en pacientes sin factores de riesgo. Seis pacientes fallecieron. El estudio de las cepas realizado por el Instituto de Salud Pública concluyó que 55% de los casos fueron causados por una cepa relacionada genéticamente conocida como clon 09. La investigación epidemiológica determinó que los alimentos involucrados fueron quesos Brie y Camembert de marca Chevrita, los que se retiraron el 25 de noviembre de 2008. 77% de los pacientes afectados por la cepa epidémica residían en el sector oriente de la capital, específicamente en las comunas de Las Condes y Vitacura.
Prevención de la listeriosis
Las siguientes son recomendaciones para prevenir infecciones por Listeria Monocytogenes (9). Para la población general se sugiere:
- Almacenar las comidas “listas para comer” a 4° C o menos.
- Usar los alimentos perecibles y “listos para comer” lo antes posible.
- Cocer en forma adecuada los productos derivados de vacunos, aves y peces.
- Lavar en forma prolija frutas y verduras antes de consumirlas.
- No consumir lácteos no pasteurizados.
- Limpiar el refrigerador en forma regular.
- Mantener separados los distintos tipos de alimento en el refrigerador.
- Mantener las superficies de cocina y utensilios limpios.
Para la población compuesta por mujeres embarazadas, adultos mayores, inmunosuprimidos y otros grupos de riesgo, se recomienda además:
- No comer hotdogs o carnes “deli”, definidas como rebanadas de carnes cocinadas como jamón, roast beef, salame y pavo, a no ser que se recalienten hasta hervir.
- No comer quesos blandos del tipo azul, brie, estilo mexicano y camembert o frescos, a menos que se consigne que se fabricaron con leche pasteurizada.
- No comer patés o salsas de carne, a menos que estén enlatados.
- No comer pescados ahumados refrigerados, salvo que estén en platos bien preparados y con buena cocción.
- No beber leche no pasteurizada ni comer alimentos que la contengan.
Conclusiones
Listeria monocytogenes es un patógeno intracelular que se encuentra presente en alimentos de consumo diario en Chile. Es probable que se requieran nuevos estudios a nivel epidemiológico para redimensionar el problema. Para el diagnóstico se requiere un alto grado de sospecha clínica, siendo importante el antecedente epidemiológico de consumo de alimentos lácteos no pasteurizados y el tipo de paciente afectado.

