Publicado el 1 de agosto de 2005 | http://doi.org/10.5867/medwave.2005.07.2312
El papel de los canales de potasio en la regulación de la presión arterial
The role of potassium channels in regulating blood pressure
Resumen
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Nefrología.
Introducción
El ión potasio (K) se distribuye tanto en el líquido intracelular (LIC) como en el extracelular (LEC), pero la cantidad absoluta es muy distinta en cada uno, siendo mucho mayor dentro de la célula que fuera de ella. La concentración de K en el LIC, cuyo volumen aproximado es de 27 litros, es de 140 mEq/l, lo que da un total de 3.780 mEq; en cambio, en el LEC, cuyo volumen es de 14 litros, la concentración de K es de 4,5 mEq/l, de modo que su cantidad absoluta alcanza a sólo 63 mEq. Lo dicho tiene una serie de connotaciones, sobre todo con respecto al potencial de membrana.
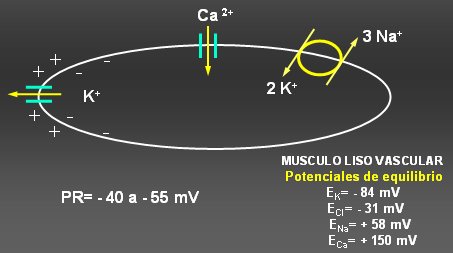
El potencial de membrana es generado por la bomba sodio potasio ATPasa (Na/K ATPasa), que bombea K hacia el interior de la célula y saca Na hacia el exterior de ella, lo que aumenta la cantidad de K y disminuye la cantidad de Na a nivel intracelular. Esto ocurre con gasto de energía. Si la membrana fuese permeable a todos los iones por igual, el gradiente generado se perdería rápidamente; pero, como la permeabilidad es mayor para el K que para el Na, lo más importante en la génesis de este potencial de membrana, a nivel del músculo liso y de otras células, es la salida de potasio, que tanto por su concentración como por el gradiente eléctrico, tiende a salir de la célula. El potencial de membrana del músculo liso vascular fluctúa entre –40 a –55 (véase Figura 1).
 Tamaño completo
Tamaño completo Figura 1. Regulación del potencial de membrana y tono vascular por canales de potasio.
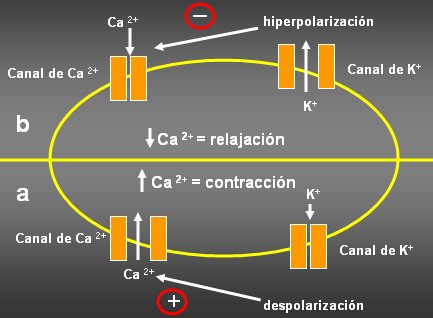
En la Figura 2 se explica cómo se acopla esta función con la contracción del músculo liso y qué relación tiene con el tono vascular y la hipertensión. En estas células hay canales de calcio regulados por voltaje, entre ellos los clásicos canales tipo L, que se pueden bloquear con los bloqueantes de cálcicos que se utilizan en la clínica. Cuando la membrana se despolariza, los canales de calcio se abren, permiten mayor entrada de calcio al interior de la célula, y esto conduce a una mayor contracción de la célula. Al contrario, cuando la membrana se hiperpolariza, los canales se cierran, hay menos calcio disponible para al aparato miocontráctil y la célula se relaja.
 Tamaño completo
Tamaño completo Figura 2. Interacción entre canales de K y Ca.
Mientras más tiempo estén abiertos los canales de potasio o mayor cantidad de ellos estén abiertos, la salida de potasio será mayor; en consecuencia, la membrana se hiperpolariza, los canales de calcio se cierran, el calcio intracelular disminuye y hay relajación. A la inversa, cuando se cierran los canales de K, hay despolarización, activación de canales de calcio, mayor entrada de calcio y contracción del músculo liso. Hay un excelente review de Davis y Smith (Physiol Rev 79: 387-423, 1999), sobre este tema.
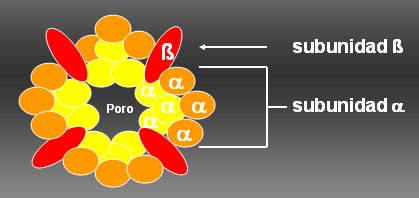
La Figura 3 ilustra la estructura hipotética de un canal de K regulado por voltaje, que se compone de subunidades alfa y beta. Las subunidades alfa están formadas por una proteína con seis segmentos transmembrana, con el extremo amino y carboxi terminal hacia la célula, y un sensor de voltaje. Una subunidad alfa tiene seis segmentos que atraviesan la membrana y una subunidad beta, que habitualmente es intracelular. Con la unión de cuatro subunidades beta y cuatro subunidades alfa se forma el poro del canal funcional. La subunidad beta se une a sustancias intracelulares y regula (favorece o disminuye) el pasaje de K por el canal. Diversos investigadores están abocados a estudiar las alteraciones en la subunidad alfa o en la subunidad beta que modifican la conductancia de K.
 Tamaño completo
Tamaño completo Figura 3. Modelo hipotético de un canal de potasio regulado por voltaje tipo Shaker.
Clases de canales de potasio
Existen distintos tipos de canales de potasio en el músculo liso vascular: regulados por voltaje; regulados por calcio; y rectificadores internos.
Los canales regulados por voltaje se llaman Kv y tienen muchos miembros en esta clase; específicamente los que están presentes en el músculo liso son el Kv 1.5 y quizás el Kv 1.1. Hay inhibidores específicos de estos canales (4-Aminopiridina, quinina e hipoxia).
Los canales regulados por calcio intracelular tienen la misma disposición, pero en el segmento carboxi terminal pueden unir calcio. Hay canales de conductancia mayor, llamados hslo (también Maxi K o BK), que son los más abundantes de todos los canales de potasio en los vasos sanguíneos; los activan el calcio intracelular y las proteín kinasas A y G; tienen inhibidores específicos (iberiotoxina, charibdotoxina y TEA). Hay además canales regulados por calcio que permiten menor conductancia de K, llamados de “conductancia menor”.
Los canales rectificadores internos, en lugar de tener seis segmentos transmembrana, tienen solamente dos; también deben unirse cuatro subunidades alfa con cuatro subunidades beta para formar el canal funcional. Una subclase está constituida por el canal Kir (inward rectifier), sus componentes principales son Kv 2.0 y quizás Kv 1.0, son activados por hiperpolarización e inhibidos por bario y 4-Aminopiridina y se postula que participan en la vasodilatación por hiperkalemia.
Otra subclase es el K-ATP, habitualmente están inhibidos por el ATP intracelular; pero cuando sobreviene hipoxia y disminuyen los niveles de ATP, estos canales se abren, la membrana se hiperpolariza, entra calcio y el vaso arterial se dilata. Esto ocurre, por ejemplo, en el shock séptico, en que la hipoxia causa la apertura de los canales de potasio, lo que se suma a los mecanismos clásicos de vasodilatación en el shock séptico. Los canales K-ATP tienen una subunidad llamada SUR (unidad receptora unida a sulfonilureas) a nivel del páncreas, las sulfonilureas se unen a este canal, se activa el canal de potasio y se inicia la liberación de insulina.
Otra clase de canal de potasio es el canal de dos poros, que tiene cuatro segmentos transmembrana. En los nemátodos se han descrito más de 80 canales distintos, muchos de ellos ya tienen un homólogo humano y algunos están presentes a nivel de la vasculatura. A estos canales no me voy a referir en esta charla.
Por lo tanto, hay distintos canales de potasio en distintos tejidos y, dependiendo de la subunidad beta, habrá distintos reguladores.
Canal Maxi K
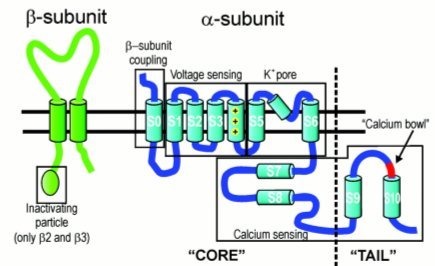
En la Figura 4 se muestra la estructura del canal Maxi K, que tiene una subunidad alfa con seis segmentos transmembrana y un segmento extra; aún se discute si es intracelular o está en la membrana, pero tiene en el extremo carboxi terminal un lugar al que se puede unir el calcio. Además, tiene una subunidad beta, de las cuales hay cuatro descritas en distintos tejidos; el tipo 1 es el que se encuentra en músculo liso vascular.
 Tamaño completo
Tamaño completo Figura 4. Estructura del canal Maxi K.
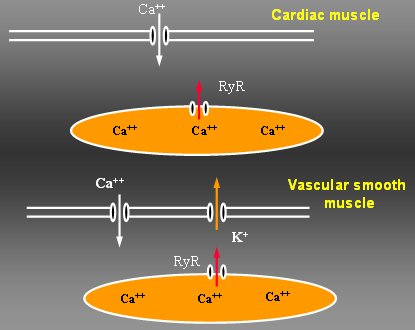
Explicar el hecho de como la entrada de calcio produce la contracción del músculo liso vascular es un poco más complejo. Si bien el calcio sirve para que se una la actina con la miosina y se active la contracción, el aumento del calcio intracelular determina que este ión se una al receptor de rionidina que se encuentra en el retículo sarcoplásmico e induzca la liberación de calcio; con ella se activan los canales Maxi K, cuya apertura permite la salida de potasio (véase Figura 5).
 Tamaño completo
Tamaño completo Figura 5. Papel del receptor rionidina.
La importancia de este fenómeno radica en que la contracción causa, por un mecanismo de retroalimentación positiva, también la relajación, ya que la salida de potasio hiperpolariza la membrana, cierra el canal y relaja el músculo liso. Los receptores rionidina están en íntimo contacto con los canales Maxi K y por lo tanto permiten esta retroalimentación negativa. En cambio, en el músculo cardíaco no hay Maxi K, de modo que, cuando entra calcio en la célula y se libera calcio del receptor rionidina, el calcio participa solamente en la contracción de la célula cardíaca.
En el músculo liso vascular, la liberación de calcio de depósito sirve para relajar el vaso sanguíneo previamente contraído; por lo tanto, el tono vascular está regulado por este mecanismo, que es totalmente autónomo y ocurre in vitro, sin regulación hormonal ni del sistema nervioso. Si se saca un vaso sanguíneo del cuerpo, ese vaso está totalmente flácido, pero, a medida que se presuriza al mismo, la membrana plasmática comienza a despolarizarse, se abren los canales de calcio tipo L, entra calcio a la célula y se incrementa el tono arterial; pero, como ya se ha dicho, esto produce apertura de los canales maxi K, la membrana se hiperpolariza y el vaso se relaja. Por medio de este mecanismo de feedback negativo, las arterias se encuentran en estado de semi contracción, denominado tono vascular.
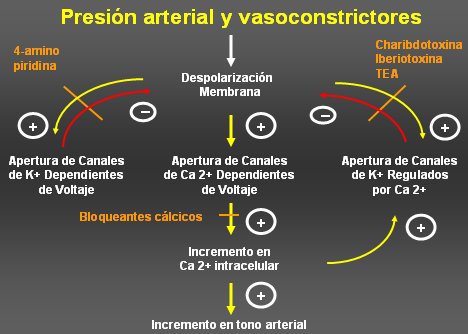
En la Figura 6 se muestra el mecanismo por el cual la presurización de una arteria aumenta la presión arterial. Existirían canales sensibles al estiramiento; son canales catiónicos inespecíficos y censan el estiramiento de la célula; un mayor estiramiento produce una despolarización inicial por cierre de canales de potasio que desencadena la apertura de los canales de calcio dependientes de voltaje, con incremento en el calcio intracelular y luego incremento en el tono arterial.
Por otra parte, existen los canales de K dependientes de voltaje, que se activan con la despolarización y al abrirse se repolarizan o hiperpolarizan. Este mecanismo es muy importante en la mantención del tono vascular y es muy conocido clínicamente, porque cuando se administran bloqueadores del calcio se produce vasodilatación y cuando se administra inhibidores de canales de potasio regulados por calcio, como la iberiotoxina, la arteria no puede relajarse.
 Tamaño completo
Tamaño completo Figura 6. Presión arterial y vasoconstrictores.
Canales de K y regulación de la presión arterial
Las alteraciones de los canales de K podrían hipotéticamente producir hipotensión o hipertensión. Una de las primeras evidencias concretas surgió en 2000, cuando el grupo de Brenner y Nelson estudió la importancia de la subunidad beta uno, que tiene cuatro exones, en un ratón knock out carente del segundo exón.
Al estudiar los canales de K con métodos electrofisiológicos, se comprobó que en el grupo control la actividad del canal era normal permitiendo la entrada de K; en cambio, en el ratón knock out el canal no permitía prácticamente pasaje de este ión. Al incrementar la cantidad de calcio, con lo que el canal debería abrirse mucho más, tampoco hubo salida de K (Figura 7 panel a).
En ratones control, al activarse el canal de rionidina se producía una “chispa” (spark), salida de calcio que induce un aumento concomitante de corriente del canal Maxi K. Pero en el ratón knock out, la presencia de chispas no se correspondían con corriente en los canales de K debido a la insuficiente valoración de niveles intracelulares de calcio por la subunidad beta mutada (Figura 7 panel b).
 Tamaño completo
Tamaño completo Figura 7. Regulación del tono vascular por la subunidad beta del canal de K activado por calcio (Brenner et al. Nature 2000; 407:870-76).
Cuando se midió la presión arterial de estos animales, se encontró que el promedio fue de 114 ± 6,0 mm Hg en el grupo control (n = 6) y de 134 ± 5 mmHg en el grupo de ratones knock out (n = 6), diferencia estadísticamente significativa (p < 0,029).
En 2004, el Dr. Ramón Latorre, junto con un grupo español, estudió la correlación, en seres humanos, entre las alteraciones de los canales de potasio y la presión arterial, y observó que una mutación que hace aumentar la función de la subunidad beta se asociaba con baja presión arterial. En ese estudio, un trabajo epidemiológico muy interesante, se utilizó una base de datos española de 3.000 individuos en quienes se determinó el genotipo de la subunidad beta; se encontró una mutación a nivel del aminoácido 65, con reemplazo del ácido glutámico por glicina. Del total de 3.000 casos, 80% tenían el gen EE, o sea, tenían ácido glutámico en sus dos cromosomas; 20% tenían una forma heterocigota u homocigota, pero los últimos eran muy pocos, menos de 1%. Luego se midió la presión arterial en función del genotipo y se comprobó que, cuanto menor era la presión arterial, mayor era la prevalencia de la mutación; cuanto más alta era la presión, más frecuente era la condición de homocigoto de los dos ácidos glutámicos (Clin Invest 113:1032–1039 (2004).
A continuación se hicieron mutantes de los canales de potasio con esa alteración del ADN, se fabricó ARN mensajeros que fueron inyectados en ovocitos para luego determinar la corriente que se producía a través de esa membrana plasmática; es un experimento simple de electrofisiología. Cuando sólo se inyectaba la unidad alfa, a medida que aumentaba el calcio había más corriente y más K pasando a través del canal; cuando se ponía la subunidad alfa y beta normales (wild type) aumentaba la corriente y la subunidad alfa se hacía mucho más sensible al calcio, y pasaba más K. Cuando se introducía una subunidad alfa y una beta con la misma mutación que se encontró en esa población, pasaba aún más potasio, ya que esta subunidad beta mutada es más sensible al calcio.
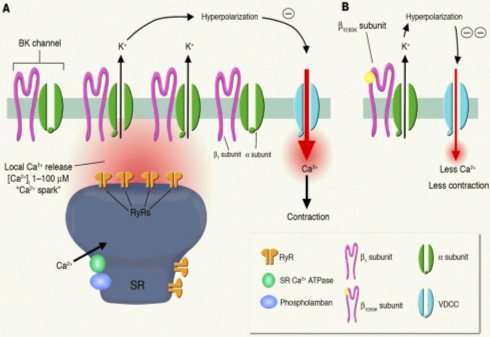
En la Figura 8 se observa el receptor de rionidina y, arriba, la zona donde se libera el calcio y el canal de K, con las subunidades beta y alfa por donde pasa el ión. En un individuo normal esta liberación causa hiperpolarización que cierra el canal de calcio y origina contracción; cuando la subunidad beta está mutada, se censa más el calcio que se libera de los receptores de rionidina, lo que causa mayor salida de K, con hiperpolarización, menor calcio intracelular y menor contracción (arriba a la derecha). Los autores concluyeron que, debido a esta mutación, el canal era hipersensible y que con valores normales de calcio intracelular había mayor hiperpolarización.
 Tamaño completo
Tamaño completo Figura 8. Mutación de la subunidad beta del canal de K, asociada con menor presión arterial.
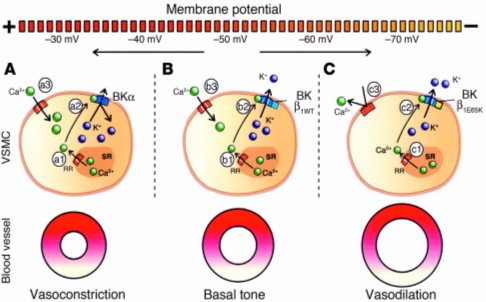
En la Figura 9 se ve una representación de un individuo normal, en el cual, cuando entra calcio, se libera calcio del receptor de rionidina, se permite la salida de potasio y con ello, se mantiene un tono arterial basal. En cambio, en el knock out de beta1, la entrada de calcio produce la salida normal de chispas de calcio, pero sale menos K a través del canal por sensado inadecuado del nivel de calcio intracelular, la membrana está más despolarizada y el vaso está más contraído. Al contrario, en presencia de la mutación descrita por Latorre, sale más potasio que en controles normales, la membrana se hiperpolariza y causa vasodilatación.
 Tamaño completo
Tamaño completo Figura 9. Efecto de la entrada de calcio en situación normal y en knock out de beta1.
Clonado y expresión funcional de un canal de K regulado por GMPc
Actualmente se sabe que la L-arginina se convierte en citrulina en el endotelio, donde se une al óxido nítrico (ON), el que, a nivel del músculo liso vascular, llega a GMP cíclico (GMPc) a través de la guanilatociclasa (GCS); el GMPc causa vasodilatación mediante hiperpolarización, al cerrar los canales de calcio, pero este mecanismo está todavía en discusión. Con esta pensamiento en mente, nuestro grupo comenzó a buscar canales de K que tuvieran algún elemento regulado por GMPc, a través del cual el ON y el factor hiperpolarizante derivado del endotelio (EDHF) pudiesen producir hiperpolarización, con la consiguiente reducción de la entrada de calcio y relajación del músculo liso vascular (véase Figura 10).
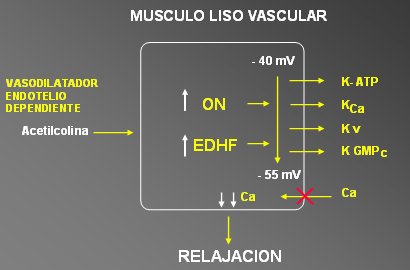 Tamaño completo
Tamaño completo Figura 10. Canales de potasio y regulación del tono vascular.
Así se encontró el canal denominado hKCNA10, cuyo gen tiene aproximadamente 1500 pares de bases en un solo exón y está ubicado en el brazo corto del cromosoma 1, a la altura del 13,1. En los estudios electrofisiológicos se demostraron las siguientes propiedades:
- Al aumentar la corriente se originaba mayor pasaje de K por el canal, el que se hacía más positivo y mostraba gran activación, lo que demuestra que es un canal regulado por voltaje.
- En el rango fisiológico, este canal es mucho más permeable para el K que para el Na (aproximadamente 15 veces más), es decir, es selectivo para el K.
- Al inyectar en oocitos y agregar 8-bromo-GMPc aumentaba mucho la conductancia hacia el K y, al inhibirlo con aminopiridina, esta corriente baja y pasa menos K; por lo tanto, este canal expresa corrientes de potasio y las expresa más cuando es regulado por GMPc.
- Lo interesante es que este canal también es bloqueado por verapamilo y, en condiciones experimentales, se ve que cuando termina la acción del verapamilo, la corriente de K se restaura.
- Este canal se localiza en riñón, sobre todo a nivel del túbulo proximal.
- En la inmunofluorescencia se puede ver que es mucho más importante la señal en la membrana apical que en la basolateral.
En estudios realizados en ratas para demostrar que el anticuerpo es sensible, ya que éste no funcionaba tan bien en tejido humano, se realizó hibridización in situ y se encontró a nivel renal, en el endotelio de los vasos sanguíneos, en el músculo liso vascular y en distintos sitios del glomérulo, así como en el endotelio de grandes vasos y en el músculo liso vascular (J Am Soc Nephrol 13: 2831–2839, 2002).
Como la subunidad alfa no deja pasar tanta corriente de K en condiciones fisiológicas, se utilizó el sistema de doble híbrido para identificar una subunidad beta reguladora de KCNA10 (Tian et al Am J Physiol Renal Physiol, 2002). Así se encontró la denominada KCNA4B, que está localizada en el cromosoma 13 y tiene 16kb, 5 exones y 141 aminoácidos. Tiene similitud estructural con la superfamilia de oxidorreductasas NAD(P)H dependientes y se expresa principalmente en el corazón, músculo esquelético, riñón, intestino delgado y placenta.
Cuando se inyectaba agua o KCNA4B no pasaba casi nada de corriente, pero cuando se inyectaba junto con KCNA4B se producía una gran activación y salida de K. Como este canal de K es regulado por GMPc y éste es uno de los intermediarios por los cuales actúa el óxido nítrico en estos sitios, se planteó la hipótesis de que las alteraciones en este canal producirían alteraciones en el tono vascular.
En el lado apical del riñón hay una serie de canales, como el KCNA10 y otros, el que causa el síndrome del QT prolongado y canales de calcio que participan en la hiperpolarización de la membrana, sobre todo cuando en el lado basolateral se produce salida de K y activación de la bomba. Creemos que este canal, a nivel renal, no tiene relación con la presión arterial; se está tratando de determinar cómo influye en el metabolismo del azúcar y en el funcionamiento de la bomba de co-transporte de Na/glucosa y Na/aminoácidos.
Es probable que este canal tenga influencia en los vasos sanguíneos, arterias y venas. Por este motivo estamos buscando mutaciones en el canal que puedan estar asociadas con algún cuadro hipertensivo.
Hipertensión arterial diastólica predominante
Entre los pacientes hipertensos se destacan dos grupos, por su presión de pulso: los que presentan hipertensión sistólica aislada, cuya presión de pulso es amplia, por ejemplo, 160/88; y los que tienen hipertensión diastólica aislada, cuya presión de pulso está disminuída, por ejemplo, 130/94. Los sisto-diastólicos son habitualmente una mezcla de hipertensos con presión de pulso amplia, normal y disminuída, y constituyen un grupo muy heterogéneo: hay pacientes con 164/92 (predominantemente sistólicos), 140/90 (proporcionados, pulso normal), etc.
Estas categorías son artificiales y responden a nuestra clasificación actual de estadios de hipertensión. Para intentar obtener subgrupos más homogéneos en cuanto a fisiopatología, estudiamos pacientes con presión de pulso disminuida y los denominamos hipertensos esenciales con predominio diastólico (HTA PD), término que abarca a pacientes con hipertensión diastólica aislada y sisto-diastólicos con presión de pulso disminuida, por ejemplo, 130/94 y 140/100.
Analizando los factores que regulan la presión arterial, que es el resultado del gasto cardíaco por la resistencia vascular periférica, era lógico no buscar receptores de vasodilatadores, sino factores que afectaran la vasodilatación y el tono miogénico, entre los cuales los canales de K pueden ser importantes. La hipertensión diastólica siempre ha sido muy discutida y hay muchos trabajos al respecto, pues en un principio se pensaba que no existía verdaderamente, que podía ser sólo un fenómeno auscultatorio, y había mucho escepticismo.
Estudiamos este punto midiendo la presión con otro método distinto del auscultatorio, el MAPA (Monitoreo Ambulatorio de la Presión Arterial), y observamos que, entre los pacientes que por método auscultatorio eran diastólicos aislados o sisto-diastólicos predominantemente diastólicos, sólo cuatro no encajaban en alguna de estas dos categorías; por lo tanto, la mayoría de los pacientes que son hipertensos diastólicos predominantes por método auscultatorio también lo son por MAPA.
Por lo tanto, estamos trabajando con los hipertensos diastólicos predominantes, este grupo incluye pacientes diastólicos aislados, y sisto-diastólicos con presión de pulso disminuida.
Fue difícil fomar el grupo control, porque el hecho de que una persona de cuarenta años sea normotensa no asegura que en dos años más no desarrolle hipertensión, de modo que este grupo quedó conformado por personas normotensas mayores de 65 años y personas más jóvenes, cercanas a los 40 años, que no tuvieran familiares hipertensos (ni padres ni ninguno de los cuatro abuelos). Los parámetros clínicos de ambos grupos se muestran en la Tabla I.
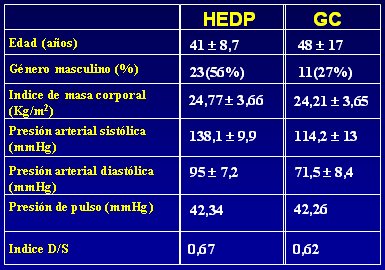 Tamaño completo
Tamaño completo Tabla I. Parámetros clínicos de hipertensos esenciales predominantemente diastólicos (HEDP) y grupo control (GC).
También se determinó la relación con el genotipo ID de la enzima convertidora de angiotensina (ACE), la que tiene dos tipos, con inserción o deleción; muchos estudios han demostrado que los pacientes portadores de II tienen menos ACE en plasma que los individuos DD. Los resultados se muestran en la Tabla II. Si se observa las presiones del grupo control, 114/71, que son bastante más bajas que los grupos control del resto de la literatura, se puede ver que en los pacientes hipertensos predominantemente diastólicos la proporción de DD es mucho mayor que en el grupo control, aunque esto no es significativo, probablemente por el pequeño número de pacientes, pero podría estar ocurriendo un mecanismo distinto y quizás no todos los diastólicos tienen su problema en los canales de K; podrían existir fenotipos que produzcan mayor vasoconstricción y por lo tanto, desarrollen más hipertensión.
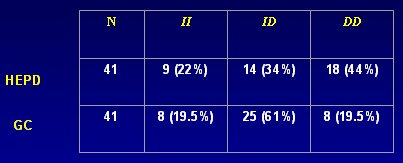 Tamaño completo
Tamaño completo Tabla II. Determinación de genotipo I/D ACE. Test Chi cuadrado: DD vs. ID vs. II (p <0,0301).
Por último, en lo que se refiere a ciencias básicas, estamos estudiando la unión entre KCNA 10 y KCNA4B. Se sabe que ambos se unen por un segmento de 50 aminoácidos en KCNA10. Estamos haciendo constructos con deleciones sucesivas del gen para identificar exactamente el sitio de unión entre ambas subunidades.
También estamos tratando de hacer la co-localización de KCNA10 y KCNA4B en tejidos humanos y en riñón. Queremos demostrar que además de estar estas subunidades en el riñón, están también en la misma célula e incluso, en el mismo lado de la membrana, ya sea apical o basolateral.
Resumen
- Los canales de potasio son fundamentales en la regulación del tono vascular.
- Alteraciones en los canales de potasio Maxi K y KCNA10 pueden tener una participación importante en la hipertensión.

