Consenso
← vista completaPublicado el 1 de enero de 2010 | http://doi.org/10.5867/medwave.2010.01.4328
Revisión de la literatura sobre uso de resonancia magnética mamaria en cáncer de mama
Literature review on use of breast MRI in breast cancer
Contenidos
Introducción
Objetivos Específicos
Metodología y Resultados de la Búsqueda de la Literatura
Síntesis de la Evidencia y Recomendaciones
1. Estudio con Resonancia Mamaria en Mujeres con Alto Riesgo de Cáncer Mamario
1.1 Evaluar la Indicación de Resonancia Mamaria como Screening Suplementario en las Mujeres de Alto Riesgo
1.2 ¿Qué Características en Imágenes Pueden Presentar los Cánceres Mamarios en el Grupo de Alto Riesgo?
2. Evaluar la Utilidad de la Resonancia Mamaria para Monitorizar el Tratamiento con Quimioterapia Neoadyuvante
3. ¿Qué Nueva Información Aporta y Cuál es el Impacto de Agregar la Resonancia Mamaria en el Estudio Preoperatorio de una Paciente con Diagnóstico de Cáncer de Mama?
4. ¿Cuál es el Rendimiento de la Resonancia Mamaria en el Diagnóstico y en la Evaluación de Extensión del Carcinoma Ductal In Situ (CDIS)? Además, Revisar Algunas Consideraciones que se Deben Tener en su Presentación en Imágenes de Resonancia
4.1 Cuál es el Rendimiento de la Resonancia Mamaria en el Diagnóstico y en la Evaluación de Extensión del Carcinoma Ductal In Situ
4.2 Revisar Algunas Consideraciones que se Deben Tener en la Presentación en Imágenes de resonancia del CDIS
5. ¿Cuáles son los Requerimientos Prácticos y Técnicos para Obtener una Resonancia Mamaria de Buena Calidad?
Referencias
Introducción
En este consenso hicimos una revisión de algunas de las indicaciones de resonancia mamaria en las que han surgido nuevas evidencias e incluimos otras que no habían sido tratadas en el consenso del año 2003. Considerando la falta de estandarización de la técnica de resonancia mamaria, agregamos un listado de recomendaciones para obtener un examen de buena calidad.
La resonancia mamaria tiene una sensibilidad muy alta para detección de cáncer y una especificidad menor que depende, como en todas las modalidades de imágenes, de muchos factores como la experiencia del lector, uso de técnicas adecuadas y composición de las cohortes de pacientes. En relación al rendimiento diagnóstico de la resonancia, el metaanálisis de Peters en pacientes con lesiones mamarias referidas para biopsia, que incluyó 44 estudios, mostró una sensibilidad de 0,90 (IC 95%:0,88- 0,92) y una especificidad de 0,72 (IC 95%:0,67-0,77) (Peters 2007).
Las indicaciones de la resonancia que consideramos no era necesario volver a evaluar en este consenso serán brevemente comentadas a continuación:
- Hallazgos no concluyentes en exámenes convencionales: la alta sensibilidad de la resonancia para la detección de cáncer hace que pueda ser útil en algunos casos en que hay dudas con el examen físico o los exámenes convencionales, aunque el estudio con biopsia percutánea sigue siendo la mejor alternativa, debido a que el VPN de la resonancia no es suficiente para reemplazarla (Bluemke, 2004), especialmente en una resonancia negativa con una mamografía con microcalcificaciones, en que se debe tomar la conducta basado en los hallazgos mamográficos.
- Primario desconocido: la presentación de un adenocarcinoma con metástasis en los linfonodos axilares ocurre en un 1% de los cánceres mamarios. Dado lo infrecuente de esta presentación clínica son pocos los estudios de resonancia en esta indicación y con poco número de pacientes. En siete investigaciones publicadas, se reúnen 174 pacientes en las que la resonancia demostró el primario en un 61% de ellas. Al demostrar el primario en la mama se puede planificar el tratamiento más adecuado, de modo que algunas pacientes puedan optar a cirugía conservadora (De Martini, 2008).
- Evaluación de enfermedad residual después de cirugía con bordes positivos: la resonancia puede ser útil al demostrar extensión de la enfermedad lejos del sitio de la tumorectomía, siendo útil para decidir el tipo de cirugía final.
- Sospecha de recurrencia tumoral al examen físico, mamografía o ultrasonido: la resonancia es la técnica más sensible para detectar recidiva local y tiene un alto VPN. Además su especificidad en la mama tratada es más alta que en la no tratada. Actualmente no hay evidencia para recomendar screening con resonancia en pacientes tratadas con cirugía conservadora.
Objetivos Específicos
- Evaluar la indicación de resonancia mamaria como screening suplementario en las mujeres de alto riesgo y qué características en imágenes pueden presentar los cánceres mamarios en este grupo de riesgo.
- Evaluar la utilidad de la resonancia mamaria para monitorizar el tratamiento con quimioterapia neoadyuvante.
- Qué nueva información aporta y cuál es el impacto de agregar la resonancia mamaria en el estudio preoperatorio de una paciente con diagnóstico de cáncer de mama.
- Cuál es el rendimiento de la resonancia mamaria en el diagnóstico y en la evaluación de extensión del carcinoma ductal in situ (CDIS). Además revisar algunas consideraciones que se deben tener en su presentación en imágenes de resonancia.
- Cuáles son los requerimientos prácticos y técnicos para obtener una resonancia mamaria de buena calidad.
Metodología y Resultados de la Búsqueda de la Literatura
Se realizó búsqueda bibliográfica mediante PubMed. Las palabras claves utilizadas fueron MRI or MR and Breast; and chemotherapy; and screening; and DCIS; and staging. También se usaron los trabajos relacionados. Igualmente se recopiló información en el metabuscador Tripdatabase. No se empleó filtros por año de publicación ni idioma. Además se utilizó las referencias de los estudios encontrados.
Resultados:
Introducción: 3 estudios; 1 metaanálisis, 1 estudio prospectivo multicéntrico y 1 revisión narrativa.
- Screening con resonancia en pacientes de alto riesgo: 8 estudios; 2 revisiones sistemáticas, 2 observacionales de pruebas diagnósticas, 2 análisis de costoefectividad (estos finalmente no fueron incluidos en la síntesis por no ajustarse a la realidad chilena), 1 guía clínica, 1 revisión narrativa.
- Resonancia para monitorizar tratamiento con quimioterapia neoadyuvante: 15 estudios; 4 estudio de cohorte (uno de ellos prospectivo, multicéntrico con resultados preliminares), 3 revisiones narrativas, 5 de pruebas diagnósticas y 3 de series de casos.
- Evaluación de extensión de cáncer diagnósticado con resonancia: 13 estudios; 1 estudio prospectivo multicéntrico aleatorio (hasta la fecha aún no se ha publicado el extenso), 2 revisiones sistemáticas, 4 estudios de pruebas diagnósticas prospectivos (3 multicéntricos), 4 de cohorte, 2 de pruebas diagnóstcas retrospectivos.
- Resonancia mamaria en el CDIS: 11 estudios; 3 de pruebas diagnósticas prospectivo (1 de ellos multicéntrico), 3 de pruebas diagnósticas retrospectivos, 1 analítico transversal, 4 series de casos.
- Requerimientos técnicos: 3 revisiones narrativas.
Síntesis de la Evidencia y Recomendaciones
1. Estudio con resonancia mamaria en mujeres con alto riesgo de cáncer mamario
1.1 Evaluar la indicación de resonancia mamaria como screening suplementario en las mujeres de alto riesgo
Síntesis de la evidencia:
En una revisión sistemática que incluye 11 estudios prospectivos no aleatorios en mujeres de alto riesgo, en los que se usó resonancia además de mamografía con o sin ultrasonido y examen físico, los cánceres de intervalo fueron menos de 10% en los estudios con más de una ronda de screening. En los trabajos con más tasa de detección de CDIS, la mayoría de estos fueron detectados por resonancia. Del total de cánceres detectados, más del 50% correspondieron a in situ o menores de 1 cm y sólo 12 a 21% de los tumores infiltrantes tuvieron linfonodos positivos. En los pocos estudios en que existen datos por año de screening, el estadío tumoral fue similar para prevalencia e incidencia. La sensibilidad de la resonancia fue mayor que la de la mamografía en todos los estudios y la especificidad de la resonancia fue menor que la de la mamografía en todos excepto uno (Kuhl). En dos de tres estudios que reportaron especificidades por ronda, ésta fue superior en las rondas subsecuentes. Definiendo positivo sólo a los BI-RADS 4 o 5, la resonancia asociada a mamografía se asoció al mayor OR diagnóstico y asumiendo una probabilidad de enfermedad pretest de 2%, hallazgos negativos en mamografía y resonancia reducen la probabilidad de lesiones biopsiadas sospechosas a 0,3%, mientras que una mamografía sola la reduce a 1,4%.
Resultados combinados:
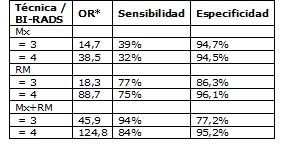 Tamaño completo
Tamaño completo Aunque los 11 estudios usaron un intervalo de 1 año para el screening, puede no ser el ideal para todos los grupos de alto riesgo. Algunas limitaciones de la investigación son las diferencias en la población de pacientes, experiencia del centro y criterios para resultados positivos de screening que resultan en una heterogeneidad entre los estudios incluidos (Warner, 2008).
No existen estudios que entreguen datos de la supervivencia libre de enfermedad o total al agregar resonancia mamaria a la mamografía en el grupo de alto riesgo, pero se asume que al detectar más cánceres con linfonodos negativos, reduciría la mortalidad por cáncer de mama (Warner, 2008; Berg, 2009).
La ASCO y la Guía Clínica Europea de panel de expertos acerca de screening con resonancia como complemento de mamografía (Saslow, 2007) hacen las siguientes recomendaciones:
1) Resonancia anual, basada en evidencia derivada de ensayos de screening no aleatorios y estudios observacionales:
- Mutaciones BRCA
- Pariente de primer grado con BRCA, no examinada o estudiada
- Riesgo en la vida > o = 20-25% según BRCAPRO u otro modelo basado fuertemente en historia familiar
2) Resonancia anual, basada en opinión de consenso de expertos, a partir del riesgo estimado de desarrollar cáncer a lo largo de la vida en cada grupo:
- Radiación torácica entre los 10 y 30 años de edad
- Síndrome Li-Fraumeni y sus familiares de primer grado
- Síndromes de Cowden y Bannayan-Riley-Ruvalcaba y sus parientes de primer grado
3) Evidencia insuficiente a favor o en contra de resonancia como screening (recomienda decisiones caso a caso):
- Riesgo en la vida 15-20% según BRCAPRO u otro modelo basado fuertemente en historia familiar
- Carcinoma lobulillar in situ o hiperplasia lobulillar atípica
- Hiperplasia ductal atípica
- Mamas heterogéneas o extremadamente densas en mamografía
- Mujeres con antecedente personal de cáncer, incluyendo carcinoma ductal in situ
4) Recomendación en contra de resonancia como screening, basada en opinión de consenso de expertos:
- Mujeres con riesgo en la vida <15%
Nivel de evidencia: I
Recomendación:
- En las pacientes de alto riesgo con predisposición genética o fuerte historia familiar se recomienda screening con resonancia mamaria junto con la mamografía en forma anual. También se recomienda en pacientes con antecedente de radioterapia torácica y algunos síndromes neoplásicos hereditarios.
1.2 ¿Qué características en imágenes pueden presentar los cánceres mamarios en el grupo de alto riesgo?
Síntesis de la evidencia:
En un estudio de serie de casos en pacientes con cáncer e historia familiar, seleccionadas a partir de un estudio de cohorte prospectivo, se encontró que los fenotipos de imágenes difieren entre las categorías de riesgo. Del total de cánceres invasores, un 20% aparecieron como impregnación del tipo no masa y un 33% tuvo características cinéticas benignas. Un 23% de los cánceres invasores se presentaron como masas bien delimitadas, sin calcificaciones, como frecuentemente se ve en los fibroadenomas, pero sin los signos típicos de realce de estos. Las portadoras de mutación BRCA1 exhibieron el 80% de estas lesiones con morfología benigna y ninguno de sus cánceres presentó microcalcificaciones ni fue CDIS. En cambio, los cánceres de las portadoras de mutación BRCA2 y mujeres en riesgo moderado, presentaron características similares a los cánceres esporádicos. Con respecto a la ubicación, un 67% de los cánceres en mujeres de alto riesgo y con mutaciones se encontraron en localización posterior, inmediatamente prepectorales (p<0,009) (Schrading, 2008).
Otro estudio, retrospectivo, para evaluación del aspecto en mamografía y resonancia de lesiones malignas en pacientes portadoras de mutación BRCA1 y 2, encuentra diferencias significativas como mayor índice de actividad mitótica y tumores más redondeados y bien definidos en comparación con los cánceres esporádicos; además, en resonancia presentan más frecuentemente realce en anillo. No hubo diferencias significativas en la cinética de impregnación (Veltman, 2008).
Recomendaciones:
- En las pacientes con mutación BRCA, considerar fenotipos de imágenes diferentes a las habituales, ya que presentan más frecuentemente cánceres con patrones morfológicos redondeados y bien delimitados.
2. Evaluar la utilidad de la resonancia mamaria para monitorizar el tratamiento con quimioterapia neoadyuvante
Síntesis de la evidencia:
La quimioterapia neoadyuvante en cáncer de mama, previo al tratamiento quirúrgico, se indica principalmente en tumores no resecables a fin de reducir su tamaño y permitir la resección.
La resonancia se puede utilizar durante el tratamiento para la evaluación temprana de la respuesta tumoral, demostrando ser superior al examen clínico, mamografía y ultrasonido. Algunos de los parámetros usados son los cambios morfológicos bajo el tratamiento, habiéndose identificado dos tipos de disminución de tamaño del tumor en las imágenes de resonancia: una concéntrica en los tumores nodulares que tienden a encogerse más que a fragmentarse, seleccionando buenas candidatas para cirugía conservadora; y una dendrítica que se ve en los tumores espiculados e irregulares, los que tienden a fragmentarse más que a encogerse indicando un alto riesgo de márgenes positivos posterior a la tumorectomía (Thibault, 2004).
Otro parámetro que se puede evaluar durante el tratamiento es la reducción en el volumen tumoral. Los hallazgos preliminares del ACRIN 6657, ensayo clínico prospectivo y multicéntrico con exámenes normalizados de resonancia tanto para la adquisición de datos y la cuantificación del marcador, sugieren que el cambio inicial en el volumen tumoral, medido después del primer ciclo de quimioterapia, fue la única variable predictiva de respuesta patológica completa (Hylton, 2008).
Hay algunos estudios que han relacionado los cambios cinéticos a la respuesta tumoral. La disminución del realce precozmente, después del primer ciclo, es significativamente mayor en los tumores con regresión histológica (Wasser, 2003). Entre las alteraciones de la curva cinética inducidas por la quimioterapia se describe disminución de la intensidad del realce, retardo del peak de realce y aplanamiento de la curva (Londero, 2004; Rieber, 2002; El Khoury, 2005). Esto se explica por las alteraciones en la angiogénesis inducida por el tratamiento que hacen que en los respondedores el tumor progresivamente disminuya su realce en las imágenes dinámicas de la resonancia.
Existen algunos estudios de cohorte que relacionan niveles de perfusión y permeabilidad vascular de los tumores pretratamiento y supervivencia libre de enfermedad (Pickles, 2008) o cambio en el volumen tumoral precoz medido en resonancia bajo el tratamiento y supervivencia libre de enfermedad (Ka-Loh Li, 2008). El ACRIN 6657 continúa el seguimiento de sus pacientes para estratificar grupos de riesgo por resonancia, acorde a supervivencia libre de enfermedad a los 3 años.
Otras técnicas como la resonancia con espectroscopía e imágenes de difusión se muestran promisorias en la evaluación precoz de respuesta tumoral; sin embargo, aún no hay estudios prospectivos que permitan recomendarlas en la práctica clínica (Tardivon, 2006; Kuroki, 2008).
En relación a la cuantificación de la respuesta tumoral una vez finalizada la quimioterapia neoadyuvante, la mayoría de los autores encuentran una excelente correlación entre la histología y la resonancia para evaluar tamaño tumoral postquimioterapia, superior a los métodos convencionales con coeficientes de correlación que van desde 0,75 a 0,89 (Patridge, 2002; Rosen, 2003; Tardivon, 2006; Yeh, 2005; Rieber, 2002; Londero, 2004; Hylton, 2008). Los resultados preliminares del ACRIN 6657 muestran que entre las mediciones del tamaño del tumor residual, el volumen tumoral en resonancia fue el que se correlacionó mejor con el tamaño patológico, en comparación al diámetro mayor en resonancia y al examen físico.
Sin embargo, la resonancia puede subestimar la enfermedad residual postquimioterapia, no siendo capaz de detectar pequeños focos tumorales. Esto ocurre más frecuentemente en la presentación multifocal o difusa inicial y en la disminución de tamaño en forma fragmentada. Los cambios cinéticos inducidos por la quimioterapia explican los resultados falsos negativos de la resonancia, ya que la enfermedad residual mínima no puede ser distinguida del realce de fondo del tejido fibroglandular normal (Yeh, 2005; Rieber, 2002; Tardivon, 2006).
Nivel de evidencia: II
Recomendaciones:
- Realizar resonancia mamaria antes de comenzar la quimioterapia y una vez terminada, para evaluar la respuesta al tratamiento, idealmente midiendo el volumen tumoral.
- Para predecir precozmente la respuesta al tratamiento se recomienda agregar una resonancia mamaria después del primer ciclo de quimioterapia, evaluando volumen tumoral y cambios cinéticos. Es útil diferenciar el tipo de disminución de tamaño del tumor con el tratamiento, concéntrico o fragmentado, debido a que ayuda a seleccionar el tipo de cirugía.
- Una resolución completa en resonancia no significa una respuesta patológica completa, por lo que en estas pacientes la resección del lecho tumoral sigue siendo esencial en el tratamiento. La subestimación de la enfermedad residual es más frecuente en la presentación multifocal o difusa inicial y en la disminución de tamaño tumoral en forma fragmentada. La quimioterapia provoca cambios en la cinética del tumor, por lo que cualquier realce tardío y de baja intensidad en el sitio del tumor inicial debe ser considerado como posible tumor residual.
3. ¿Qué nueva información aporta y cuál es el impacto de agregar la resonancia mamaria en el estudio preoperatorio de una paciente con diagnóstico de cáncer de mama?
Síntesis de la evidencia:
Una revisión sistemática y metaanálisis de 19 estudios que evalúan la resonancia para la detección de multifocalidad y multicentricidad no visible en exámenes convencionales, muestra que la resonancia detecta más cáncer en 16% de las pacientes (N=2610). Varía su exactitud diagnóstica dependiendo del estándar de referencia utilizado, disminuyendo de 99% a 86% a medida que la calidad del estándar aumenta. El VPP fue de 66% y VP/FP, 1,91. En relación al porcentaje de cambio en el manejo quirúrgico secundario a los hallazgos de la resonancia, los estudios variaron entre un 7,8% a 33,3%; el metaanálisis muestra que la conversión de cirugía conservadora a mastectomía fue de 8,1% (IC 95% 5,9 a 11,3) y a cirugía mayor en general (escisión más amplia, adicional o mastectomía) en un 11,3% (IC 95% 6,8 a 18,3). La conversión a mastectomía por falsos positivos de la resonancia ocurrió en un 1,1% (IC 95% 0,3 a 3,6) y a cirugía más extensa en 5,5% (IC 95% 3,1 a 9,5) (Houssami, 2008).
El estudio prospectivo multicéntrico de Schnall efectuado en 426 mujeres con cáncer demostró que las lesiones multifocales y multicéntricas incidentales detectadas sólo por resonancia fueron similares en tamaño e histología a las detectadas por mamografía (Schnall, 2005).
Algunas investigaciones indican que la resonancia mamaria prequirúrgica es de mayor utilidad en algunos subgrupos, como es el caso de la histología del carcinoma lobulillar infiltrante. En una revisión sistemática, que incluyó 18 estudios, con un número de 450 pacientes, se demostró que los carcinomas lobulillares presentaron con mayor frecuencia multifocalidad y multicéntricidad (32% focos adicionales) y presentaron más a menudo cánceres contralaterales, aproximadamente en un 7% de las pacientes. La resonancia cambió la conducta quirúrgica en un 28,3% del total de los casos (IC 95%: 20 a 39), siendo esta correcta en un 88% de las veces (IC 95%: 75 a 95) basándose en la anatomía-patológica (Mann, enero 2008).
En cuanto a la sensibilidad de la resonancia para detección de multifocalidad y multicentricidad en relación al patrón mamario mamográfico, hay un trabajo multicéntrico y prospectivo que muestra que la detección de cáncer en los subgrupos de mamas con patrón de densidades dispersas, heterogéneamente densas y extremadamente densas, fue significativamente mayor en comparación con la de la mamografía (81% versus 60%) lo que no sucedió en los patrones adiposos (Sardanelli, 2004). Sin embargo, hay otro estudio retrospectivo que no mostró diferencia significativa en el cambio del manejo quirúrgico, al separar por tipo de patrón mamario (Braun, 2008).
Otra característica tumoral que se asocia a un mayor efecto de la resonancia en el manejo clínico, es el tamaño. En el trabajo retrospectivo de Tillman la resonancia cambió el manejo quirúrgico con mayor frecuencia en las lesiones en estadío T2 y T3 (p=0,0089) (Tillman, 2002).
Hay otro estudio prospectivo de pruebas diagnósticas para identificar subgrupos en que la resonancia pudiese tener mayor valor con respecto a las técnicas convencionales en la evaluación de la extensión tumoral antes de la cirugía conservadora, los que resultaron ser: las pacientes menores de 58 años, tumores con márgenes irregulares en mamografía y discrepancia en el tamaño tumoral entre mamografía y ultrasonido de más de 10 mm (Deurloo, 2006).
En la evaluación del componente intraductal extenso, hay dos trabajos que evalúan la capacidad diagnóstica de la resonancia, con sensibilidades de 50% a 71%, superiores a la de los exámenes convencionales (Van Goethem, 2007; Ikeda, 2004).
Los cánceres contralaterales sincrónicos son ocultos a la mamografía en un 75% de las veces. Sin resonancia preoperatoria, estas lesiones probablemente se presenten como cánceres contralaterales metacrónicos. El ACRIN 6667, estudio prospectivo y multicéntrico de pruebas diagnósticas, incluyó 969 mujeres con cáncer de mama unilateral recientemente diagnosticado y sin anormalidades en la mama contralateral al examen físico y mamografía, a las que se les realizó resonancia para evaluar la presencia de cáncer contralateral, la que detectó 30 cánceres contralaterales en las 969 pacientes (3,1%) durante un seguimiento de 12 meses. La sensibilidad de la resonancia en la mama contralateral fue de 91% y la especificidad 88%, el VPN fue de 99% y el VPP fue de 21%. El área bajo la curva ROC para resonancia para toda la cohorte fue de 0,94±0,02. El promedio del diámetro de los tumores encontrados fue de 10,9 mm, estando el 96,7% de los tumores en etapa 0 o 1. El número adicional de cánceres encontrados no fue influenciado por la densidad mamaria, estado menopáusico ni características histológicas de los tumores primarios (Lehman, 2007). En otro estudio observacional retrospectivo el diagnóstico de cáncer en la mama contralateral durante 40 meses de seguimiento, entre las pacientes con y sin resonancia en el momento del estudio de su cáncer inicial, fue de 1,7% y 4% respectivamente (Fisher, 2004).
Sin embargo, no hay evidencia que muestre que la resonancia contribuye a un mejor control de la enfermedad o supervivencia. Hay 3 estudios retrospectivos que tuvieron como objetivo investigar si la introducción de la resonancia en el estudio preoperatorio obtenía mejores resultados. En el estudio de Fisher la recurrencia en el grupo con resonancia fue significativamente menor, comparada con el grupo sin resonancia, (1,2% versus 6,8%, p<0,001) pero en este trabajo hay diferencias entre los dos grupos evaluados en cuanto al tamaño tumoral y compromiso de linfonodos, teniendo el grupo sin resonancia un estadío más avanzado, lo que resta confiabilidad a los resultados (Fisher, 2004). En el estudio de Pengel la resonancia no cambió significativamente la tasa total de escisión incompleta (Pengel, 2008). En el trabajo de Solin no hubo diferencias significativas entre los grupos con y sin resonancia en falla local, supervivencia total ni causa específica, como tampoco en la enfermedad libre de metástasis ni cáncer contralateral (Solin, 2008).
El COMICE es el único estudio prospectivo, multicéntrico y aleatorio, diseñado para evaluar si la adición de resonancia prequirúrgica disminuye las tasas de reoperación y la conversión a mastectomía después de cirugía conservadora en comparación con la triple evaluación convencional (mamografía, ultrasonido y biopsia). Sus resultados muestran que no hubo reducción en la tasa de reoperación al agregar resonancia. Llama la atención el bajo porcentaje de detección de enfermedad adicional maligna detectado por la resonancia en este estudio (6,1% vs. 16% en revisión sistemática de Houssami) y una representación menor de lo habitual del carcinoma lobulillar infiltrante (Turnbull, 2008 sesión oral en el Simposio de San Antonio, diciembre de 2008).
Nivel de evidencia: I
Recomendaciones:
- La resonancia mamaria puede ser utilizada para la evaluación del tamaño tumoral previo a la cirugía debido a que permite detectar multifocalidad y multicentricidad mejor que los exámenes convencionales, cambiando el manejo quirúrgico en un importante número de pacientes. Además sirve para descartar cáncer contralateral con un muy alto VPN. Sin embargo, no hay evidencia que muestre que mejore el resultado en cuanto a falla local ni supervivencia.
- Considerar que la resonancia mamaria tiene mayor utilidad en el carcinoma lobulillar infiltrante y podría tenerla en otros subgrupos como las pacientes jóvenes, en los tumores mayores de 2 cm, en las mamas densas, tumores con márgenes irregulares en mamografía, discrepancia de tamaño entre los exámenes convencionales y sospecha de carcinoma intraductal extenso.
- Considerando los falsos positivos, un cambio de conducta quirúrgica surgido de los hallazgos de la resonancia debe ser previamente confirmado con biopsia, especialmente cuando se quiere cambiar de cirugía conservadora a mastectomía.
- El valor de agregar la resonancia debe ser evaluado por el médico y la paciente, considerando los beneficios clínicos demostrados y los no demostrados; la posibilidad de falsos positivos; el costo y la disponibilidad.
4. ¿¿Cuál es el rendimiento de la resonancia mamaria en el diagnóstico y en la evaluación de extensión del carcinoma ductal in situ (CDIS)? Además, revisar algunas consideraciones que se deben tener en su presentación en imágenes de resonancia
4.1 Cuál es el Rendimiento de la Resonancia Mamaria en el Diagnóstico y en la Evaluación de Extensión del Carcinoma Ductal In Situ
Síntesis de la evidencia:
Si bien los CDIS se detectan en su gran mayoría a través de la mamografía de screening, los estudios muestran que la resonancia mamaria y la mamografía son exámenes complementarios para su diagnóstico, manifestándose algunos sólo como microcalcificaciones en la mamografía y otros sólo como realces con el contraste en la resonancia.
Existen trabajos prospectivos para evaluar el rendimiento de la resonancia en la detección de cáncer en las pacientes con microcalcificaciones en mamografía, los que muestran una sensibilidad cercana al 80% (Bazzocchi, 2006; Kneeshaw, 2006).
Por otra parte el estudio observacional prospectivo de Kuhl, demostró que la sensibilidad total de la resonancia para CDIS es sustancialmente mayor que la de la mamografía, especialmente en el CDIS de alto grado, que es el que más probablemente evolucionará a cáncer infiltrante. Se incluyó 7319 mujeres, de las cuales más de la mitad tenían un riesgo de cáncer promedio. A todas se les realizó mamografía y resonancia, leídas en forma independiente, resultando un 15% con hallazgos clasificados como BI-RADS 4 o 5; diagnosticándose finalmente 167 pacientes con CDIS puros, sin diferencia en los perfiles demográficos ni de riesgo entre el grupo detectado por mamografía o por resonancia. La sensibilidad de la mamografía fue significativamente menor, de 56% versus 92% de la resonancia (p<0,0001), con un 44% de falsos negativos en mamografía y un 8% en resonancia (p<0,0001). Además, en el mismo estudio se encontró que la mamografía tiende a identificar CDIS con un perfil biológico comparativamente más benigno, correspondiendo el 83% de sus hallazgos a lesiones de grado bajo e intermedio. La resonancia en cambio, detectó el 98% de las lesiones de alto grado (p<0,0001), la mitad de estas no visibles por mamografía. El VPP fue 55% para la mamografía y 59% para la resonancia (Kuhl, 2007).
En la evaluación de la extensión del CDIS, encontramos estudios de pruebas diagnósticas y series de casos retrospectivas, que muestran que la resonancia es superior a los exámenes convencionales en la estimación del tamaño del CDIS y detecta más casos de multifocalidad. Al demostrar mejor la extensión tumoral, la resonancia puede cambiar el manejo quirúrgico correctamente en 15% a 19% de las pacientes (Menell, 2005; Hwang, 2003; Chung, 2005; Neira, 2009). Sin embargo, es necesario considerar que varios estudios han mostrado una tendencia a la sobrestimación del tamaño del CDIS con la resonancia (Bazzocchi, 2006; Kumar, 2006; Neira, 2009). En el estudio retrospectivo de Kumar se encontró que la sobrestimación ocurrió predominantemente en lesiones con receptores de estrógenos positivos y de bajo grado. La mayoría de éstas se caracterizó por tener una distribución regional o multiregional y realce heterogéneo en resonancia (p<0,05). Una explicación a esto es la dificultad que presentan los CDIS multifocales para medirlos en el estudio anátomo-patológico. Los procesos benignos que rodeaban a las lesiones y que también explican la sobrestimación del tamaño tumoral, fueron en un 90% lesiones proliferativas de grado intermedio o alto de Hartmann, lo que puede reflejar la presencia de un continuo de cambios proliferativos en los CDIS del tipo no comedo.
Para el estudio de CDIS residual e invasión oculta, encontramos un solo trabajo retrospectivo de 190 pacientes (Hwang, 2003). En éste la sensibilidad y VPN para la detección de CDIS residual e invasión oculta fueron mayores para la resonancia en comparación con la mamografía. En especial la sensibilidad de la resonancia para la detección de enfermedad residual fue de 96% por lo que, con una muy alta probabilidad, en las pacientes con márgenes positivos y una resonancia negativa para carcinoma residual, una pequeña reescisión de los bordes puede ser suficiente para el tratamiento quirúrgico definitivo. Para el diagnóstico de invasión oculta, los VPP no fueron significativamente diferentes entre la resonancia y la mamografía, siendo en ambos casos bajos (43 y 50%, respectivamente).
Nivel de evidencia: II
Recomendaciones:
- Considerar la mamografía y la resonancia como complementarias para el diagnóstico de CDIS, teniendo presente que identifican CDIS con perfiles biológicos diferentes y que la sensibilidad de la resonancia es mayor que la de la mamografía. Como se analizó previamente, la resonancia mamaria como método de screening está indicada en las mujeres de alto riesgo, pero no hay evidencia que apoye su uso en la población con riesgo normal.
- Considerar el uso de la resonancia para la evaluación de extensión del CDIS, debido a que puede cambiar el manejo quirúrgico a una mejor opción en un considerable número de pacientes. Es necesario tener presente la posibilidad de sobrestimación, especialmente en los casos de CDIS con impregnación de distribución regional o multiregional y realce heterogéneo. La posibilidad de invasión, se debe sospechar principalmente en base al tamaño tumoral, ya que el VPP para diagnosticar invasión oculta, es bajo en mamografía y resonancia.
4.2 Revisar Algunas Consideraciones que se Deben Tener en la Presentación en Imágenes de Resonancia del CDIS
Síntesis de la evidencia:
En varios estudios se describe la presentación, no infrecuente, del CDIS como impregnación asimétrica del tipo no masa (Kumar, 2006; Groves, 2005; Neira, 2009; Esserman, 2006). La resonancia detecta el realce con el contraste de los CDIS debido a que presentan neovascularización; sin embargo, estos vasos son más maduros que en los carcinomas infiltrantes. Por esto los patrones típicos de lavado del estudio cinético, que indican malignidad, están a menudo ausentes. En los CDIS de alto grado la densidad de los microvasos es alta y como consecuencia el realce es más fuerte, por lo que son más fácilmente detectados en resonancia que los de bajo grado.
Otra investigación de tipo analítico transversal, muestra que la impregnación ductal ramificada es altamente específica para carcinoma in situ (p=0,03), mientras que la impregnación en anillo es un signo altamente específico para carcinoma invasor (p=0,07) (Groves, 2005).
Recomendaciones:
- En la interpretación de la resonancia se debe tener en cuenta que la presentación de los CDIS puede ser diferente a la de los carcinomas infiltrantes, ya que muchas veces tienen patrones de impregnación de tipo no masa, asimétricos y sin curva de lavado.
5. ¿Cuáles son los requerimientos prácticos y técnicos para obtener una resonancia mamaria de buena calidad?
A continuación se entrega un resumen de consideraciones prácticas, técnicas y clínicas para obtener una resonancia mamaria de buena calidad:
1. Instrucciones y posicionamiento del paciente:
- Indicar a la paciente que debe mantenerse inmóvil durante el examen.
- En el posicionamiento se deben hacer esfuerzos para que la paciente esté cómoda. Habitualmente los brazos se colocan hacia arriba y la cabeza debe estar apoyada en un apoya-cabeza.
- Antes de comenzar el examen se debe chequear la posición de las mamas. Los pezones deben quedar orientados hacia abajo, en lo posible simétricos.
2. Hardware: Magnetos y bobina
Se debe evitar un equipo con un campo magnético menor de 1,5T. Un campo de 3T puede ser utilizado, sin embargo, aún no hay evidencia de aumento en el valor clínico.
Se debe utilizar una bobina de superficie dedicada a mama. Se sugiere una suave compresión, sólo para sostener las mamas.
Hacer series de localización en planos axial, coronal y sagital en mama derecha e izquierda para conocer y seleccionar la extensión del tejido fibroglandular.
3. Elección del plano de imagen:
Se recomienda adquirir las imágenes en plano sagital o axial.
- Plano Sagital:
Ventajas: FOV relativamente pequeño permite mejor resolución espacial. Al reducir el FOV en dirección cráneo caudal (FOV rectangular) se logra también mejor resolución temporal. Se logra un campo homogéneo, lo que favorece la supresión grasa.
Desventaja: se requieren demasiados cortes para cubrir ambas mamas. Por esto se utilizan casi exclusivamente para imágenes unilaterales.
Si se utiliza para evaluación bilateral, será a expensas de relación señal/ruido y/o resolución témporo-espacial.
- Plano axial versus coronal:
Estos planos habitualmente se usan para la resonancia bilateral.
Se recomienda plano axial porque sufre menos artefactos por movimientos respiratorios y de flujo y se puede evaluar mejor la zona del pezón e invasión de la pared torácica.
4. Imagen unilateral o bilateral:
Se sugiere evaluación bilateral, con el objetivo de aprovechar la inyección del contraste y evaluar la mama contralateral (además, al igual que en la mamografía bilateral, ayuda a evitar errores al poder comparar con la mama contralateral y evaluar simetría).
5. Secuencias:
- T2 FSE no contrastada.
- T1 para adquisición dinámica con una secuencia obtenida precontraste y después del bolo de contraste intravenoso inyectado rápidamente con varias adquisiciones repetidas entre 5 y 7 minutos. Las secuencias pueden ser 3D o 2D.
Las secuencias 3D permiten cortes más finos pero las 2D tienen la ventaja de sufrir menos artefactos de movimientos y pulsaciones. Ambas se pueden hacer con o sin supresión grasa.
Todas las secuencias de pulso deben utilizar el tiempo de repetición más corto posible, un flip angle grande (usualmente 90º para 2D y 25º-50º para 3D GRE) y un tiempo de eco corto, en fase (4,6 mseg en 1,5T) para protocolos sin saturación grasa.
Seleccionar una dirección de fase diferente a anterior-posterior para minimizar artefactos de movimiento del corazón y movimientos respiratorios. Para imágenes axiales se sugiere dirección izquierda-derecha. Para imágenes coronales y sagitales se sugiere dirección superior-inferior.
6. Material de contraste:
Es necesario poner catéter endovenoso antes de posicionar a la paciente, con una vía larga.
La dosis óptima del contraste (gadolinio) es entre 0,1-0,2 mmol/kg (frecuentemente 0,1 mmol/kg). Se debe inyectar por vía en vena antecubital, idealmente con inyectora a una velocidad de 3ml/seg, seguido de 20 ml de suero salino.
7. Resolución temporal:
Las imágenes deben obtenerse entre 60 y 120 segundos postinyección de contraste. Realizar adquisiciones dinámicas, adquiriendo las mismas imágenes antes y varias veces después (4 ó 5) de administrar el contraste, entre 5 y 7 minutos.
8. Resolución espacial:
Se debe usar la mayor matriz que sea posible de lograr en un tiempo de obtención del examen dinámico de 60-120 segundos.
Para obtener una adecuada resolución espacial, el tamaño del voxel debería ser menor de 2,5 mm en cualquier dirección y la resolución en plano de al menos 1 mm.
Las adquisiciones deben tener un grosor de corte fino (3 mm o menos).
9. Supresión grasa:
Se debe obtener una supresión grasa homogénea. Esta puede hacerse con sustracción o supresión directa (saturación).
- Sustracción:
No requiere tiempo extra de adquisición ni está influenciada por inhomogeneidades del campo magnético. Es preferida para evaluación bilateral.
Su desventaja es que puede haber errores de sustracción secundarios a movimiento, por lo que se recomienda leve grado de inmovilización.
- Saturación:
Toma tiempo extra de adquisición, lo que puede dificultar los protocolos dinámicos.
Requiere un campo magnético muy homogéneo a través de todo el FOV, lo que es difícil de lograr en estudios bilaterales.
Usualmente se utiliza en evaluaciones unilaterales con FOV pequeños, en plano sagital.
Si se hace sustracción no es necesario hacer saturación grasa.
10. Análisis cinético:
Dado que el peak del realce en el cáncer de mama ocurre dentro de los primeros dos minutos después de la inyección del contraste, los tiempos de adquisición deben ser entre 60 y 120 segundos. Esto permite además ver el comportamiento del realce en el tiempo y detalles morfológicos.
La secuencia dinámica necesita de al menos tres mediciones, una antes y dos después del contraste.
Se puede evaluar visualmente, poniendo una región de interés (ROI) para obtener curvas cinéticas y se puede utilizar un sistema de diseño asistido por computador (CAD).
El ROI debe ponerse en el área de mayor intensidad en la primera imagen postcontraste y no debe incluir más de 3-4 pixeles, teniendo cuidado de que se encuentre dentro de la lesión durante la serie completa. Además se puede realizar un análisis visual de las imágenes no sustraídas para obtener una impresión del patrón de realce de toda la lesión.
Para cuantificar el realce se puede relacionar el aumento de intensidad de señal en relación a la intensidad basal precontraste.
11. Presentación de la imagen e interpretación:
Se puede obtener reconstrucciones multiplanares (MPR) de las imágenes iniciales postcontraste sustraídas de los datos 3D. También proyecciones de máxima intensidad (MIP) para visualizar áreas de mayor intensidad en un volumen.
Se pueden utilizar softwares suplementarios para obtener un mapa angiogénico y curvas de impregnación dinámica.
Las imágenes idealmente pueden visualizarse en un sistema PACS en estación de trabajo para optimizar la ventana y comparar con exámenes de mama previos.
12. Prerrequisitos clínicos:
Es necesario que el tecnólogo haga una breve anamnesis antes de comenzar el examen y descarte contraindicaciones, al igual que en cualquier tipo de resonancia.
Un radiólogo debe asumir el rol de “portero”, teniendo la responsabilidad de visar cada resonancia de mama. Debe estar entrenado en mamografía y ecografía mamaria, ya que habitualmente se usa asociada a estos exámenes convencionales y debe tener experiencia en resonancia mamaria. Para la interpretación se debe considerar la información morfológica y cinética y usar léxico BI-RADS de la ACR en el informe.
Debe educar a los demás médicos en las indicaciones de la resonancia y asegurarse que el examen está siendo tomado, en lo posible, entre los días 7 y 14 del ciclo menstrual en las mujeres premenopáusicas.
Puede ser necesario complementar la resonancia con una ecografía dirigida, considerando que un número importante de lesiones pueden ser visibles al ultrasonido, guiados por los hallazgos de resonancia.
Es necesario contar con sistema de localización y biopsia guiada bajo resonancia o cooperación de un centro que disponga de éste, correlacionando los resultados posteriormente (Raush, 2006; Mann, 2008; Kuhl, 2007).
Recomendaciones:
- Se recomienda considerar los requerimientos prácticos, técnicos y clínicos antes mencionados para lograr una mayor estandarización de la resonancia mamaria y obtener un examen con alta resolución espacial y temporal, de modo de optimizar su rendimiento diagnóstico.
Notas y agradecimientos
Este artículo fue redactado en su versión final después de haber recibido las contribuciones y comentarios de los delegados que asistieron a la III Jornada Nacional de Diagnóstico y Tratamiento de Cáncer de Mama, realizada en Coquimbo, Chile, en agosto de 2009. A su vez, las ponencias que se presentaron en esa jornada fueron la síntesis del artículo completo de revisión de la literatura y trabajo previo de la comisión correspondiente. Este trabajo de formulación duró un año, comenzó en junio de 2008 y se llevó a cabo bajo la asesoría de Medwave Estudios Ltda., en el marco del proyecto denominado “Asesoría en la Formulación de Consenso y Recomendaciones en Cáncer de Mama Basados en la Evidencia”. El financiamiento para la ejecución de la asesoría provino de la Sociedad Chilena de Mastología.
La coordinación de la asesoría fue realizada por Vivienne Bachelet; el metodólogo jefe fue Miguel Araujo; y la metodóloga adjunta fue Gabriela Moreno. Colaboró en la sistematización bibliográfica y en el formato final de los documentos, Matías Goyenechea. El artículo definitivo es el resultado del trabajo final presentado a las jornadas de consenso, donde fue conocido, revisado y discutido por los concurrentes, y luego fue revisado por un comité editorial de pares constituido por la misma Sociedad Chilena de Mastología, tras lo cual fue enviado a Medwave para su publicación.

