Congresos
← vista completaPublicado el 1 de junio de 2007 | http://doi.org/10.5867/medwave.2007.05.1036
Reemplazo renal en insuficiencia renal aguda. ¿A quién, cuándo y cómo?
Renal replacement in acute renal failure: Who, when and how?
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por las Sociedades Chilenas de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores.
Introducción
Hay muchos aspectos que analizar en el tratamiento de la insuficiencia renal aguda (IRA), entre ellos: las razones biológicas e iniciación de la terapia; la aproximación al paciente y técnicas a emplear; los objetivos clínicos y medidas de supervivencia; la evidencia clínica; la adecuación, dosis y sobrevida; la tecnología y logística; los nuevos paradigmas y los estudios futuros.
Existe la creencia de que la mortalidad por IRA no ha cambiado con los años y que los pacientes mueren con falla renal aguda y no por falla renal aguda, lo que desde luego es falso. Se ha demostrado que los pacientes con IRA que están en unidades de cuidados intensivos tienen mayor mortalidad que los pacientes con IRA aislada (Star, Kidney Int 1998; 54:1817-31) y que mientras más órganos presenten insuficiencia, mayor es la mortalidad. Por otra parte, existe un problema de puntaje clínico y de definición de la IRA; por ejemplo, en la base de datos de Vicenza figuran 48 casos de IRA entre 1974 y 1979, de los cuales 15% se trataron en una UCI y los demás, en el Departamento de Nefrología, mientras que entre 1995 y 2000 se registraron 475 enfermos en la misma base de datos, de los cuales sólo 8% se trataron en Nefrología y los demás estuvieron en la UCI; sin embargo, la mortalidad de los pacientes con IRA fue similar en ambos períodos (alrededor de 53%). En un estudio de Metnitz en que se hizo el ajuste según el compromiso de otros órganos y la edad del paciente, el autor concluyó que la mortalidad era más alta en los pacientes que necesitaban terapia de reemplazo renal (Metnitz, Crit Care Med 2002; 30:2051-8).
Por tanto, la mortalidad por IRA ha cambiado con el transcurso de los años, así como su etiología y patrones clínicos. Hoy está claro que los pacientes mueren por IRA, que es un factor de riesgo independiente de la edad y la gravedad, de modo que se deben tomar medidas para evitar la falla renal y la terapia de reemplazo renal se debe optimizar para disminuir las consecuencias de la uremia. La situación clínica de los pacientes con IRA es diferente a la de los que tienen insuficiencia renal crónica, ya que la IRA, por lo general, es una complicación de otras patologías, de modo que lo más frecuente es que el paciente esté con soporte farmacológico, ventilación mecánica, inestable, inconsciente, séptico y en insuficiencia orgánica múltiple, de modo que se necesita una terapia adecuada para tal situación clínica.
Los requisitos generales para la terapia de reemplazo en estos enfermos son los siguientes: inicio rápido y de fácil monitorización; mínima carga de trabajo; purificación sanguínea eficiente; buena tolerancia clínica; control estricto de líquidos, electrolitos y equilibrio ácido-básico; posibilidad de hiperalimentación e infusión de líquidos; predicción de la depuración para ajustar las dosis de fármacos y que exista una biocompatibilidad que asegure interacciones biológicas mínimas.
Entre los factores de riesgo de IRA se cuentan: correción inadecuada de los trastornos homeostáticos; mal manejo de líquidos e hipovolemia iatrogénica; lesión isquémica renal sobreagregada; prolongación de la anuria; aumento de la lesión inflamatoria; hemorragias, trombocitopenia e hipoxemia mantenida. Por tanto, es importante tener claro que en la IRA hay riesgos relacionados con la enfermedad, pero también los hay relacionados con el tratamiento; por consiguiente, no es tan fácil establecer cuán agresivo debe ser el tratamiento, el momento en que se debe iniciar y los criterios para indicarlo.
¿Cuándo se debe iniciar el tratamiento de reemplazo renal?
La pregunta que con mayor frecuencia se hace es cuándo iniciar el tratamiento de sustitución renal. Esto llevó a que se creara la ADQI (Acute Dialysis Quality Initiative), que dio origen a la AKIN (Acute Kidney Injury Network), grupo de trabajo integrado por especialistas en cuidados intensivos y nefrólogos cuyo objetivo es desarrollar la colaboración internacional, interdisciplinaria e inter-sociedades, para facilitar la investigación y estandarizar las prácticas de prevención y tratamiento de la IRA. AKIN propuso una modificación a los estadios de gravedad de la IRA y estableció los criterios para iniciar la TRR, como se muestra en la Fig. 1.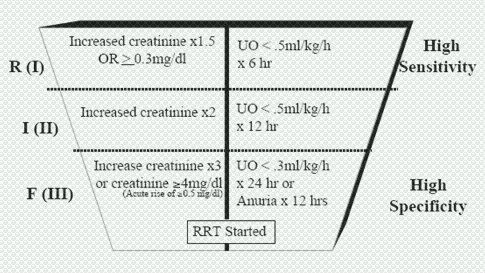 Tamaño completo
Tamaño completo Figura 1. Modificaciones propuestas por AKIN a la clasificación y tratamiento de la IRA
El aumento de la creatinina y la disminución de la diuresis son los principales criterios para iniciar la TRR, pero ADQI ha establecido criterios numéricos para esto y ha definido que, si se cumple un criterio, se plantea la terapia de reemplazo; si se cumplen dos criterios, la terapia es obligatoria y si se cumplen tres o más criterios, es de urgencia. Los criterios son los siguientes:
- oliguria o anuria menor de 200 ml en 12 horas
- acidosis metabólica grave, con pH menor de 7,1
- hiperazotemia grave, con BUN igual o mayor de 80 mg/dl
- hipercalemia igual o mayor de 6,5 meq/L)
- signos clínicos de toxicidad urémica
- hiponatremia o hipernatremia grave, con Na menor de 115 o mayor de 160 meq/L;
- hipertermia
- anasarca o sobrecarga de líquidos importante
- insuficiencia orgánica múltiple, incluyendo disfunción renal
- SIRS, sepsis o shock séptico con disfunción renal.
Algunos estudios demuestran que la supervivencia puede mejorar si la terapia de reemplazo se implementa en forma precoz (Gettings et al. Intens Care Med 1999; 25: 805-813), pero es difícil establecer el momento preciso y la diálisis profiláctica no ha mostrado ventajas específicas.
El objetivo de la terapia de reemplazo es simular las funciones y la fisiología del riñón nativo: realizar una adecuada purificación de la sangre, en calidad y cantidad; restaurar y mantener la homeostasis; evitar complicaciones; lograr una buena tolerancia clínica y favorecer condiciones que permitan una recuperación de la función renal. A continuación se analizará cómo alcanzar estos objetivos.
¿Cómo realizar la TRR?
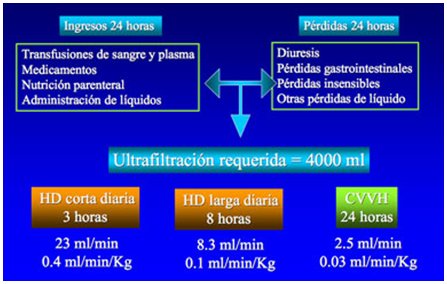
Hoy, la diálisis peritoneal en pacientes críticos no tiene la misma importancia que tuvo en la década del 70, debido a sus limitaciones: baja depuración de solutos, ultrafiltración limitada, alto riesgo de infección y problemas mecánicos. En cuanto a la hemodiálisis (HD) intermitente, a pesar de que hoy en día se cuenta con equipos de diálisis muy avanzados, la tolerancia clínica es mala, ya que los pacientes deben soportar una restricción hídrica, necesitan una enfermera de diálisis y la técnica es de eficiencia limitada. La diálisis continua (CRRT) también tiene limitaciones: requiere anticoagulación continua, largos períodos de exposición al circuito extracorporal, monitorización continua, mayor carga de trabajo y disponibilidad de equipos.Para comparar la CRRT y la HD intermitente se deben considerar los siguientes puntos clave: la tolerancia de la extracción de líquidos; la eficiencia en cuanto a remoción de solutos; el control de la homeostasis del estado ácido-básico y electrolítico; los casos clínicos especiales, como trauma, quemaduras, neonatos y lesión cerebral; el apoyo a la función renal y de otros órganos; y el impacto en la sobrevida y recuperación de la función renal, todo lo cual apoya la implementación de la terapia de reemplazo continua en enfermos graves. Si se va a remover más de 0,3 ml/min/kg de líquido del organismo, lo que significa prácticamente la remoción de un litro de líquido por hora, aumenta la frecuencia de hipotensión, aspecto muy importante que se debe considerar en pacientes de cuidados intensivos, quienes requieren una ultrafiltración de al menos 4000 ml de líquido diario. Como se puede ver en la Fig. 2, con la hemodiálisis corta diaria de 3 horas la ultrafiltración supera los límites para una buena tolerancia; la hemodiálisis larga diaria de 8 horas representa un límite; y con la terapia continua de 24 horas la remoción de líquido por minuto es muy escasa, alcanzando a sólo 2,5 ml/min.
 Tamaño completo
Tamaño completo Figura 2. Paciente de 70 kg con IRA: balance de líquidos requerido.
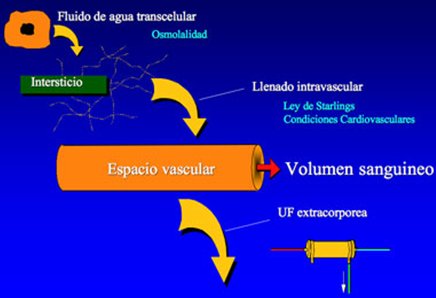
El problema es que el sistema extracorpóreo puede remover una gran cantidad de líquido, pero si no hay un llene intravascular apropiado, el volumen sanguíneo puede disminuir y ocasionar inestabilidad cardiovascular (Fig. 3).
 Tamaño completo
Tamaño completo Figura 3. Volumen sanguíneo = ultrafiltración - llenado.
Nosotros usamos un sistema para medir el volumen sanguíneo que permite guiar la ultrafiltración en enfermos muy inestables, con medición del llenado intravascular (Fig. 4). Como se detalla en la Fig. 5, en los procedimientos de diálisis diaria corta y larga el peso corporal y el volumen sanguíneo varían, cosa que no ocurre al usar la diálisis continua, lo que permite mantener una presión arterial media constante.
 Tamaño completo
Tamaño completo Figura 4. Equipo para guiar la ultrafiltración en pacientes con inestabilidad cardiovascular.
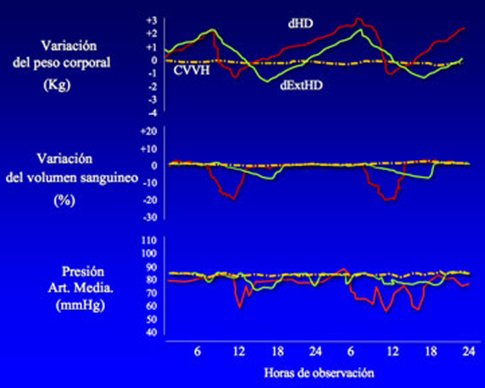 Tamaño completo
Tamaño completo Figura 5. Variación de peso corporal, volumen sanguíneo y presión arterial con distintos tipos de diálisis. dHD = hemodiálisis diaria corta; CVVH = hemodiálisis veno-venosa continua; dExtHD = hemodiálisis diaria larga.
Entre los mecanismos de acción de la terapia de diálisis continua, que permiten la normalización de las presiones de llenado cardiaco, están, por una parte, el mantenimiento del volumen sanguíneo vascular, la regulación del eje renina-angiotensina y la reducción de la postcarga; por otra parte están la reducción de la precarga, la depleción constante y lenta de volumen y la depuración de péptidos vasoactivos. Todo lo anterior es muy importante para la renoprotección, ya que la mantención de un flujo sanguíneo constante es fundamental para la prevención de una nueva lesión isquémica (Fig. 6).
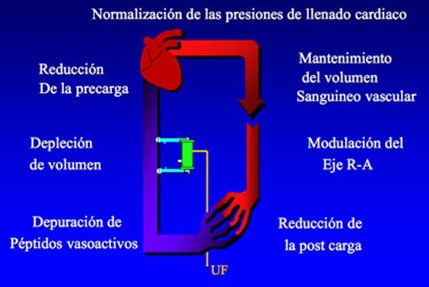 Tamaño completo
Tamaño completo Figura 6. CRRT: Posibles mecanismos de acción.
Los estudios sobre el control de la homeostasis en pacientes con sobrecarga de líquido e hiponatremia han demostrado que, luego de algunas horas de diálisis continua, se logra una corrección importante. Estos enfermos son los que requieren mayor atención durante el tratamiento. Otros estudios demuestran una mejoría del índice cardiaco y una modesta disminución de la resistencia vascular sistémica, con estabilidad de la presión sanguínea y de la frecuencia cardiaca y reducción de las presiones capilares pulmonares; es decir, estos parámetros mejoran claramente con la hemofiltración. También en relación con la homeostasis, con la terapia continua se optimiza el control del equilibrio ácido-base, como lo demuestra la estabilidad de los niveles de bicarbonato, lo que no ocurre con la terapia intermitente ni la diálisis diaria larga, que producen una alcalemia post-dialítica y luego, una disminución brusca (“rebote”) del pH (Fig. 7).
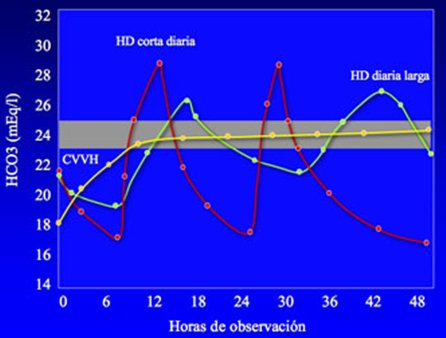 Tamaño completo
Tamaño completo Figura 7. Niveles de bicarbonato en CVVH y HD diaria.
En estudios de densidad cerebral con tomografía axial computarizada se ha demostrado que la densidad del tejido cerebral (sustancia gris y sustancia blanca) cambia luego de un tratamiento intermitente agresivo, mientras que con el tratamiento continuo se mantiene constante.
Lo que ocurre con los fluidos también ocurre con solutos como la urea y la creatinina: si no hay llenado intravascular con distribución adecuada del flujo sanguíneo, la eficacia de la diálisis se reduce. Se sabe que existe un pool que es un volumen (V) por una concentración (C), que depende de la cantidad de remoción, es decir, del clearence. Con el tiempo, la diferencia entre estos dos pools depende de la diferencia entre estos dos términos; pero la diálisis, en especial la diálisis intermitente, actúa sobre un pool que es distinto del pool global, de modo que existe una diferencia que depende mucho del coeficiente de transferencia de las moléculas dentro de estos dos componentes del organismo (Fig. 8).
 Tamaño completo
Tamaño completo Figura 8. Balance de solutos (modelo de doble pool).
Entonces, en una diálisis corta, a pesar de su elevado Kt/V, hay un efecto de rebote más alto y el Kt/V se reduce debido a este rebote que tiene lugar después de la diálisis; lo mismo ocurre con una diálisis diaria larga, pero no hay efecto de rebote en una situación de terapia continua y lo que en inglés se denomina time average deviation es mayor con la terapia intermitente y casi no existe con la terapia continua. Todo esto explica que la remoción diaria de urea sea mayor con terapias continuas que con diálisis corta diaria (Fig. 9).
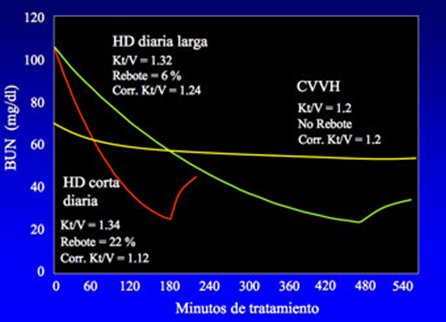 Tamaño completo
Tamaño completo Figura 9. Rebote postdialítico en HD.
Otros estudios demuestran que la depuración continua puede entregar valores estándar mucho más altos que cualquier otra terapia intermitente o diaria larga; por otra parte, la comparación de la diálisis continua con bomba y sin bomba, ha demostrado que mientras mayor sea el volumen de ultrafiltrado, mayor es la sobrevida (Stork et al. The Lancet 1991; 337:452-455).
El grupo clínico de Cleveland ha demostrado que si la enfermedad es de menor gravedad, la sobrevida de los pacientes es muy alta, independiente de la terapia que realice el equipo médico; pero en caso de enfermedad grave el paciente tenderá a morir, haga lo que haga el médico. En dicha situación, el elevado recambio por medio de la diálisis, que se puede alcanzar sólo con la terapia continua, puede invertir el cuadro. En un estudio que publicó nuestro grupo en el año 2000, se analizó la sobrevida acumulativa según dosis de tratamiento en tres grupos y se demostró que la ultrafiltración de 35 ml/kg/hr se asociaba a una sobrevida mayor y estadísticamente significativa que la dosis de 20 ml/kg/hr (Fig. 10). Otros estudios, como el de Schifft, demuestran que la diálisis diaria tiene una mortalidad más baja que la diálisis en días alternos (Schifft et al. New Engl J Med 2002; 346:305-310).
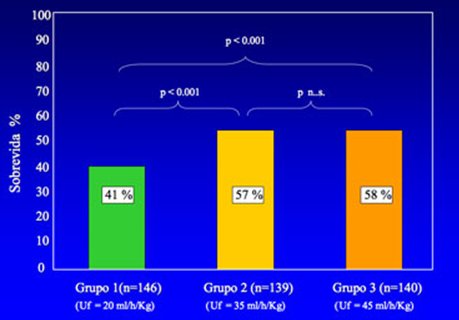 Tamaño completo
Tamaño completo Figura 10. Sobrevida acumulativa según dosis de tratamiento (Ronco et al. Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet. 2000 Jul 1;356(9223):26-30
En resumen, la terapia de reemplazo continua permite alcanzar un peso corporal estable, buena tolerancia hemodinámica, con adecuada presión arterial y buen control metabólico y de la acidosis; pero todavía no se puede afirmar que haya diferencias en la sobrevida, porque no hay estudios completos que permitan responder a esta pregunta. Hasta este momento existen tres estudios aleatorios, cuyos resultados no han sido significativos y en uno de ellos se detectó que sólo 34% de los pacientes tenían la misma gravedad y prácticamente la mitad eran enfermos más graves, en terapia continua, por lo que no se puede considerar a dichos estudios como evidencia. Kellum hizo un metaanálisis de estos estudios y concluyó que la terapia continua tendría ventajas sobre la terapia intermitente, con un riesgo relativo de muerte de 0,72 de la primera comparado con un riesgo de 1 con la segunda (Kellum et al. ICM 2002; 28:29-37).
En ausencia de evidencia ¿qué modalidad se debe usar? En los Estados Unidos se trata a menos de 20% de los pacientes con IRA con terapia continua; en Europa es mucho más común, pero con alta variabilidad entre centros y en Australia se usa terapia continua en casi 100% de los casos. Lo cierto es que la terapia continua ha permitido tratar a enfermos que antes fallecían sin opción de terapia y esto se debe a que hay una evolución en la prescripción del tratamiento: hace algunos años la dosis clásica era de 1 L/h, mientras que actualmente se prescriben 2 L/h, con difusión y conversión juntas; además se indica ultrafiltración más alta, con 4 ó 6 L/h, lo que se ha hecho posible gracias a los avances en la tecnología.
Uno de los aspectos interesantes del estudio que realizamos en el año 2000 es que no hubo diferencias al tratar a los pacientes con dosis más altas de diálisis, pero al estratificar a los pacientes se encontró que los que tenían sepsis se beneficiaban significativamente con las dosis más altas. Asimismo, el estudio de Oudemans-van Stranten demostró que cuando se utilizaba ultrafiltración de alto volumen, la mortalidad era más baja que lo esperado con base en la gravedad de los enfermos. Esto sugiere, en forma similar a lo que se describió con la dopamina hace algunos años, que habría una dosis de terapia continua como dosis renal y una dosis de terapia continua como dosis de sepsis. Un ejemplo es el caso de un enfermo que presentó una falla renal aguda secundaria a rabdomiolisis séptica y que se trató con terapia de alto volumen, con la cual se logró que sus parámetros se comenzaran a normalizar después de algunas horas, lo mismo que su cuadro clínico. Hace algunos años, los nefrólogos habrían pensado que este enfermo tenía una reducción del volumen extracelular, pero al enfermo se le trató con terapia isovolumétrica, o sea, no hubo diferencia de volumen; la explicación de esta situación puede estar en que los enfermos sépticos tienen un exceso de producción de mediadores en los fluidos biológicos.
La depuración de los mediadores con terapia continua parece ser baja; se han sugerido varias posibilidades para aumentar esta depuración. La primera es aumentar el volumen de ultrafiltrado y por ende, la convección. En 1995 hicimos un estudio para determinar la presencia de citoquinas en el ultrafiltrado, pero el significado clínico no quedó completamente aclarado; sin embargo, un mayor recambio del agua plasmática podría entregar algún beneficio, como lo sugiere un estudio sobre el efecto de la hemo-ultrafiltración de alto flujo publicado en 1998, en el que se demostró que la necesidad de norepinefrina disminuye significativamente con mayores cambios de volumen (Bellomo y Ronco. Kidney Int 1998).
Otra posibilidad es aumentar la permeabilidad de la membrana. El estudio de Matson, en un modelo de sepsis inducida por Staphilococcus aureus, demostró que se podría reducir la morbilidad y mortalidad con una membrana de 100.000 daltons (Matson. Crit Care Med, 26:730-737, 1998); otros estudios han utilizado una combinación de filtración plasmática, separación y adsorción plasmática.
Otra forma de aumentar la depuración es utilizar sorbentes en terapias combinadas, para aumentar la adsorción; se podría utilizar un sorbente junto con el filtro de diálisis, como una hemoperfusión más una diálisis. En un estudio realizado con este sistema pudimos demostrar que la remoción de mediadores era más alta que la de cualquier tipo de membrana de diálisis o hemofiltración. También hoy existen membranas cubiertas con polimixina B que se diseñaron para la adsorción selectiva de endotoxinas; algunos estudios japoneses han demostrado una sobrevida tres o cuatro veces mayor que los controles y actualmente se está haciendo un estudio en Europa para aclarar este aspecto.
Hace algunos años hicimos un estudio sobre la utilización de la plasmafiltración y adsorción integradas con regeneración del filtrado plasmático, mediante un filtro que separaba el plasma circulante por medio de un sorbente, con lo que se reconstituía la sangre y luego se efectuaba una diálisis normal. Lo interesante fue que se logró mejoría de la resistencia vascular sistémica, estabilidad del índice cardiaco y disminución significativa de la necesidad de las dosis de norepinefrina; además, los niveles plasmáticos de factor de necrosis tumoral (TNF) no cambiaron significativamente, pero la producción in vitro de TNF por las células monocitarias mejoró en forma significativa luego de 5 a 10 horas, cuando estaban incubadas con endotoxina. Entonces se analizó el plasma antes y después del cartucho y se encontró que, después de éste, las células normales mejoraban su capacidad de producir TNF cuando estaban en contacto con endotoxina.
En un paciente con sepsis, el monocito humano tiene una capacidad limitada para producir citoquinas; entonces surgen las siguientes preguntas: ¿Estamos trabajando con células agotadas, incapaces de llevar a cabo una sobreproducción o una producción adecuada? o bien ¿Está la célula inhibida por las altas concentraciones de citoquinas? y ¿La remoción se debe orientar a remover los niveles circulantes tóxicos, o bien a modular la actividad del monocito para que recupere su función de secreción?
La peak concentration hypothesis (hipótesis de concentración máxima) establece que existen muchas alzas de concentración de los mediadores luego de una inyección de endotoxina, efecto que se debería a una activación seguida de una inhibición del monocito. Ante tal situación se podría usar altas dosis de corticoides, antibióticos, antiinflamatorios o factor estimulante de colonias, pero aún no se sabe con certeza lo que se debe hacer. Pensamos que la terapia continua podría tener un efecto que, si bien es muy inespecífico, disminuiría los peaks de concentraciones de los mediadores inflamatorios y antiinflamatorios, con lo que se restauraría la homeostasis inmune.
Es probable que no sea tan importante bloquear un mediador u otro, ya que hay muchos; lo que se necesita es una especie de escudo que bloquee todos estos mediadores, un tratamiento pensado como una terapia de reemplazo que podría constituirse en una terapia de soporte multiorgánica y, al circular la sangre por los diferentes sistemas extracorpóreos, permitiría llevar a cabo las funciones de los diferentes órganos. Esto constituiría una esperanza para los centros hospitalarios que deben invertir innumerables recursos en enfermos que tienen insuficiencia multiorgánica y no sólo insuficiencia renal aguda aislada.
Para terminar, es importante señalar que el manejo de estos pacientes debe estar a cargo de un equipo multidisciplinario en el que el nefrólogo se incorpore al manejo intensivo, ya que el tratamiento es complejo y debe ser integrado.

