Congresos
← vista completaPublicado el 1 de noviembre de 2004 | http://doi.org/10.5867/medwave.2004.10.1153
Medicina actual y sus conflictos de intereses IV
Today's medicine and conflicts of interest IV
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del II Congreso Masvida 2004, realizado en Santiago el día 30 de abril de 2004, cuyo tema central fue el Rol del Médico en la Nueva Salud. En la ocasión, se publica el panel: Medicina Actual y sus Conflictos de Intereses.
Presidente: Dr. Juan Badilla.
La Cámara de la Industria Farmacéutica agrupa a las 22 empresas de investigación que mayoritariamente están presentes en Chile. A continuación se tratará dos aspectos: la investigación y generación de productos innovadores, uno de los objetivos más importantes que tiene esta industria, y, en segundo lugar, se dejarán planteados temas controvertidos que pudieran constituir conflictos de interés.
Las autoridades, los profesionales de la salud y la industria farmacéutica de investigación tienen objetivos compartidos, que son brindar los cuidados de salud a la población, con el mejor nivel de calidad disponible dado el conocimiento actual. Los avances en el conocimiento permiten la innovación, que es el leitmotiv de esta industria.
Valor de la investigación fármaco-clínica
Para señalar el valor de la investigación clínica en el mundo, se pueden citar algunos ejemplos. A principios del siglo XX, la tuberculosis aniquilaba a una parte importante de la población; la poliomielitis hizo popular el pulmón de acero hace 50 años, pero la generación actual no conoce este término, y muchas otras enfermedades de la primera mitad del siglo hoy figuran sólo en los libros de historia, todo ello muy relacionado con la investigación farmacéutica.
El SIDA estremeció al mundo en la década de 1980, pero en la actualidad hay 74 medicamentos para el tratamiento de esta enfermedad y las afecciones relacionadas, y existen muchos más en desarrollo; por último, es preciso recordar que a principios del siglo XX el promedio de vida en los países desarrollados era de 47 años, lo que significa que la expectativa de vida aumentó más en un siglo que en los 5 años previos a 1990.
Hay varias etapas de investigación, las que con el tiempo se han vuelto más complejas y alargan los plazos de investigación, como se resume en la figura 1.
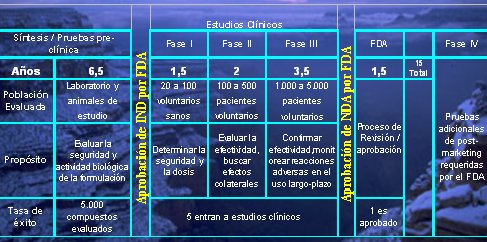 Tamaño completo
Tamaño completo Figura 1. Desarrollo de nuevas drogas y proceso de aprobación en los años 90.
Si se analiza lo que ocurre hoy: a partir de 5.000 moléculas iniciales se llega a una molécula final en el transcurso de 15 años, a lo largo de todo el proceso de investigación; se pierden recursos y trabajo, como se ilustra en la figura 2, lo que contrasta con el tiempo de desarrollo de un nuevo fármaco en los años 60, que era de sólo 8 años.
Esto ha significado un aumento en los costos de la investigación necesaria para desarrollar un nuevo fármaco, que en los años 80 era de aproximadamente 138 millones de dólares por fármaco; en la actualidad oscila alrededor de 800 millones de dólares (véase figura 3).
 Tamaño completo
Tamaño completo Figura 2. Etapas de la investigación farmacológica.
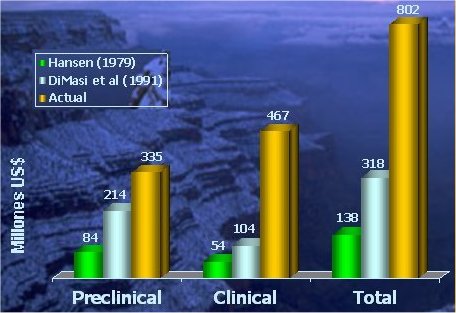 Tamaño completo
Tamaño completo Figura 3. Evolución del costo del desarrollo de un nuevo fármaco. Fuente: J. A. DeMasi, R.W. Hansen and H.G. Grabowski. The Price of Innovation: New Estimates of Drug Development Cost. Journal of Health Ecomonics 22 (2003): 151-185.
A nivel mundial, en 2003 la industria farmacéutica, representada sólo por las empresas que pertenecen a Pharma Internacional, invirtió en investigación 38.000 millones de dólares, con un aumento exponencial de este gasto en relación con 1980, como se puede ver en la figura 4.
Además hay que considerar que, a medida que van aumentando los costos y los años necesarios para obtener un fármaco nuevo, van disminuyendo los fármacos que aparecen en el mercado. Esta relación se observa claramente en la figura 5.
Con respecto al país de origen, la mayor actividad de investigación se está generando en los Estados Unidos, Japón y algunos países europeos, como Alemania y Suecia, y con respecto a las instituciones que impulsan la investigación de productos nuevos, actualmente 94% de este esfuerzo está dado por la industria farmacéutica, con muy poca participación de universidades, gobiernos o particulares (véase figura 6).
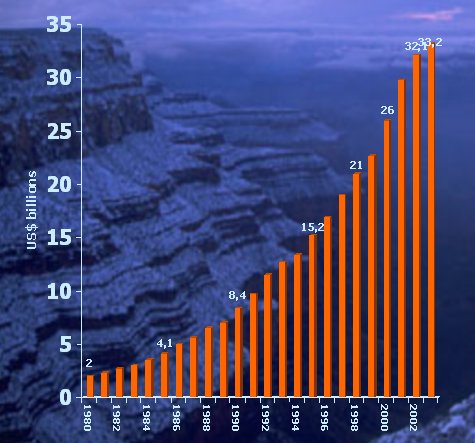 Tamaño completo
Tamaño completo Figura 4. Inversión en I&D por las Compañías PhRMA (Fuente: PhRMA Annual Membership Survey, 2003).
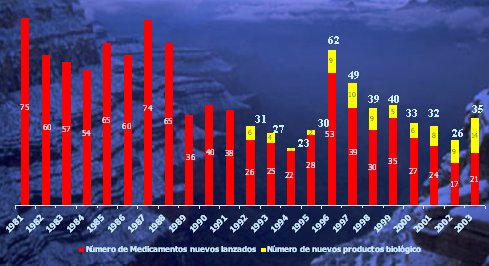 Tamaño completo
Tamaño completo Figura 5. Nuevos medicamentos en el mercado (1981-2002). (Fuente: U.S. Food and Drug Administration).
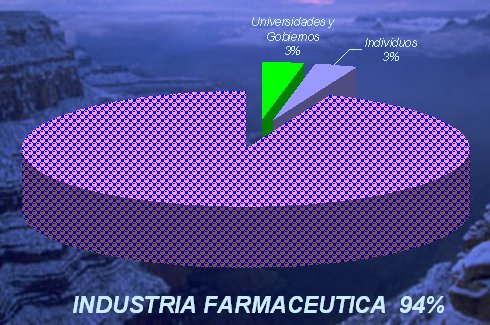 Tamaño completo
Tamaño completo Figura 6. Origen de las 100 drogas patentadas más prescritas en los EE.UU. en 1990. (Fuente: US Pharmaceutical Manufacturers’ Association).
El desarrollo e investigación de medicamentos nuevos que constituyan agentes terapéuticos eficaces e innovadores para la medicina es necesario e importante, dado el alto costo que genera la atención de las enfermedades que actualmente aún son incurables. Por ejemplo, el costo del tratamiento de las enfermedades cardíacas en los Estados Unidos, fue de 140 mil millones de dólares (véase figura 7).
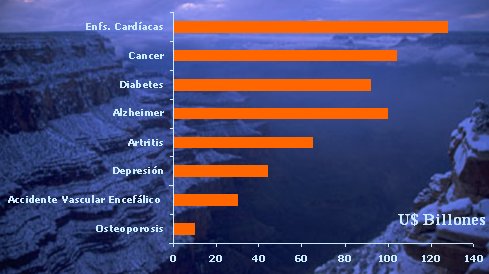 Tamaño completo
Tamaño completo Figura 7. Costo de Enfermedades Incurables, USA, 1996. (Fuentes: National Osteoporosis Foundation; National Stroke Association; National Institute of Mental Health; Arthritis Foundation; Alzheimer Association. National Cancer Institute: American Heart Association; PhRMA Survey).
La investigación clínica en Chile
En cuanto a la evolución de los estudios clínicos en Chile, en los últimos años ha habido un crecimiento importante en la investigación clínica. En la figura 8 se puede ver que entre los años 2000 y 2004 ha habido un aumento importante del número de estudios clínicos, los que aún están vigentes, y actualmente hay cerca de 700 centros participantes, con 46 instituciones repartidas a lo largo del país, 831 investigadores principales, 672 coinvestigadores y 416 coordinadores, lo que significa que la participación del país es importante.
Otros datos importantes son: las últimas cifras de inversión de las industrias de investigación en Chile, en 2003, alcanzan a alrededor de 16 millones de dólares anuales. Actualmente hay 10.000 pacientes que participan en protocolos de investigación clínica (véase figura 9); y, finalmente, hay un alto porcentaje de estudios en relación con enfermedades infecciosas, cardiovasculares y oncología; al mismo tiempo, sobre otras enfermedades relevantes, como la diabetes, hay menos estudios.
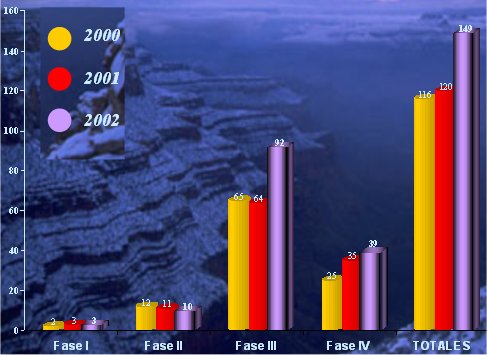 Tamaño completo
Tamaño completo Figura 8. Evolución de los estudios clínicos 2000/2002. Número de estudios en curso durante ese año. Encuesta CIF 2002.
 Tamaño completo
Tamaño completo Figura 9. Evolución de los estudios clínicos 2000/2002. Número de pacientes participantes. Encuesta CIF.
Papel de la industria farmacéutica en Chile
- La principal misión es entregar productos y fármacos de la mejor calidad disponible con el nivel de conocimiento actual.
- La innovación e investigación deben tener protección, por los altos niveles de inversión que se realizan; están suscritos varios tratados internacionales que protegen la propiedad intelectual.
- Aportes en políticas de salud y medicamentos.
- Introducción de innovaciones en los protocolos de atención; la reforma de salud debe contemplar la evolución de la técnica y la innovación en los protocolos.
- La calidad de los fármacos es un aspecto muy importante.
- Además, está presente el papel social.
- Otras tareas más concretas son el registro sanitario y la regulación de los productos de innovación; la importación, comercialización, los aspectos de promoción, el marketing y la interacción con el cuerpo médico; el perfeccionamiento médico continuo y el apoyo a las entidades médicas y a la fármaco-vigilancia.
Aspectos controvertidos
- La calidad de los productos;
- La bioequivalencia internacional de los productos farmacéuticos en Chile;
- La comercialización de los medicamentos;
- La prescripción médica;
- La actividad promocional;
- El precio;
- El apoyo económico que la industria da hoy a la actividad médica y a la investigación;
- La propiedad intelectual.
En cuanto a la calidad de los productos, para nosotros, como agrupación, es muy importante que en Chile se garantice los productos farmacéuticos, para lo cual se necesita una ley o una disposición que establezca que las plantas farmacéuticas deben tener GMP, (Guía de inspección de buenas prácticas de fabricación), tanto en procesos como en producción, como principio básico para hablar de otros aspectos en relación con la garantía de calidad. No se puede hablar de bioequivalencia, biodisponibilidad ni calidad de producto, si lo anterior no está garantizado. En la actualidad, en Chile las plantas no aplican las GMP, y en más de 63% de los productos que se venden la calidad no está garantizada.
Otro factor importante es que los productos no se deben vigilar sólo en una ocasión, sino desde la importación de las materias primas hasta el producto terminado y los controles de estantería. La fármaco-vigilancia debe ser efectiva, y las empresas deben tener responsabilidad en cuanto a los efectos terapéuticos, los efectos secundarios, la información de calidad, la bioequivalencia y la biodisponibilidad con normas internacionales.
La autoridad sanitaria debe regular e implementar los aspectos de bioequivalencia y biodisponibilidad. Hay proyectos dirigidos a enfrentar de mejor manera este aspecto. La industria farmacéutica apoya la garantía de calidad, bioequivalencia y biodisponibilidad, pero con altas normas. Debe haber un cronograma, con un establecimiento claro de las prioridades, y una legislación eficaz, lo que significará que los organismos públicos y privados participen en garantizar la calidad de los fármacos disponibles en Chile.
El tema de la comercialización ha sido poco tratado, pero es importante. En la actualidad, 95% de los productos que se comercializan están concentrados en tres cadenas, las que muestran una proliferación de productos propios. Otras preocupaciones son los productos OTC, que se venden sin receta, y las faltas de respeto hacia la prescripción médica, que se manifiesta en indebidos cambios de receta y ventas sin receta. La transparencia, la integración y la cobertura geográfica son otros elementos importantes.
En lo que se refiere a la prescripción médica, hay muchos vicios, como los cambios de receta, porque hay una integración entre la farmacia y sus productos propios, área que necesita ser más transparente. La receta médica constituye parte del acto médico, por lo que su responsabilidad no se desliga hasta el uso del producto verdadero que se le expende en la farmacia al paciente.
También están los problemas de la automedicación responsable, es decir, todo lo que sucede cuando los pacientes acuden sin receta a la farmacia. Aquí entra el aspecto de la prescripción genérica obligatoria, que forma parte del proyecto que se piensa implementar junto con el AUGE, al cual no se opone la industria farmacéutica si hay garantía de calidad. Además, el médico debe ser libre de prescribir los fármacos con los cuales tiene experiencia y confianza.
En cuanto a la actividad promocional, se debe respetar un código de ética en cuanto a la información que se entrega al médico, en lo referente a las indicaciones y los efectos secundarios. La información debe ser veraz y permitida, y debe corresponder al fármaco de investigación. Además del código de ética internacional, debe haber reglamentación y vigilancia locales.
El precio es, sin duda, un elemento importante. Chile tiene uno de los precios más bajos de América Latina en fármacos, y existe un consumo importante de medicamentos genéricos. El precio debe estar determinado por el grado de innovación del producto. Quizás un compromiso para el futuro es llegar a tener cobertura de fármacos en Chile, lo que es contemplado por el AUGE en algunos aspectos. También es preciso señalar que coexisten medicamentos de categorías y precios diferentes, como los innovadores, que son resultado de la investigación, los similares con marca (copias), los genéricos.
El apoyo a las actividades médicas se refiere al hecho de que la industria financia una gran cantidad de congresos y estudios, pero esta actuación debe estar regida por un código de ética, sin violentar jamás la libertad del médico en la prescripción. Además, estas actividades deben estar orientadas a la educación o al quehacer médico, deben ser de preferencia institucionales, deben tener valores razonables y apoyo legal y tributario, de modo que sean incuestionables y transparentes.
Tareas futuras para la industria farmacéutica
- Trabajar en lograr fármacos de calidad;
- Potenciar la investigación en Chile;
- Desarrollar protocolos de investigación que consideren el desarrollo de la ciencia y de la técnica, incorporando productos de innovación;
- Establecer precios razonables, incorporando el concepto de fármaco economía;
- Respetar estrictamente la receta médica;
- Efectuar una comercialización transparente;
- Lograr que los fármacos tengan cobertura;
- Obtener que las actividades de promoción estén regidas por un código de ética;
- Realizar una farmacovigilancia adecuada.

