Congresos
← vista completaPublicado el 1 de noviembre de 2006 | http://doi.org/10.5867/medwave.2006.10.1267
Aspectos epidemiológicos del cáncer cervicouterino
Epidemiological aspects of cervical cancer
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del V Congreso de Obstetricia, Ginecología Infantil y Adolescencia, Simposio: Vacunas en la Adolescencia, realizado en Santiago entre los días 31 de agosto al 2 de septiembre de 2006. El evento fue organizado por la Sociedad Chilena de Obstetricia, Ginecología Infantil y Adolescencia.
Presidente: Dra. Pamela Oyarzún.
Introducción
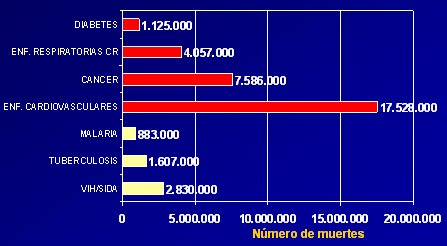
El cáncer ocupa el segundo lugar como causa de mortalidad en el mundo, después de las enfermedades cardiovasculares, según las estimaciones de la OMS para el año 2005; 17 millones y medio de muertes ocurren por causa cardiovascular y alrededor de la mitad de ese número, por cáncer (Fig. 1). Algo similar ocurre en Chile.
 Tamaño completo
Tamaño completo Figura 1: Mortalidad mundial por diferentes causas 2005. Estimación OMS.
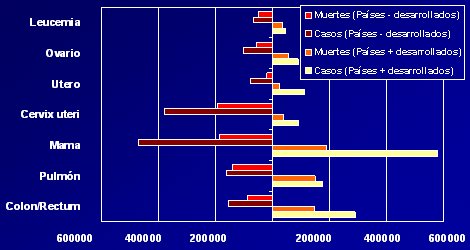
Los datos de Globocan de 2002 relacionados con cáncer (Fig. 2), señalan claras diferencias entre los países según su grado de desarrollo: el cáncer de cuello uterino (Ca Cu) es mucho más frecuente en los países de menores recursos, a tal punto que esta enfermedad se podría considerar una trazadora de los recursos en salud; y no solamente el número de casos es menor en los países desarrollados: el número de muertes es proporcionalmente mucho menor.
En cambio, en otros tipos de cáncer no se observa tanta diferencia entre los países en desarrollo y aquellos en vías de desarrollo o subdesarrollados, lo que se debe a que en algunos hay elementos para detección precoz y normas de tratamientos muy efectivos, y en otros no, como, por ejemplo, el cáncer de ovario, para el cual aún no hay un screening disponible y la norma de tratamiento todavía no se ha establecido.
 Tamaño completo
Tamaño completo Figura 2: Número total de casos y muertes por tipo de cáncer en países menos y más desarrollados. Globocan IARC Lyon, Francia 2001
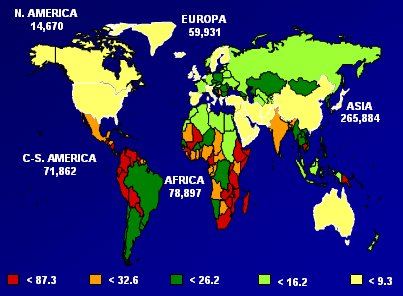
Si se analizan las localizaciones más frecuentes del cáncer en mujeres de América Central y América del Sur, se observa que el Ca Cu ocupa el segundo lugar en cuanto a incidencia y mortalidad, con tasas bastante elevadas, no sólo en 2002, sino que se han mantenido desde hace largo tiempo.
 Tamaño completo
Tamaño completo Figura 3: Número estimado de casos de cáncer cérvico-uterino/Región. Tasa de incidencia ajustada por edad por 100,000 mujeres/año. Globocan 2002.
El impacto mundial del cáncer de cuello uterino se estima, para 2002, en una incidencia de 83 mil casos en los países desarrollados y 409 mil casos en los países en desarrollo, es decir, éstos acumulan 83% de los casos. Asia tiene 54% de los casos en el mundo y América Latina y el Caribe, 18%; para mayor desgracia, las regiones más afectadas cuentan con solamente 5% de los recursos mundiales de salud. Los casos que se registran en América Central y América del Sur se asemejan al total de casos que se registran en América del Norte y Europa Occidental, prácticamente la misma cantidad de casos, pero con una sobrevida menor.
La mayor parte de los programas de detección del Ca Cu en América del Sur, América Central, el Caribe y México han fracasado; los únicos países en que se ha visto algún beneficio con el screening secundario son Chile y Colombia, cuyos programas de prevención les han permitido mostrar una tendencia a la disminución de la mortalidad.
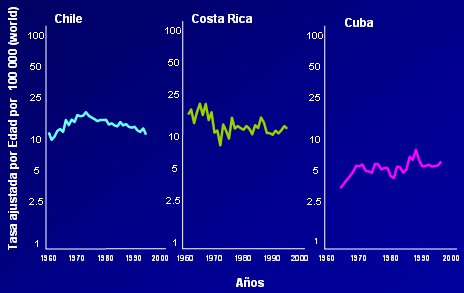 Tamaño completo
Tamaño completo Figura 4: Tendencia de la mortalidad por cáncer cérvico-uterino (Fuente: WHO/NCHS)
En el mundo se registraron 550 mil casos de Ca Cu en 2005 y hubo alrededor de 270 mil muertes, de acuerdo con estimaciones de la OMS. En Chile, en 2004 la incidencia estimada fue de 1.350 casos de acuerdo a cifras del Minsal (aunque no se dispone de un registro nacional, sino sólo de registros regionales uno en Antofagasta y otro en Valdivia), el número de muertes en el país fue de 676 por esta causa. Si se considera que los estándares quirúrgicos y de radioterapia los definieron Wertheim, Roentgen y los esposos Curie, hace más de un siglo, y que hace más de 60 años Papanicolau puso a disposición de la humanidad el método de citología clásica exfoliativa que lleva su nombre (PAP), es evidente que algo nos impide que esto no tenga la aplicación ni el efecto que debería tener.
Estrategias actuales para la prevención del cáncer de cuello
Hay tres tipos de prevención. La prevención primaria se orienta a evitar la aparición de la enfermedad y en ella cumplen un papel muy importante los hábitos de vida; la alimentación, pues se ha demostrado que las dietas ricas en antioxidantes pueden disminuir la incidencia de cáncer; y las vacunas, cuyo importante papel en la prevención primaria quedó demostrado hace muchos años, siendo uno de los únicos fármacos que permiten erradicar enfermedades. La prevención secundaria se efectúa mediante la detección precoz de la enfermedad con un screening apropiado, como el PAP, en el caso del cáncer de cuello uterino (y la mamografía y el antígeno prostático, para cáncer de mama y próstata). La prevención terciaria se refiere a la oportunidad y calidad del tratamiento.
La prevención secundaria del Ca Cu se basa en el método de pesquisa citológica de Papanicolau, que adolece de algunas limitaciones, ya que ningún examen tiene un valor predictivo absoluto positivo o negativo, pero presenta algunos elementos muy importantes: bajo costo, alta sensibilidad y baja especificidad. En Chile, con el control de calidad que aplican los laboratorios del sistema público, se puede afirmar que no más de 20% son falsos negativos y no más de 15%, falsos positivos. Sobre 90% se efectúan en la atención primaria de salud (por parte de las matronas) y tienen un alto índice de costo-beneficio. La cobertura ideal de población es de 80%. Hay otros métodos, como tipificación de virus papiloma humano, citología en medio líquido y citología automatizada, pero no se ha hecho estudios de costo-beneficio suficientes, de modo que dependen de factores relacionados con las estructuras de costo y con los sistemas de salud y culturales de los distintos países.
Una gran limitante del PAP son los errores por procedimiento inadecuado en la toma de muestra, de modo que los resultados negativos pueden presentar un error de 5% a 40%; si se optimiza la toma de muestra, disminuyen los falsos negativos y probablemente también los falsos positivos. Todos estos inconvenientes se reducen al mínimo con la repetición periódica del examen. Por otra parte, de acuerdo con los datos disponibles en el Hospital San Borja Arriarán y los resultados descritos en una publicación reciente del American College of Obstetricians and Gynecologists, 50% de los casos de cáncer invasor se ven en pacientes que nunca se han hecho un PAP, o sea, hay un nicho de población al cual la citología o la prevención secundaria no llega, por distintos motivos, y eso ocurre tanto en Chile como en los Estados Unido, hasta 15% de los casos de cáncer invasor tenían un PAP falso negativo, lo que no es extraño, porque la citología de PAP se describió para detectar lesiones preinvasoras, no lesiones invasoras (estas mujeres acudieron tardíamente). Otras limitantes del tamizaje serían la presencia de casos de Ca Cu de progresión acelerada y la falta de control de calidad de los laboratorios de citología en América Latina.
Adolescentes en una unidad de patología cervical
En cuanto a la situación de las adolescentes, en el Hospital San Borja Arriarán, en 2005, se tomaron 23 exámenes a menores de 15 años portadoras de factores de riesgo, de los cuales 2 salieron positivos, es decir, casi 10% (en población general la positividad es alrededor del 1,5%); también se hicieron 968 PAP en adolescentes de 15 a 19 años y 1,2% (12) salieron positivos, lo que es comparable con el promedio de la población. Ese mismo año ingresaron a la Unidad de Patología Cervical (UPC) 8 adolescentes de 18 años o menos, entre un total de 489 ingresos (1,6%). Para estimar que un PAP es positivo se utilizó la norma ministerial, que lo define como segundo PAP atípico, PAP atípico que plantea alto grado, NIE o cáncer.
Programa Nacional de Cáncer de Cuello Uterino
El programa de Ca Cu en Chile marcó una tendencia muy importante, entre 1987 y 2003, en el indicador más importante: la tasa de mortalidad, que bajó de 12 a 8,4 por 100.000 en 2003 y 8,3 en 2004, pero el mayor impacto se aprecia, no en el total sino en el grupo de mujeres mayores de 25 años, que son las que mueren por Ca Cu (Fig.5). La tasa de 24 por 100.000 cayó a 14,4 por 100.000 en 2003, o sea, un resultado muy importante que se logró solamente con base en la prevención secundaria.
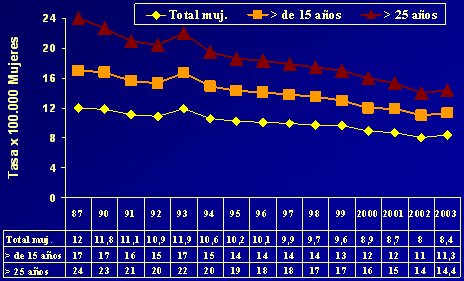 Tamaño completo
Tamaño completo Figura 5: Mortalidad por cáncer cérvico-uterino total y específica por edad, Chile 1987-2003. Unidad Cáncer MINSAL.
Los años hito (Fig. 6) fueron 1987, en que se inició el programa de Ca Cu; 1994, cuando se hicieron las modificaciones al programa de cáncer de cuello uterino; y 2003 en que se implementa el Auge. Se observa que en el grupo de mayor riesgo, que son las mujeres de 35 a 64 años, la tasa de mortalidad cayó en 53%.
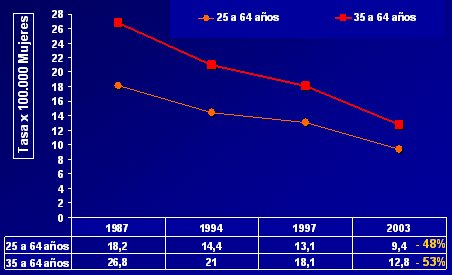 Tamaño completo
Tamaño completo Figura 6: Mortalidad por cáncer cérvico-uterino según grupos de riesgo. Chile, años hito. Unidad de Cáncer MINSAL.
En 2002 se plantearon alternativas sobre la mejor forma de seguir avanzando en el programa de Ca Cu para potenciar su éxito en el futuro. Sabemos que la cobertura ideal en un programa de prevención secundaria es de 80%, de modo que se deben buscar los métodos para conseguirlo, pero no hay evidencias de metodología, del impacto ni de la relación costo-efecto que tendrían, en un escenario como el de Chile, las medidas que se pudieran tomar para pasar de 66% a 80%. Otras medidas que se podrían tomar para reducir la mortalidad tienen que ver con prevención terciaria, como optimizar el diagnóstico y optimizar los accesos y la calidad del tratamiento (medicina basada en evidencia).
En el año 2002 esto coincidió con la Reforma de Salud planteada por el Gobierno y la implementación del plan AUGE, que recoge la necesidad de aplicar medidas de prevención terciaria en Ca Cu y asegura los accesos y la calidad de los tratamientos (Tabla I), completando, de esta forma, un conjunto de medidas que se puede aplicar a muchas otras enfermedades. En esta situación, la de un programa afianzado de control del CaCu, como el de Chile, se abre la interrogante sobre el eventual impacto que podrían tener las vacunas en el futuro.
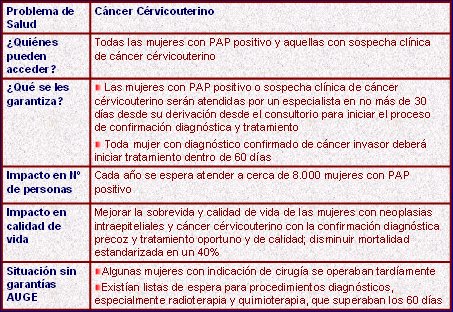 Tamaño completo
Tamaño completo Tabla I: Concepto general AUGE MINSAL.
Lo anterior ha sido posible gracias a la organización del Sistema de Salud chileno en una Red de Atención. En esta red, el Programa Nacional de Ca Cu establece que en cada Servicio de Salud se desempeñen un médico y una matrona encargados de la gestión del Programa, en el nivel terciario de Salud; en cada hospital funciona una Unidad de Patología Cervical (nivel secundario de atención), con un equipo capacitado, y se cuenta con una red de derivación a quimioterapia, radioterapia y cirugía, en el nivel terciario. El Laboratorio de Referencia Nacional de Citolopatología realiza el control de calidad de los 22 laboratorios ubicados a lo largo del país; y en el nivel primario de Salud, en cada consultorio hay una matrona encargada del Programa; gracias a quienes se ha logrado que 92% de los PAP del sistema público se tomen en este nivel. El programa de alivio del dolor y cuidados paliativos funciona en los tres niveles de atención.
Virus papiloma humano y potenciales vacunas
La relación de causalidad entre el virus papiloma humano (VPH) y el Ca Cu está ampliamente demostrada. En todo el mundo, la infección persistente por VPH se considera como una causa necesaria, aunque no la única, para el desarrollo de cáncer invasor de cuello uterino. Por ejemplo, en un estudio sobre prevalencia de DNA del VPH en más de 1.000 biopsias de Ca Cu, que se realizó en 22 países, se comprobó que en 99,7% de los casos de cáncer de cérvix invasor participa este virus (Walboomers JM, Jacobs MV, Manos MM et al. J. Pathol. 189: 12-19, 1999).
En este aspecto, hay algunas observaciones interesantes. Se sabe que el riesgo de infección durante la vida es muy alto: 50% a 80% en hombres y mujeres, pero menos de 2% de las mujeres desarrollan alguna alteración citológica; la mayoría de las infecciones virales son transitorias, latentes o simplemente desaparecen y sólo en una minoría de casos la infección persiste, lo que se podría deber a una respuesta inmunológica permisiva o a la influencia de cofactores. Algunas de estas mujeres con infección persistente y con tipos virales de alto riesgo desarrollan NIE de alto grado o cáncer.
Entre los cofactores que pueden participar se mencionan la promiscuidad (tanto en el hombre como la mujer), multiparidad (mas de 5 partos), el abuso de drogas y de tabaco, y el uso de algunos compuestos hormonales. El manejo de la información sobre el VPH no es un tema menor. Las pacientes que ingresan a una UPC con un PAP sugerente de infección por VPH refieren muchas veces, que se les dijo que se trata de una enfermedad de transmisión sexual; que ella se contagió y que es portadora de la infección, lo que significa un rótulo muy negativo para una mujer; que este virus produce cáncer; que no hay medicamentos contra esta infección viral; y que debe acudir al oncólogo, todo lo cual es cierto, pero las mujeres llegan aterradas y existen otras formas de explicarlo. La información se debe entregar en forma muy cautelosa y dirigida a lograr la fidelidad de las pacientes, pero sin asustarlas en exceso. Hay que enfatizar que el riesgo de infección durante la vida es de 50% a 80%, pero solamente 2% van a desarrollar alguna lesión de las células cervicales relacionadas con el virus.
Sabemos desde hace tiempo, que los factores sexuales cumplen un rol ; factores como la multiparidad, la promiscuidad y el inicio temprano de la actividad sexual tienen alguna influencia en el cáncer de cuello uterino. Lo que se sabe hasta ahora sobre la historia natural de la infección por VPH, los cambios celulares que ésta origina y la forma en que progresa hasta llegar a un lesión intraepitelial de alto grado o un cáncer se ve en la Fig. 7. Estudios recientes demuestran que lo que se pensaba: que la neoplasia intraepitelial (NIE) de grado 1 o leve era un paso necesario hacia grados mayores, en realidad forma parte de otro capítulo relacionado con la infección, pero no es una condición para que se desarrollen las lesiones de alto grado o el cáncer; o podría ser un estado intermedio. De hecho, se ha demostrado que, en mujeres menores de 30 años, hasta 90% de las NIE 1 regresan espontáneamente, no así en mujeres mayores.
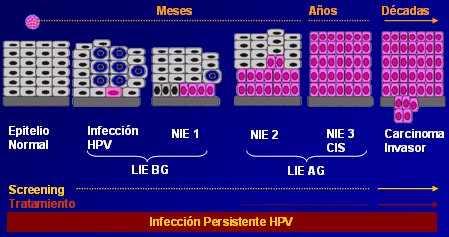 Tamaño completo
Tamaño completo Figura 7: Progresión del cáncer de cuello uterino NIE = Neoplasia intraepitelial cervical: LIE = Lesión intraepitelial escamosa.
Se sabe que la edad temprana de infección es un factor de riesgo crítico para el Ca Cu y que el riego de infección es muy alto en las adolescentes, debido a que los cambios hormonales condicionan una alta susceptibilidad cervical. También aumenta el riesgo el hecho de tener varias parejas y otros factores como el tabaco y el alcohol. En un estudio realizado en una comunidad urbana de los Estados Unidos, en hombres y mujeres adolescentes, estudiantes de educación secundaria, se les consultó sobre las relaciones sexuales en forma amplia, no sólo la actividad coital, preguntando por el contacto piel con piel y se observó que los adolescentes tenían este tipo de contactos con altísima frecuencia y que además eran múltiples, lo que nos alerta de riesgos tempranos se deben manejar (Bearman et al. Am J Soc. 2004; 110: 44-91).
Prevalencia de VPH en cérvix: diagnóstico citológico/histológico
La prevalencia de la infección por virus papiloma es de 9% en mujeres con citología normal y aumenta notablemente en las que tienen lesiones preinvasoras (80%-90%), hasta 95%-100% en las portadoras de Ca Cu. Por otra parte, los virus papilomas son más de 100, pero sólo 40 se relacionan con el tracto genital, tanto en hombres como en mujeres, y de ellos, 18 se relacionan con Ca Cu o lesiones preinvasoras de alto grado del cuello uterino. Se consideran de alto riesgo oncogénico los tipos 16, 18 (65%), 31, 33, 35, 39, 45, 51, 52, 56, 56, 59, 68, 73 y 82; y de alto riesgo probable, los tipos 26, 53 y 66 (Muñoz N. et. al. Epidemiological classification of HPV types associated with cervical cancer. N Engl J Med 2003;348). La relación del VPH con el cáncer de cuello uterino alcanza un riesgo relativo de 500; es la relación más sólida entre un agente y las enfermedades, más aún que fumar y tener cáncer de pulmón, y más que la presencia de virus de la hepatitis B o C y cáncer de hígado (Fig.8).
 Tamaño completo
Tamaño completo Figura 8: VPH y cáncer cervical: una relación notablemente sólida en la epidemiología del cáncer. Bosch FX y colaboradores (J Clin Pathol 2002; 55: 244–65).
En la prevalencia mundial de la infección por VPH, por edad (Fig. 9), se puede ver que las adolescentes son las más afectadas y que alrededor de los 40 a 50 años aparece un segundo peak.
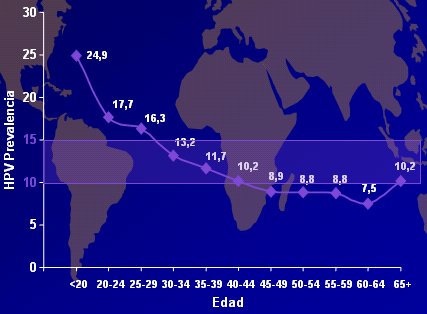 Tamaño completo
Tamaño completo Figura 9: Prevalencia mundial de VPH-DNA específica por edad, en mujeres de población general (De Sanjose et al, en preparación).
Esta situación es similar a lo que ocurre en Chile, como lo demostró el estudio de Ferrecio y colaboradores, de la Universidad Católica, publicado en 2003, realizado en una comunidad de mujeres sanas de Santiago. La distribución (Fig. 10) se asemeja a la que se describió a nivel mundial, con prevalencia muy alta en mujeres de 20 años, luego va descendiendo a medida que aumenta la edad, con un segundo peak alrededor de los 50 años (pero en este predominan subtipos de bajo riesgo). Es probable que este efecto esté relacionado con la primoinfección y el desarrollo de la respuesta inmune natural.
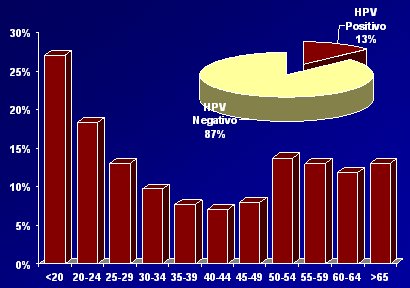 Tamaño completo
Tamaño completo Figura 10: Prevalencia de HPV en Chile. Adaptación de JM Ojeda de Ferrecio C, Prado R et al, Cancer Epidemiology, Biomarkers & Prevention; 13; 2004.
En la Figura 11 se grafica la contribución de los diferentes subtipos o genotipos de virus papiloma al cáncer de cuello uterino y se ve claramente que la elección de las vacunas contra subtipos 16 y 18 depende de esta distribución mundial de los diferentes subtipos, si bien existen variaciones regionales y geográficas.
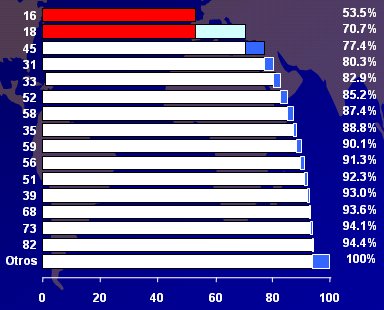 Tamaño completo
Tamaño completo Figura 11: Contribución relativa al cáncer cervicouterino: todas las regiones del mundo combinadas. (Bosch FX).
Se sabe que de cada millón de mujeres con infección por virus papiloma, 100.000 tendrán alteraciones citológicas; 8.000 desarrollarán una NIE de alto grado o un cáncer in situ; y 1.600 desarrollarán un cáncer (McIntosh N. Documento sobre estrategia JHPIEGO 2000). La mortalidad global es enorme: en el mundo, cada dos minutos muere una mujer por cáncer cervical; y en América Latina, cada semana aparecen 1.300 a 1.400 casos nuevos y 628 muertes (Ferlay J et al. Globocan 2002. IARC 2004). La situación de Chile es muy buena si se compara con la del resto de América Latina.
La distribución de los distintos subtipos se analizó en un estudio de 1995, de Bosch y Nubia Muñoz, en el que se tomaron muestras de cáncer de cuello uterino en distintos países en el mundo y se demostró que el subtipo 16 es el más frecuente. El 18 está relacionado con el adenocarcinoma de cuello uterino y el subtipo 16, con el carcinoma escamoso, que corresponde a 85% a 90% de los casos. Ambos son mucho más frecuentes que el resto de los serotipos en Europa y en América del Norte, y permanece alto en África y Asia sudoriental, aunque su importancia relativa es un poco menor. Chile colaboró en este estudio con algunas muestras del Servicio de Salud de Concepción y llama la atención que la cantidad de otros serotipos es relativamente alta, en comparación con los demás países (Fig. 12). Este estudio se hizo hace diez años, con la técnica de ese momento; por eso, en este momento se está llevando a cabo un estudio similar, con tecnología actualizada.
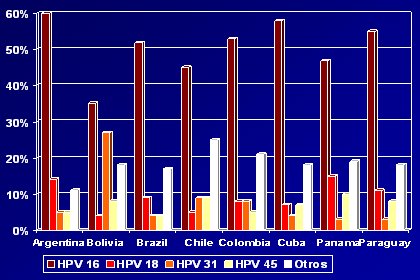 Tamaño completo
Tamaño completo Figura 12: Distribución de VPH positivos por tipo de VPH y país (Bosch X; Manos M; J Natl Cancer Inst 87; 1995).
Medwave. Año VI No. 10 Noviembre 2006. Derechos Reservados
La edición y publicación de esta conferencia han sido posibles gracias a un auspicio sin restricciones de GlaxoSmithKline.
La infección por virus papiloma es necesaria para el cáncer cervical. Está claro que la vacuna va a tener impacto, pero la magnitud de ese impacto todavía no se puede dimensionar en forma exacta. En áreas que tengan recursos de screening desarrollados, las vacunas para HPV serán un complemento de los programas de prevención secundaria. En Chile hay un programa de screening desarrollado, con cobertura nacional, a diferencia de lo que ocurre en América Central y en el resto de América del Sur, y se van a necesitar muchos análisis para determinar el grado de complementación entre esta posibilidad de prevención primaria que está emergiendo y la prevención secundaria, que ya está asumida. En áreas con recursos de screening limitados, las vacunas para VPH representarán un paso decisivo en la lucha contra el cáncer cervical, dependiente de costos, prejuicios y énfasis en la salud pública; allí van a constituir la única posibilidad de disminuir la mortalidad por cáncer cérvico-uterino.
Resumen
Las interrogantes que subsisten tienen que ver con aspectos generales de la infección.
¿Cuánto dura la infección transitoria? Hoy en día se habla hasta de 24 meses, pero hace algún tiempo se hablaba de 12 meses. ¿Se logra erradicar al virus, o sólo se logra que sea indetectable frente a las técnicas disponibles para identificarlo y/o tipificarlo? ¿La prevalencia de los subtipos de alto riesgo es similar en la población general y en los pacientes con cáncer? ¿Se va a originar reinfección por otros subtipos de alto riesgo?
¿Cuál va a ser el impacto mediático, político y psicosocial con la vacunación de preadolescentes, puesto que se trata de una infección relacionada con la actividad sexual? ¿Cuál es el momento óptimo para aplicar la vacuna y cuánto dura su efecto? ¿Cual es la costo-efectividad de un programa de vacunación para VPH (como política sanitaria)?
Una vez que se apliquen las vacunas, ¿por cuánto tiempo se deberá mantener los programas de prevención secundaria? Es probable que estos programas acompañen las vacunas por varias décadas, mientras no se tenga una respuesta clara a estas interrogantes y no se logre inmunizar a toda la población.
Interrogantes clínico-epidemiológicas 2005-2006
En cuanto al fundamento científico de la composición, las dos vacunas desarrolladas tienen un antígeno, que es una partícula L1 semejante al virus (VLP), expresado en un variedad de hongo y la otra en un sistema baculovirus; y un adyuvante, sal de aluminio o el lípido A monofosforilo 3-deacilado (MPL R más sal de aluminio, o sistema adyuvante AS04), para aumentar la respuesta inmunológica contra el virus. Si se comparan los datos correspondientes a adyuvantes de las dos vacunas, podrían existir diferencias de acuerdo a estudios preclínicos. Los datos disponibles indican que la eficacia de la vacuna en cuanto a los subtipos 16 y 18 es prácticamente 100% para la NIE y para la infección persistente, y un poco menos para la incidencia, porque probablemente en ésta influyan otros subtipos, aparte de los subtipos 16 y 18 (Harper D. et al. Lancet 2004,364 (9447); Lancet 2006, 367 (9518)).
Un aspecto interesante es la baja inmunidad natural contra el virus, lo que puede explicar la presencia de reinfecciones a lo largo de la vida. La inmunogenicidad de las vacunas permite obtener altos títulos de anticuerpos, aunque éstos descienden con el tiempo, como lo demuestran los estudios de seguimiento de distintas poblaciones (HPV-007: Imunogenicidad VPH 16 y 18 a 4,5 años postvacunación (Lancet 2006 367(9518):1247-55).
En un estudio aleatorio y controlado sobre la vacuna VPH 16/18 se observó que el rango de efectos adversos es aceptable; que no existen efectos adversos graves; que la seroconversión es de 100%; y que los títulos específicos obtenidos en el Mes 7 mediante la vacuna son más altos que los que otorga la inmunidad natural: 100 veces mayores en HPV 16 y 80 veces mayores en HPV 18 (Harper DM, 2004). La vacuna candidata de GSK para los subtipos 16 y 18 tiene como meta lograr una reducción de 70% de los cánceres asociados con estos tipos de virus papiloma. Existiría la posibilidad de un impacto protector adicional si se añadieran otros subtipos; los últimos resultados publicados por GSK demuestran que la eficacia de la vacuna alcanzaría 94% contra el serotipo 45, que es el tercero más frecuente, y de 55% contra el tipo 31, o sea, el impacto podría ser mayor, aunque eso dependería de la distribución geográfica y regional de los diferentes subtipos del virus papiloma.
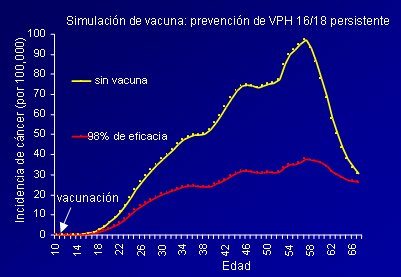
Figura 14: Impacto proyectado de las vacunas sobre el cáncer cervical (Gráfica adaptada de Goldie SJ, Int J Cancer 2003; 106: 896-904).
 Tamaño completo
Tamaño completo Visto de otra forma, la curva de la evolución de la enfermedad en el mundo sería distinta con las vacunas o sin ellas (Fig. 14).
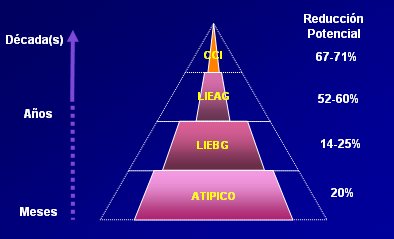
Figura 13: Impacto teórico de una vacuna para tipos HPV 16-18 (ATIPICO: Células escamosas atípicas de origen incierto; LIE BG/AG: lesión intraepitelial bajo/alto grado; CCI: Carcinoma cervical invasor.
 Tamaño completo
Tamaño completo En resumen, entre los métodos de lucha contra el Ca Cu están la prevención secundaria, la que está aceptada universalmente y consiste en el diagnóstico precoz de las lesiones preinvasoras, mediante un método masivo de tamizaje (el PAP) en la población femenina expuesta y la terciaria que implica el tratamiento oportuno. Ambas han permitido reducir significativamente las tasas de mortalidad por cáncer cervical en países con infraestructura adecuada. Luego está la prevención primaria, que se encuentra en etapa de certificación y se basa en el desarrollo de una vacuna polivalente idealmente para los siete tipos virales relacionados con mayor frecuencia con el Ca Cu (16, 18, 45, 31, 33, 52 y 58), las vacunas disponibles sólo comprenden dos de estos. Con ella se brindaría protección efectiva a 87% de las mujeres vacunadas. Con una vacuna para los subtipos 16 y 18 que alcanzara una cobertura de 70% y una duración del efecto inmune de por vida, se esperaría obtener una dramática disminución (entre 67% y 71%) de la incidencia de Ca Cu invasor, pero todavía falta tiempo para corroborar esas condiciones (Fig. 13).