Congresos
← vista completaPublicado el 1 de junio de 2008 | http://doi.org/10.5867/medwave.2008.05.1744
Preeclampsia: nuevos conceptos sobre un problema antiguo
Preeclampsia: new concepts on an old problem
Resumen
Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el Congreso Conjunto de Nefrología, Hipertensión y Trasplante realizado en Pucón entre el 26 y el 29 de septiembre de 2007. El congreso fue organizado por las Sociedades Chilenas de Nefrología, Hipertensión y Trasplante. El presidente de la Sociedad Chilena de Nefrología fue el Dr. Alejandro Cotera, la secretaria ejecutiva fue la Dra. María Eugenia Sanhueza y la directora del curso precongreso fue la Dra. Gloria Valdés.
Introducción
Los trastornos hipertensivos del embarazo se pueden clasificar de varias formas. La clasificación que se utiliza en los Estados Unidos, que es muy fácil y sencilla, reconoce cuatro tipos:
- Hipertensión crónica o preexistente.
- Preeclampsia (PE) – eclampsia (E).
- PE agregada sobre hipertensión crónica: la condición que se asocia a hipertensión más grave durante el embarazo, con mayor morbimortalidad.
- Hipertensión gestacional: se define como la aparición de cifras elevadas de presión arterial, por primera vez, durante el embarazo, en ausencia de los otros signos y alteraciones de laboratorio que se observan en la PE.
Entre 30% y 50% de estas mujeres desarrollan PE a medida que el embarazo progresa; a las demás se las clasifica como hipertensas gestacionales. Las mujeres con hipertensión gestacional que no desarrollan PE tienen mayor riesgo de desarrollar hipertensión esencial más adelante. A diferencia de las mujeres con PE durante su primer embarazo, que generalmente no presentan hipertensión en embarazos sucesivos, la mujer con hipertensión gestacional a menudo presenta cifras de presión arterial elevadas en los embarazos posteriores. Por último, cabe señalar que es frecuente que este trastorno no aparezca en el primer embarazo, sino durante el tercero o cuarto.
Preeclampsia: características clínicas
Todas las PE presentan hipertensión, proteinuria y algunas veces valores anormales de creatinina, pero pueden ser causadas por numerosas etiologías. Por esto se deben considerar como un síndrome más que como enfermedad, pues se pueden desarrollar a través de múltiples mecanismos, en forma análoga a lo que ocurre con las glomerulonefritis, que pueden ser una nefropatía IgA, una glomeruloesclerosis focal y segmentaria o una glomerulonefritis membrano-proliferativa.
La PE se expresa clínicamente después de las 20 semanas y se caracteriza por: presión sanguínea elevada, definida de la misma manera que en una mujer no embarazada, es decir, cifras mayores a 140/90 mmHg; y proteinuria, definida como la excreción urinaria mayor de 300 mg/24 horas, cifra que dobla el valor normal de la mujer no embarazada. En cuanto a los síntomas, puede haber cefalea, alteraciones visuales, dolor en el hemiabdomen superior o en el pecho, edema de manos y cara y aumento súbito de peso.
En los exámenes de laboratorio, se observa un aumento moderado de los niveles plasmáticos de creatinina, entre 0,8 y 1,5 mg/dl. Se sabe que durante el embarazo aumenta la hemodinamia renal y por lo tanto la tasa de filtración glomerular y el flujo sanguíneo renal, por lo que la mujer sana embarazada tiene normalmente creatinina sérica baja, menor de 0,6 mg/dl; la mujer con PE suele tener aumentos leves, de 0,8 a 0,9 mg/dl, pero estas cifras probablemente representan una disminución de la tasa de filtración glomerular cercana a 30%. La PE también produce hiperuricemia mayor de 5,5 mg/dl, probablemente secundaria a alteraciones del flujo renal. Además hay proteinuria, como ya se dijo, e hipocalciuria menor de 150 mg/día, según lo publicado. En la variante HELLP (Hemolysis, ElevatedLiver Enzymes,Low Platelet) aparecen hemoconcentración (hematocrtito mayor de 36%), trombocitopenia (menos de 100.000) y enzimas hepáticas elevadas. Según la opinión de la mayoría de los obstetras, la variante HELLP representa una forma más grave de PE y con frecuencia constituye indicación de parto de urgencia.
Preeclampsia: epidemiología
En América del Norte, la PE se presenta en 1% a 7% de las mujeres sanas que esperan su primer hijo, pero la incidencia sube entre 10 y 50% en presencia de cuadros médicos preexistentes, como diabetes, hipertensión o enfermedad renal crónica. Por ejemplo, las mujeres con hipertensión esencial preexistente tienen un riesgo aproximado de 25% de desarrollar PE, cinco veces mayor que el riesgo de una mujer normotensa. Por otra parte, no se ha determinado si hay diferencias raciales en cuanto a la predisposición de las mujeres a desarrollar PE.
Las pacientes que presentan PE siempre preguntan si el cuadro se va a repetir en los siguientes embarazos; la respuesta no es fácil, ya que la tasa de recurrencia es muy variable, entre 5% y 65% y depende, en primer lugar, del motivo por el cual se desarrolló la PE y, en segundo lugar, del momento de aparición durante el embarazo. Cuando la PE se presenta en el segundo trimestre del embarazo, el riesgo de recurrencia es de 30% a 40%; si la paciente es portadora de una enfermedad renal crónica, con creatinina de 2,5 a 3 mg/dl, tiene 75% de probabilidades de desarrollar PE y, a menos que se realice un transplante renal, el cuadro se repetirá en los embarazos siguientes. Por lo tanto, es necesario tener clara la causa o el mecanismo de la PE en cada caso, para poder entregar una opinión y educar acerca de las recidivas futuras.
Un aspecto interesante para quienes estudian este trastorno es la relación entre PE y el riesgo de desarrollar enfermedades cardiovasculares en el futuro. Leon Chesley, hace treinta años, hizo un seguimiento durante treinta años a mujeres que habían tenido eclampsia y comprobó que no desarrollaron más cardiopatías que las mujeres controles sanas, pareadas por edad (1), aunque la conformación del grupo control en este estudio ha sido motivo de controversia. Se sabe que, tanto en los estudios de cohorte como en los estudios prospectivos controlados, la selección del grupo control es muy compleja. En la actualidad se sabe que la asociación de PE temprana y grave con parto de pretérmino es un factor de aumento del riesgo cardiovascular, tan importante como la diabetes. Los datos en los que se basa esta información provienen, en parte, de una amplia base de datos de distintos países del mundo en los cuales se ha podido seguir a las mujeres desde que tienen hijos hasta muchos años después. Según la evidencia disponible, la PE estaría relacionada con el desarrollo futuro de cardiopatía coronaria, accidente vascular encefálico e hipertensión.
Preeclampsia: factores de riesgo
Los factores de riesgo para este trastorno se agrupan en factores fetoplacentarios y maternos. Entre los factores fetoplacentarios se encuentran la gestación múltiple (mellizos o trillizos o más fetos) y el embarazo molar, en el cual hay aumento de la masa placentaria. En esta última no es necesaria la presencia de un feto y es la única situación en que se observa PE durante el primer trimestre de embarazo. Existe también un leve aumento del riesgo de PE cuando el padre ha causado en otra mujer un embarazo preeclámptico, factor que influye a través del genotipo fetal.
En cuanto a los factores de riesgo maternos, desde hace muchos años se sabe que las primíparas, las mujeres que sufren de hipertensión, diabetes o nefropatía tienen mayor riesgo de desarrollar PE. Recientemente se ha demostrado que las mujeres portadoras de síndrome metabólico, en especial las obesas, también tienen mayores probabilidades de desarrollar la enfermedad.
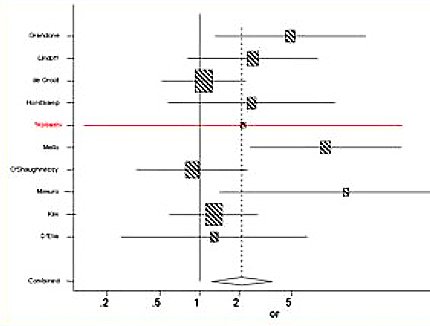
Otro aspecto que ha tenido una gran relevancia clínica y que ha cobrado importancia en los diez últimos años es la relación entre estados trombofílicos, sea genéticos o adquiridos, y la aparición de PE: las mujeres portadoras del factor V de Leyden, polimorfismo G20210A de la protrombina, síndrome antifosfolípido y otros trastornos trombóticos presentan alto riesgo de desarrollar PE temprana y grave. Las consecuencias terapéuticas de este hallazgo son muy importantes, ya que cuando se trata a estas mujeres con terapia anticoagulante generalmente responden bien y a menudo se puede prevenir la PE. Es una situación clínica compleja, ya que es difícil realizar estudios aleatorios y controlados en mujeres con este tipo de trastorno; en Canadá se intentó, pero los autores tuvieron muchas dificultades para reclutar a pacientes con trombofilias conocidas y más aún para separarlas en dos grupos, uno con tratamiento anticoagulante y otro sin tratamiento; es muy difícil hacer este estudio y es posible que nunca se logre obtener evidencia clínica de calidad en esta materia. Las mujeres portadoras del factor V de Leyden tienen, en promedio, dos veces más riesgo de desarrollar PE que las mujeres sin este trastorno (2) (Fig. 1). En general, todas las trombofilias genéticas, como el factor V de Leyden y la protrombina G20210A, aumentan el riesgo de PE por lo menos al doble.
 Tamaño completo
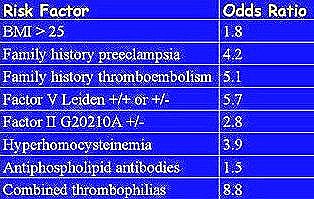
Tamaño completo En la Tabla I se observa un cuadro con algunos de los factores de riesgo de presentar PE grave, junto con la magnitud de su asociación, según lo publicado por Mello et al (3).
 Tamaño completo
Tamaño completo A pesar del gran avance logrado en los diez últimos diez años en el conocimiento de los mecanismos que explican este trastorno tan interesante y complejo, todavía no se logra determinar con certeza sus causas básicas, aparte del embarazo. Se ha estudiado a miles de mujeres, en estudios controlados y aleatorios, para evaluar numerosas estrategias preventivas, como el uso de aspirina, calcio, aceite de pescado, nitritos y antioxidantes, y ninguna de ellas ha demostrado eficacia en la población general de embarazadas. No existe otro tratamiento, fuera del parto, si bien una observación y manejo cuidadosos permiten ganar tiempo y prevenir algunas complicaciones graves. Todavía no es posible tratar este trastorno una vez que se ha presentado, pero al menos se puede rescatar al producto de la concepción, es decir, al feto, la principal víctima de este trastorno. En lugares donde hay buen control del embarazo, el niño, que nace en el segundo trimestre muchas veces debe permanecer por largo tiempo en las unidades de neonatología y tiene mayor riesgo de quedar con discapacidades por el resto de su vida. La PE y los trastornos hipertensivos del embarazo son la principal causa de parto prematuro en los Estados Unidos y, probablemente, en todo el mundo.
Preeclampsia: fisiopatología
Como ya se mencionó, se debe pensar en la PE como un síndrome del embarazo con dos componentes principales: fetoplacentario y materno. Es muy posible que el desarrollo de PE ocurra por una combinación de ambos componentes y que ninguno de ellos sea suficiente por sí solo para causar la enfermedad, lo que explica que no todas las mujeres con hipertensión desarrollen PE, ni siquiera las que tienen hipertensión grado 2 y que la predisposición materna, sea por hipertensión crónica, nefropatía o diabetes, no sea suficiente por sí sola para tener PE en el embarazo. Para esto se necesita que haya una vascularización anormal de la placenta.
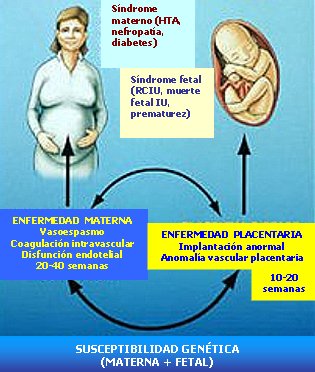
La Fig. 2 es un esquema muy simplificado de la fisiopatología de la PE. En ella se destaca el hecho de que, como cualquier trastorno complejo, existiría una susceptibilidad genética. Hace algunos años, cuando se comenzó a estudiar las enfermedades con métodos genéticos modernos, como los polimorfismos de nucleótido único o los estudios de ligamiento, se planteó que la PE se podría deber a la mutación de un gen aislado; hoy esa visión ha cambiado, pues se sabe que mecanismos diferentes pueden dar fenotipos muy semejantes. El proceso de placentación, que ocurre en etapas tempranas del embarazo (entre las semanas 10 y 20) puede presentar múltiples anomalías, cuyo progreso conduce al síndrome materno, que es de aparición tardía y se caracteriza por vasoespasmo, coagulación intravascular y disfunción endotelial. Si bien las manifestaciones de la enfermedad pueden aparecer desde la semana 20 en adelante, generalmente se presentan durante el último mes de embarazo, por lo general no antes de las dos últimas semanas.
 Tamaño completo
Tamaño completo La genética de la PE no es simple; los estudios familiares han demostrado que la incidencia aumenta en las parientes de primer grado, es decir, madre, hermanas, tías y primas de las mujeres que han tenido PE y que esto es válido no sólo para la familia materna, sino que la cuñada de una mujer, o la segunda esposa del ex marido de una mujer con PE también presentan mayor incidencia. Esto se debe a que la placenta, que es un órgano fetal y no materno, es el principal tejido que participa en la fisiopatología de la enfermedad, lo que complica aún más los estudios genéticos en PE.
El modo de herencia sugiere que se trata de una enfermedad multigénica, con contribución genética tanto materna como fetoplacentaria, según la evidencia aportada por modelos de PE en ratas. Se han identificado múltiples loci. Los trastornos trombóticos ya mencionados, como el factor V de Leyden, se pueden considerar factores epigenéticos, es decir, no tienen un rol protagónico dentro de la fisiopatología, sino que actúan como catalizadores del proceso, facilitando una presentación más temprana de la enfermedad.
Hay mucha evidencia básica, celular, clínica y epidemiológica acerca de la participación placentaria en la génesis de la PE:
- La PE ocurre sólo en el embarazo y mejora con el parto.
- Los modelos animales de reducción de la perfusión placentaria producen un cuadro similar. Si bien no existe un modelo natural de PE en animales, la reducción de perfusión uterina y otros modelos experimentales han llenado este vacío. Uno de los grandes problemas para estudiar este trastorno es que resulta muy difícil estudiar la placenta humana durante el embarazo, ya que ésta sólo se obtiene luego de que ha ocurrido el desastre, a las 39 semanas, después de nueves meses de misterio total.
- La incidencia de PE aumenta con los embarazos múltiples y el embarazo molar, es decir, cuando la masa placentaria es grande, lo que produce un desequilibrio entre el suministro vascular y la demanda.
- En comunicaciones publicadas en los últimos años se ha descrito que con la muerte del gemelo de menor tamaño in utero se resuelve la PE y el embarazo continúa sin trastornos para el otro gemelo.
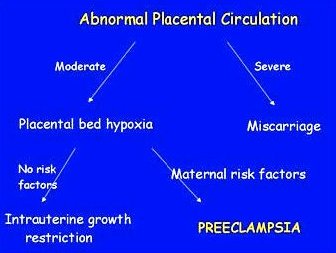
Las anomalías en la circulación de la placenta son la base de este trastorno. Actualmente se piensa que si las alteraciones vasculares placentarias son moderadas, el embarazo prosigue con la consecuencia de un lecho placentario hipóxico; si no hay factores de riesgo maternos de PE, el fenotipo resultante será de restricción de crecimiento intrauterino (RCIU), es decir, un niño más pequeño. En cambio, si hay factores de riesgo materno agregados a los que confiere una placenta hipóxica, se obtiene el fenotipo de PE. Si las anomalías vasculares de la placenta son catastróficas, el embarazo terminará en un aborto durante el primer o segundo trimestre (Fig. 3).
 Tamaño completo
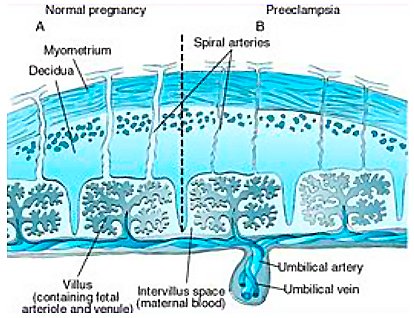
Tamaño completo La Fig. 4 es un esquema de la circulación útero-placentaria en un embarazo normal y preeclámptico; y en la Fig. 5 se ilustra la invasión citotrofoblástica de los vasos maternos: las arterias espiraladas, que son las ramas terminales de las arterias uterinas de la madre, durante un embarazo normal sufren transformaciones importantes para poder suministrar a la placenta y al feto la perfusión adecuada (Fig. 4).
 Tamaño completo
Tamaño completo 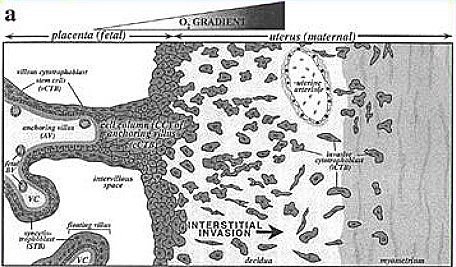 Tamaño completo
Tamaño completo En la PE, las arterias espirales no sufren estas transformaciones y permanecen estrechas, disminuyendo así la perfusión placentaria. Este hecho ha sido demostrado por un gran número de elegantes estudios efectuados en todo el mundo. En otras palabras, las arterias espirales no tienen la capacidad para experimentar la remodelación vascular normal, lo que conduce a isquemia útero-placentaria y provoca las manifestaciones clínicas y fisiopatológicas de la PE.
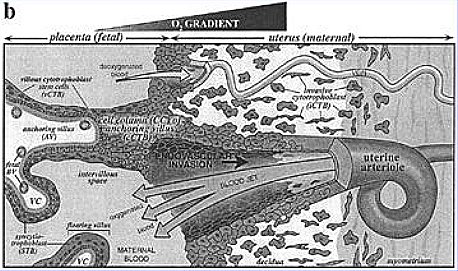
Algunos de los trabajos más adelantados en esta materia son los de Susan Fisher, quien ha estudiado el intrincado y complejo proceso de la formación del trofoblasto y la placenta. Su laboratorio ha trabajado para dilucidar los mecanismos que regulan la transformación de las arterias espirales en vasos sanguíneos dilatados, capaces de perfundir la placenta con un alto flujo. Lo que se sabe con certeza es que, en etapas muy tempranas del embarazo, las células trofoblásticas de la placenta migran hacia las arterias espirales, infiltran su pared y remplazan su endotelio, mediante una complicada transformación en que intervienen factores de adhesión celular (integrinas y cadherinas, entre otras moléculas); el resultado final es la dilatación de los vasos sanguíneos, con aumento de la perfusión hacia el feto y un estado hemodinámico adecuado al embarazo. El papel regulador de la hipoxia en este proceso todavía es motivo de discusión y estudio (Fig. 6).
 Tamaño completo
Tamaño completo En las mujeres que desarrollan PE, el proceso descrito no se desarrolla normalmente. No se sabe porqué se producen anomalías en la circulación útero-placentaria; algunos autores han propuesto que se podría deber a un aumento de la respuesta inflamatoria, secundaria a interacciones anormales entre las células natural killers del lecho uterino materno y un trofoblasto que no expresa el clásico antígeno HLA, sino los antígenos no clásicos HLA-C y HLA-G. Otros laboratorios buscan la respuesta en la expresión trofoblástica de moléculas de adhesión (integrinas y cadherinas). También se ha postulado como causa una alteración en la interacción ligando-receptor del factor de crecimiento vascular endotelial (VEGF), que ocurriría en las células del citotrofoblasto y del tejido uterino.
Relación entre enfermedad placentaria y enfermedad materna
Los mecanismos por los cuales la reducción de la perfusión placentaria produce la “toxemia” materna todavía son misteriosos. La noción que se tiene de esta enfermedad no es muy diferente de la que se tenía hace más de cien años, cuando se acuñó el término toxemia, pues se pensaba que había alguna toxina que ingresaba a la sangre materna y causaba la enfermedad. Hoy se postula algo semejante, pero se han dado distintos nombres a esta toxina: restos de sinciciotrofoblasto, especies reactivas del oxígeno, lipoperóxidos, citoquinas, leptina o factores antiangiogénicos, como el receptor soluble del receptor 1 de VEGF (Soluble Fms-LikeTtyrosine kinase 1, conocido como sFLT1) y endoglina. Todas estas sustancias podrían ser las responsables de unir la enfermedad placentaria con la materna.
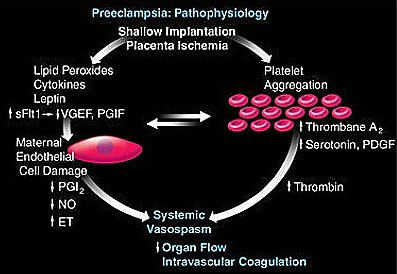
En la PE, el órgano blanco es la célula endotelial materna. Hay abundante información sobre la participación de varios mediadores en la disfunción endotelial: se ha observado disminución de los niveles de óxido nítrico y prostaciclina, aumento de tromboxano y endotelina e inhibición de la producción de VEGF. La Fig. 7 muestra un esquema de la fisiopatología de la enfermedad: tanto la implantación superficial como la isquemia placentaria hacen que se libere, hacia la circulación materna, una serie de factores que causan extenso daño endotelial materno; éste a su vez se refleja en vasoespasmo, hipertensión, disminución del flujo a los órganos y coagulación intravascular; además, aumenta la agregación plaquetaria, lo que acelera el proceso. El resultado neto es una condición que parece una enfermedad sistémica, pero en realidad es una disfunción endotelial extensa en una madre que presenta hipertensión, daño renal, dificultades de visión y que, en sus peores formas, cursa con daño hepático, consumo plaquetario o convulsiones.
 Tamaño completo
Tamaño completo Compromiso renal en la preeclampsia
El riñón de una mujer con PE presenta varias alteraciones importantes en su función y hemodinamia. La vasoconstricción hace que se supriman los componentes del sistema renina-angiotensina, a diferencia de lo que ocurre en un embarazo normal, en que este sistema se encuentra muy estimulado; también se observa disminución de la excreción de sodio y ácido úrico, junto con hipocalciuria y proteinuria. Las anteriores constituyen las anomalías más importantes desde el punto de vista de la función renal (Fig. 8).
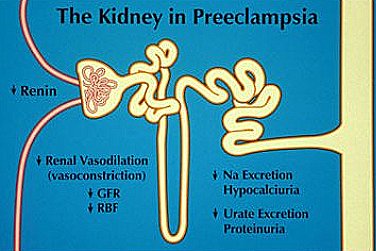 Tamaño completo
Tamaño completo En la histología, la PE se asocia a una lesión glomerular clásica que se conoce como endoteliosis glomerular y se manifiesta por un glomérulo sin sangre, con cierto grado de depósitos de fibrina y tumefacción endotelial, sin gran aumento de la celularidad (Fig. 9).
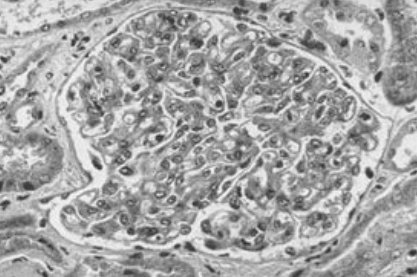 Tamaño completo
Tamaño completo Una línea de investigación actual interesante es el estudio de los factores antiangiogénicos solubles, tema que han desarrollado de manera exhaustiva investigadores del Hospital Beth Israel, en Boston, con los primeros trabajos publicados por Maynard y Karumanchi. La Fig. 10 resume los resultados de uno de estos trabajos, en el cual los autores crearon un modelo animal caracterizado por la sobreexpresión de uno de estos factores antiangiogénicos solubles, el sFlt-1 que actúa inhibiendo al VEGF. Se puede ver que la presión arterial de los animales aumenta luego de la transfección del gen que codifica sFlt-1, y además aparece proteinuria. Sin embargo, uno de los datos más interesantes de este trabajo es que en los animales que recibieron un exceso de sFlt-1, fueran hembras preñadas o no, se reprodujo la lesión de endoteliosis glomerular que se observa en mujeres con PE. Este modelo es el primero que aportó evidencia a la asociación entre la enfermedad placentaria, los productos en la sangre y la nefropatía, ya que es precisamente en la placenta donde se produce el sFlt-1. Este fenómeno es similar al que ocurre cuando se administra terapia anti VEFG a pacientes con cáncer, los que desarrollan hipertensión, proteinuria y una lesión renal muy parecida a la endoteliosis glomerular. Esta es otra evidencia que sustenta el concepto de que el desequilibrio entre los factores proangiogénicos y los factores antiangiogénicos participa en la fisiopatología de esta enfermedad (Fig. 10).
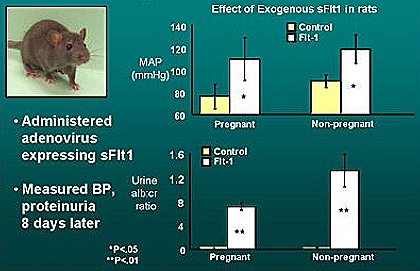 Tamaño completo
Tamaño completo En un estudio clínico publicado en The New England Journal of Medicine, el mismo grupo (4) demostró disminución en los niveles urinarios del factor de crecimiento placentario (Placental Growth Factor, PIGF), que es un factor proangiogénico, en mujeres con preeclampsia grave (Fig. 11). Esto puede ser útil desde el punto de vista de la monitorización de las mujeres que tienen este trastorno, que se podría llevar a cabo mediante la medición de dichos factores proangiogénicos en sangre u orina. Tanto el grupo del Hospital Beth Israel como otros grupos en el mundo se encuentran investigando activamente la posible utilidad de estos factores para predecir la aparición de PE.
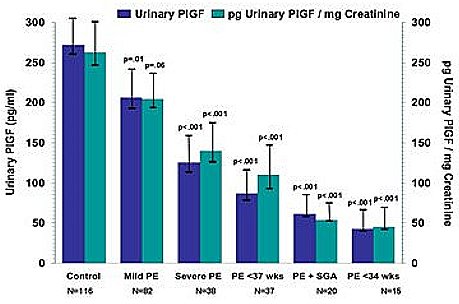 Tamaño completo
Tamaño completo Prevención de la preeclampsia
Como ya se mencionó, se sabe que los principales factores de riesgo maternos para PE son la hipertensión, la asociación con otros factores de riesgo para hipertensión, como obesidad, síndrome metabólico y diabetes, la enfermedad renal y las trombofilias. Sin embargo, pese a todos los intentos de encontrar un marcador predictivo, la gran mayoría de los tests bioquímicos y clínicos por sí solos no tienen la sensibilidad ni la especificidad suficientes para predecir la PE. Es probable que en el futuro se encuentre alguna combinación de variables que logre cumplir los criterios necesarios para transformarse en un índice predictivo confiable. Por otra parte, muchos se preguntan si es realmente importante predecir una enfermedad en la que no se puede hacer nada; por lo tanto, las iniciativas en cuanto a predicción se deben enfocar en los resultados adversos y no tanto en predecir simplemente el síndrome clínico materno.
En cuanto a la prevención, se han intentado numerosas estrategias, entre ellas, la suplementación con calcio, preconizada ya hace 90 años, en el libro de obstetricia de Williams que recomendaba una dieta rica en calcio para prevenir la eclampsia. Hoy, la literatura clínica, bioquímica y fisiológica contiene muchas evidencias que respaldan la noción de que la deficiencia de calcio es perjudicial para el embarazo y que una dieta insuficiente en calcio puede aumentar el riesgo de PE.
En un estudio clínico de nuestro grupo, controlado y aleatorio, se evaluó la suplementación con calcio en mujeres con alto riesgo de PE, específicamente en mujeres con hipertensión arterial esencial preexistente. Se incluyó a 116 mujeres, de alrededor de 30 años de edad, en promedio, la mayoría de ellas con sobrepeso, que se asignaron a dos grupos de 58 mujeres cada uno; un grupo recibió 2 g diarios de calcio y el otro, un placebo. No se logró prevenir la preeclampsia ni retardar su aparición, ni hubo diferencias entre los dos grupos, en cuanto a sobrevida; pero se logró identificar anomalías tempranas, a las 13 y 20 semanas de embarazo, que predecían el desarrollo posterior de PE agregada. Los principales predictores de PE fueron el nivel de ácido úrico mayor de 3,6 mg/dl, la presión sistólica mayor de 140 mm Hg y actividad de renina plasmática menor de 4 ng/ml/hora. En presencia de las tres condiciones señaladas, el riesgo de PE sobreagregada llegó a 90%.
Estos resultados, más que constituir una herramienta clínica útil, pueden ayudar a entender las características fisiopatológicas de la enfermedad. En primer lugar, es interesante que la hiperuricemia sea también un marcador de riesgo cardiovascular; por otro lado, es posible detectar vasoconstricción y la presión sanguínea elevada tan precozmente como a las 20 semanas, antes de que se desarrolle la PE sobreagregada. Por último, los resultados de este trabajo sugieren que en el riñón ocurren anomalías sutiles y tempranas que se manifiestan por hiperuricemia, leve aumento de las proteínas en la orina y alteraciones en la regulación de la paratohormona (PTH) y la vitamina D.
Las consecuencias para el tratamiento todavía no están claras; pero este estudio permite plantear las siguientes preguntas:
- Si la presión arterial se encuentra elevada más temprano en las hipertensas que desarrollan PE ¿sería beneficioso disminuirla para prevenir la enfermedad?
- ¿Se debe proporcionar terapia vasodilatadora a estas mujeres en las etapas precoces del embarazo?
- ¿Cuál es el significado y las consecuencias terapéuticas de la hiperuricemia en la PE?
Es evidente que aún queda mucho que aprender sobre este trastorno, a pesar de los grandes avances que se han logrado durante los veinte últimos años.

