Congresos
← vista completaPublicado el 1 de agosto de 2005 | http://doi.org/10.5867/medwave.2005.07.708
Insulinoterapia intensiva
Intensive insulin therapy
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del IV Congreso Asociación Chilena de Nutrición Clínica, realizado en Santiago entre los días 28 al 30 de abril de 2005. El evento fue organizado por la Asociación Chilena de Nutrición Clínica.
Presidente Asociación Chilena de Nutrición Clínica: Dra. Julieta Klaassen.
Edición Científica: Dra. Eliana Reyes.
Introducción
Este tema ha tenido una interesante evolución histórica, iniciada hace mucho tiempo, hasta llegar al estado actual. El enfoque de la hiperglicemia en el paciente crítico cambió a partir del estudio publicado en 2001 por Van den Berghe y durante los últimos años, la investigación se ha enfocado hacia la fisiopatología. Es decir, una vez que se demostró la utilidad del control de la hiperglicemia en el paciente crítico, surgió la necesidad de investigar el mecanismo fisiopatológico que sustenta los resultados que mostró dicho estudio.
Antecedentes históricos
En 1877, Bernard describió la hiperglicemia en situación crítica y observó que durante un shock hemorrágico podía presentarse hiperglicemia, incluso en pacientes no diabéticos. Desde entonces han aparecido numerosas publicaciones relativas a hiperglicemia y situación crítica, y actualmente esta asociación no se discute. Por ejemplo, hasta 75% de los pacientes con infarto del miocardio y hasta 50% de los pacientes con sepsis desarrollan hiperglicemia, cuyos mecanismos subyacentes serían la insulinorresistencia y la intolerancia a la glucosa.
En Lovaina, la Dra. Greet Van den Berghe (Figura 1) revolucionó y cambió el manejo de la hiperglicemia, basándose en los datos estadísticamente significativos que obtuvo en su estudio, publicado en 2001 en el New England Journal of Medicine. Antes de su aporte se consideraba que la hiperglicemia era un mecanismo adaptativo frente a una situación crítica, la que exigía mayor cantidad de sustrato, pero este concepto fue desechado y hoy en la mayoría de las publicaciones se trata de explicar por qué la normoglicemia produce una evolución tan favorable.
 Tamaño completo
Tamaño completo Figura 1. Figuras históricas de la insulinoterapia intensiva.
Persiste el temor a la hipoglicemia, porque los algoritmos de manejo no están implementados en todas partes, pero Van den Berghe, en su trabajo, comprobó que la hipoglicemia era un problema de baja incidencia y fácil manejo. Si se revisa en detalle los resultados de varias publicaciones, se puede comprobar que controlar esta complicación es muy fácil si se implementa los protocolos de infusión y se cuenta con apoyo adecuado de enfermería.
En el 2004 se publicó un análisis de la evidencia disponible acerca de las cinco medidas que han mejorado significativamente el enfoque y el tratamiento del paciente crítico, entre las cuales se cuenta el control glicémico estricto; según la medicina basada en la evidencia, ésta debe ser una medida estándar de manejo (Anestesia & Analgesia, 99(2):566-572, 2004).
Evidencias sobre control de la glicemia en el paciente crítico
Varios trabajos cambiaron el enfoque del paciente crítico y condujeron a disminuir cada vez más las glicemias. Desde la década 1970 hasta la actualidad se han publicado más de 300 estudios al respecto, por lo cual es difícil elegir los más significativos. Los primeros trabajos que llamaron la atención respecto a la necesidad de un mejor control glicémico se realizaron en pacientes diabéticos infartados; posteriormente se descubrió que este control también debe realizarse en pacientes no diabéticos.
Hay trabajos antiguos, como el que publicó Sodi-Pallares (1962), quien diseñó la solución GIK (glucosa, insulina y potasio) y observó que su administración en pacientes diabéticos infartados provocaba disminución de las extrasistolías ventriculares, una de las principales arritmias causantes de la muerte en pacientes con infarto; además, mejoraba la sobrevida precoz. Estos trabajos iniciales tenían muchos elementos criticables desde el punto de vista estadístico, pues aún no se había creado el concepto de la medicina basada en la evidencia, pero dieron luz sobre los beneficios y la necesidad del control glicémico.
Para explicar y fundamentar sus resultados, los mismos autores demostraron, en escala experimental, que en este grupo de pacientes había mejoría en la función sistólica y diastólica, y vasodilatación coronaria del miocardio isquémico; plantearon entonces que este resultado se debía a que el miocardio necesitaba ser alimentado y que la solución aumentaba el sustrato, el flujo glicolítico y la síntesis de ATP; además, disminuía el nivel de ácidos grasos libres, los que, según se demostró posteriormente, pueden aumentar la extensión de un infarto agudo de miocardio. Este concepto ahora está establecido y aceptado en la mayoría de las unidades coronarias, las que aún utilizan esta solución (Effects of an intravenous infusion of a potassium-glucose-insulin solution on the electrocardiographic signs of myocardial infarction: a preliminary clinical report. Sodi-Pallares, Am J Cardiol; 9:166-281, 1962).
En el estudio DIGAMI (Diabetes and Insulin-Glucose infusion in acute Myocardial Infarction) se utilizó solución de glucosa e insulina en alrededor de 600 pacientes diabéticos con infarto agudo de miocardio, que fueron distribuidos en forma aleatoria para recibir la solución GIK de manera precoz y después del alta, recibir tratamiento con múltiples dosis de insulina durante 3 meses, con el fin de lograr un buen control glicémico.
Los autores demostraron que este manejo redujo la mortalidad en 29% a largo plazo, la que fue evaluada al año, a los tres y a los cuatro años después de terminado el estudio (Malmberg, J Am Coll Cardiol, 1995; 26:57-65). Además este trabajo demostró que en un paciente diabético infartado, el estado glicometabólico al ingreso, entendido como la hemoglobina glicosilada y la glicemia en el momento del ingreso, constituye un predictor independiente de mortalidad. Aunque en estos estudios de mediados de la década de 1990 se plantearon objetivos más altos de glicemia y de hecho, la solución GIK se iniciaba con glicemias sobre 215 mg/dl, hubo resultados significativos a largo plazo, pero no en las complicaciones inmediatas.
En un trabajo de Furnary y su grupo participaron pacientes diabéticos tipo 1 y tipo 2 sometidos a cirugía cardiaca, divididos en forma aleatoria en dos grupos: uno recibió esquema convencional, con insulina cristalina según escala; el otro recibió infusión continua de insulina. La glicemia objetivo fue de 150 a 200 mg/dl y se observó una reducción significativa de 58% en la incidencia de infección de la herida esternal, secundaria a la cirugía cardíaca, que fue de 2% en el grupo convencional versus 0,8% en el grupo de infusión continua de insulina (Continuous intravenous insulin infusion reduces the incidence of deep sternal wound infection in diabetic patients after cardiac surgical procedures. Furnary, Ann Thorac Surg 1999; 67:352-360)
Por otra parte, los trabajos relativos a accidente vascular encefálico (AVE) publicados entre las décadas de 1980 y 1990 son numerosos y, en general, demuestran que la hiperglicemia se asocia con progresión del infarto cerebral y conversión hemorrágica de un AVE, lo que justifica el control de la hiperglicemia, la que además disminuye el éxito de una recanalización. De hecho, durante las primeras 72 horas, los pacientes con accidente vascular encefálico se deben manejar con solución fisiológica, porque así mejora su pronóstico (Stroke, 2004; 25:363).
Por último, el trabajo de Van Den Berghe marcó un hito en el manejo del paciente crítico, respecto a la medicina basada en la evidencia; en él participaron 1.548 pacientes de una UCI quirúrgica, que fueron divididos al azar en dos grupos: 60% de ellos eran pacientes de cirugía cardíaca y los restantes habían sido sometidos a otras cirugías; sólo 13% eran pacientes diabéticos. A un grupo llamado “convencional” se le administró infusión de insulina en solución fisiológica, a razón de 1 unidad/cc, con un objetivo de glicemia entre 150 y 200 mg/dl; la infusión se iniciaba con glicemias sobre 200 mg/dl. Al otro grupo se le administró un tratamiento intensivo, en el cual se iniciaba la insulina con glicemias superiores a 110 mg/dl, con una glicemia objetivo entre 80 y 110 mg/dl.
Los resultados fueron claramente significativos en cuanto a reducción de mortalidad, insuficiencia renal, necesidad de diálisis, bacteremia, necesidad de transfusiones y polineuropatía (Figura 2), todas ellas complicaciones que en la antigüedad eran de muy mal pronóstico para el paciente crítico. Se encontró sólo 5% de hipoglicemias, cuyo manejo fue fácil, con un porcentaje mínimo de glicemias inferiores a 40 mg/dl (Intensive insulin therapy in critically ill patients. Van Den0Berghe, NJEM 345(19):1359-1367, 2001).
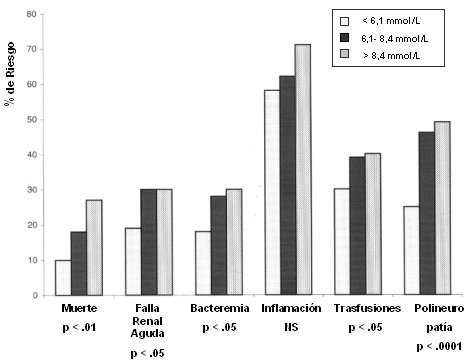 Tamaño completo
Tamaño completo Figura 2. Insulinoterapia intensiva en pacientes críticos (Van Den Berghe, NJEM 345(19):1359-1367, 2001).
Desde entonces nadie objeta estos resultados y, por lo mismo, no se ha replicado este trabajo, pero el mismo grupo empezó a preguntarse si los resultados obtenidos fueron efecto de la glicemia en sí o de la infusión de insulina.
Fisiopatología
La Figura 3 es un esquema simplificado del receptor de insulina y sus vías. A nivel molecular, la insulina debe unirse a la subunidad alfa extracelular, con lo cual se genera un cambio estructural; una porción de la subunidad beta, que está en el intracelular y tiene actividad tirosinaquinasa, origina autofosforilación y se abren dos vías de acción de la insulina. La primera es mediada por la fosfoinositol 3 quinasa (PI3K); ella interactúa con un grupo de proteínas que son sustrato para el receptor de insulina y que generan varias acciones metabólicas, por lo que a esta enzima se la llama “señal metabólica”. La otra vía es mediada por la MAP quinasa (MAPK), también conocida como “señal de crecimiento”.
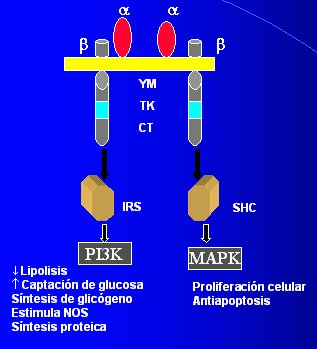 Tamaño completo
Tamaño completo Figura 3. Receptor de insulina y vías.
Los investigadores se han dedicado a la búsqueda de mediadores y se discute si la mejoría que originan los protocolos se debe a disminución de la resistencia propiamente tal, con mejoría en la captación o si es secundaria al control de la producción de glucosa a nivel hepático. La Figura 4 esquematiza la interrelación que existiría entre todos estos mecanismos para llegar a causar la hiperglicemia.
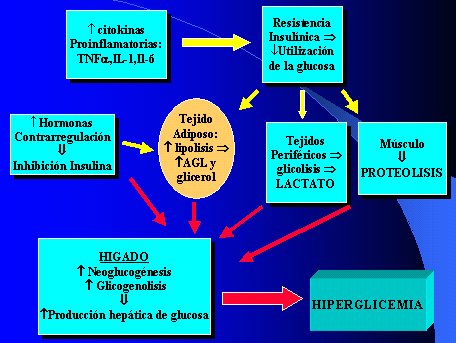 Tamaño completo
Tamaño completo Figura 4. Mecanismos de producción de hiperglicemia en el paciente crítico.
Las hormonas de contrarregulación son las catecolaminas, que actúan en la fase aguda y ejercen su acción hiperglicémica por antagonismo de la acción de la insulina, a las tres horas de ocurrida la lesión, porque actúan sobre la célula beta y disminuyen la liberación; también inhiben al grupo de proteínas que son sustrato para el receptor de insulina. Además, la hormona de crecimiento en dosis alta disminuye el número de receptores e inactiva la señal hacia el intracelular; el cortisol actúa fundamentalmente en el glucotransportador 4 (GLUT 4), transportador necesario para que la glucosa ingrese por difusión facilitada a los tejidos insulinosensibles. Las citoquinas proinflamatorias también perjudican la acción de la insulina y, derivados de la misma situación, ciertos sustratos ocasionan aumento de la producción hepática de glucosa. Las catecolaminas también pueden estimular la glicogenolisis.
El mediador más estudiado es el Factor de Necrosis Tumoral (TNF) alfa, que es capaz de potenciar la liberación de las hormonas de contrarregulación; inhibe la tirosinaquinasa del receptor de insulina; altera la translocación del GLUT 4; inhibe la enzima relacionada con la señal metabólica PI3K e inhibe la señal de crecimiento (MAPK).
Consecuencias de la hiperglicemia en el paciente crítico
Función inmune. Disminuye la adherencia de los granulocitos, la quimiotaxis y la fagocitosis; aumenta los superóxidos; altera la activación del complemento y puede producir glicosilación no enzimática de las inmunoglobulinas, todo lo cual se traduce en un alto riesgo de infección. De hecho, en el trabajo de Van den Berghe se observó una reducción significativa (46%) de las bacteremias en los pacientes con normoglicemia.
Disfunción endotelial. En un estudio que se publicó en 2005, se observó que la disponibilidad de óxido nítrico está disminuida debido a que la óxido nítrico sintetasa, responsable de su síntesis, está inhibida por la dimetil arginina, mediador que, según se ha demostrado, está muy aumentado en los pacientes críticos; lo anterior se debe a que la hiperglicemia inhibe la enzima responsable de su degradación, que es una hidrolasa (Siroen, Critical Care Med 33(3):504-510, 2005). En un estudio se demostró que la dimetil arginina es un predictor de mortalidad; su presencia aumenta 17 veces el riesgo de mortalidad en los pacientes críticos. Este mediador se genera porque se metilan residuos de arginina en proteínas y frente a una situación de catabolismo como es el paciente crítico, este producto se libera y altera el tono vascular (con el consiguiente compromiso de la perfusión tisular), altera la interacción del endotelio con los leucocitos y las plaquetas y disminuye la perfusión miocárdica.
Glucotoxicidad celular. Dentro de lo que se sabe hoy sobre la fisiopatología del estrés, se habla de alteraciones del metabolismo celular, hipoxia citotóxica y todos los mediadores que influyen en una evolución desastrosa, cuando no se controla los factores responsables. El concepto de control de la glicemia, propugnado por el grupo de Van den Berghe, tiene por objeto evitar la sobrecarga celular de glucosa en los tejidos que no dependen de la insulina, como el sistema nervioso central y periférico, las células endoteliales, inmunes, etc.
Este problema se presenta porque la entrada de glucosa está facilitada por los transportadores GLUT 1 y GLUT 3, causantes del ingreso de glucosa en los tejidos, independientes de insulina. Además, al aumentar la glucosa intracelular aumenta el piruvato y aumentan a su vez los superóxidos, los que van a interactuar con el óxido nítrico, a pesar de su disponibilidad disminuida, y generar pernitritos, es decir, hay efectos tóxicos en la fosforilación oxidativa (Van Den Berghe, J Clin Invest,114:1187-1195, 2004).
Protocolos para manejo de hiperglicemia
Durante los últimos cinco años se ha publicado por lo menos 6 protocolos, pero el original del grupo de Van den Berghe es el más sencillo. La clave es la monitorización frecuente, con la cual se evitan las hipoglicemias, porque si es necesario se puede suspender con rapidez la infusión de insulina y administrar glucosa endovenosa en las dosis sugeridas para corregir la glicemia.
La infusión se inicia con niveles sobre 110 mg/dl, se controla en forma horaria y los controles se distancian cuando se han logrado los objetivos en tres controles consecutivos, lo que según lo publicado, se logra a las 24 horas, luego de administrar 70 unidades diarias de insulina, en promedio. Este protocolo, que se resume en la Tabla I es muy fácil de implementar y no necesita gran infraestructura.
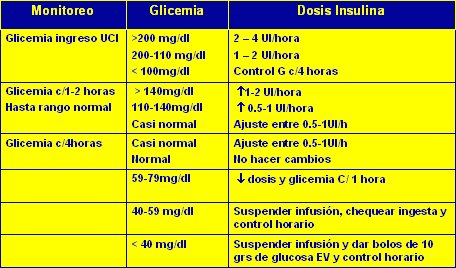 Tamaño completo
Tamaño completo Tabla I. Protocolo de infusión de insulina del grupo de Van den Berghe.
La Tabla II resume un segundo protocolo, diseñado por el grupo canadiense de Brown y Dodeck, en el cual, aparte de la infusión propiamente tal, se agregan bolos frente a descompensaciones. También realizan un monitoreo horario de glicemia capilar, hasta lograr los objetivos. Este grupo inicia sus infusiones con niveles más altos de glicemia.
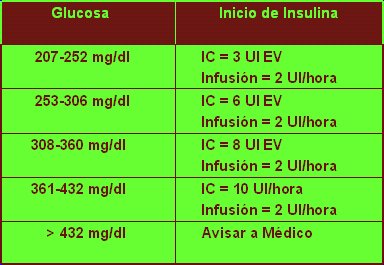 Tamaño completo
Tamaño completo Tabla II. Protocolo de infusión de Brown y Dodeck (Crit Care Med 2001;29(9):1714).
Requisitos para implementar un protocolo
Beneficios del control de la hiperglicemia
Los beneficios observados tendrían una explicación multifactorial, pero al analizar la fisiopatología, los efectos de la insulina derivados de sus propiedades anabólicas permiten explicar en gran parte los buenos resultados que se describen en estudios multivariados, respecto a la disminución de la necesidad de transfusiones y de diálisis, además de la prevención de la polineuropatía del paciente crítico, que es la que mantiene al paciente en ventilación mecánica por más tiempo. Esta es una gran área de investigación, porque además de querer explicar por qué ocurre, en forma simultánea podría servir para determinar aquellos mediadores de la inflamación que podrían servir como predictores.
Otro grupo de efectos de la insulina son los secundarios a la supresión de mediadores inflamatorios, como el TNF alfa y el factor inhibitorio de la migración de macrófagos, además de disminuir los aniones superóxidos, el factor intranuclear kappa beta (muy relacionado con la estimulación de producción de sustancias inflamatorias), la PCR y la lectina ligante de manosa, que está relacionada con la respuesta inmune, sobre todo la lectina C, cuyo nivel normal oscila entre 1000 y 2000 ug. Esta molécula se une a azúcares reducidos en las membranas de los microorganismos; en los pacientes críticos sus niveles están reducidos a menos de 500 ug. El grupo de Van den Berghe demostró que en los pacientes tratados con el esquema de insulina intensiva aumentan los niveles de la lectina ligante de manosa.
La insulina también disminuye los ácidos grasos libres; además el grupo de Van den Berghe demostró que el tratamiento intensivo, versus el convencional, se asociaba con una disminución significativa de la Dimetilarginina (DMA), aunque no fue posible determinar causalidad, y que, en consecuencia, se normalizaba el óxido nítrico. Por otra parte, en el paciente crítico está aumentada la proteína ligante de IGF-1, que es el mediador de los efectos anabólicos de la hormona de crecimiento, y la insulina logra disminuirla y normalizar o aumentar el nivel de IGF-1. Además, la insulina normaliza el perfil lipídico, que en los pacientes críticos es similar al del paciente diabético tipo 2; es decir, los pacientes críticos presentan aumento de triglicéridos y VLDL, y disminución de HDL.
Se ha visto que las lipoproteínas son barredoras y capaces de procesar endotoxinas; las infusiones de insulina también cumplirían un papel en tal sentido. También se ha demostrado que aumenta el GLUT-4 y así mejora la captación celular en los tejidos insulinosensibles a glucosa y disminuyen las metaloproteinasas relacionadas con la diseminación de la inflamación a nivel endotelial. La Figura 5 es un gráfico extraído del trabajo de Van den Berghe publicado en 2005, que demuestra que en las personas que no sobrevivieron los niveles de DMA eran más altos.
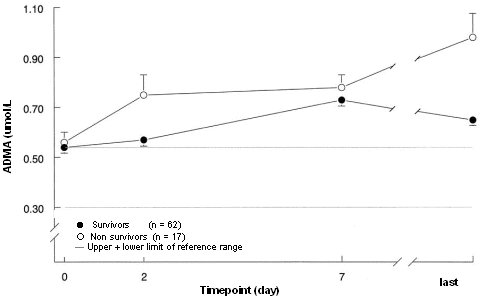 Tamaño completo
Tamaño completo Figura 5. DMA y tratamiento intensivo de insulina.
Conclusiones
La investigación se centra en descubrir nuevos mediadores biológicos para explicar de manera fehaciente cuáles son los orígenes últimos de estos beneficios; además, la mayoría de los trabajos publicados se realizaron en UCI quirúrgica y se debe investigar si los resultados son válidos en la UCI médica. En varios estudios los resultados no han sido tan beneficiosos, quizás por diferencias en el tipo de pacientes. No es lo mismo una persona joven que ingresa por un distrés respiratorio secundario a una neumonía, que un paciente diabético deteriorado.
Hay que controlar en forma estricta la glicemia en pacientes diabéticos y no diabéticos sometidos a una situación crítica, mediante protocolos adecuados. Los mejores protocolos son los que se pueden implementar y seguir en forma estricta en los hospitales, con el apoyo del equipo de enfermería y de la dirección, lo que permitirá reproducir los resultados del grupo belga.
La iniciativa y el apoyo del equipo de enfermería es el primer requisito. La Universidad de Yale reconoció que recién instauró un protocolo en 2004, porque significa una gran sobrecarga de trabajo para el personal de enfermería, aunque la Unidad de Cuidados Intensivos del Hospital de New Haven, que corresponde a la Universidad de Yale, dispone de una enfermera por paciente o de una enfermera por cada dos pacientes.
La monitorización frecuente de glicemia capilar es muy importante, pero su realización suele ser difícil. En el grupo de Van den Berghe se hace con sangre arterializada, pero lo que se utiliza es glicemia capilar y las cintas tienen un costo relativamente elevado. La intervención precoz frente a hipoglicemia debe realizarse con un algoritmo escrito.
Antes los protocolos eran muy rígidos, porque consideraban el valor absoluto de glicemia; el éxito de los protocolos actuales está relacionado con la velocidad de cambio de la glicemia, entre una glicemia y la siguiente y la velocidad de infusión de insulina.

