Congresos
← vista completaPublicado el 1 de julio de 2004 | http://doi.org/10.5867/medwave.2004.06.962
La anemia y las transfusiones en las unidades de tratamiento intensivo
Anemia and transfusions in intensive care units
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XXI Congreso de Medicina Intensiva, realizado en Pucón entre los días 5 al 8 de noviembre de 2003. El evento fue organizado por la Sociedad Chilena de Medicina Intensiva.
Presidente: Dr. Enzo Sáez.
Secretario General: Dr. Sebastián Ugarte.
Definición de anemia
Según una investigación realizada en 284 Unidades de Tratamiento Intensivo (UTI) de 213 hospitales estadounidenses, sólo 19% de ellas contaban con un protocolo, un criterio o un procedimiento documentado con respecto al uso de transfusiones, lo que probablemente se debe a la gran confusión en torno a la definición de “anemia” (1).
Un conocido texto de medicina interna describe esta entidad como “toda afección del paciente en que el nivel de hemoglobina o el número de glóbulos rojos circulantes está reducido” (2). Esta definición es muy vaga y no entrega ninguna pauta ni referencia para determinar con objetividad la presencia de anemia, sino que delega la responsabilidad a la intuición o experiencia personal del internista o del médico tratante.
Etiología de la anemia en pacientes críticos (3, 4, 5, 6)
Las causas más importantes son, en orden de importancia:
- Pérdida de sangre, ya sea por cirugía o trauma.
- Reducción de la vida media de los eritrocitos, que puede deberse a diversas causas.
- Eritropoyesis insuficiente, o sea, insuficiente producción de glóbulos rojos.
- Complicaciones propias del paciente hospitalizado en UTI, como la sepsis, que se asocia con producción disminuida de glóbulos rojos, pérdida no detectada de sangre por hemorragias internas, flebotomías frecuentes con fines diagnósticos, etc.
- Producción disminuida de eritropoyetina endógena junto con una deficiencia funcional del hierro asociada con un trastorno inmunológico, y una respuesta disminuida a la eritropoyetina.
Por lo tanto, la alta incidencia de anemia en los pacientes de UTI tiene múltiples explicaciones. En un estudio realizado en Europa en 1.136 pacientes hospitalizados en UTI, para determinar la cantidad de sangre extraída diariamente por flebotomía con el fin de efectuar exámenes de laboratorio, se comprobó que a 46% de los pacientes se le había tomado entre 5 y 6 muestras de sangre por día, y que la cantidad promedio de sangre extraída para análisis era de 41,1 ml/paciente/día (7).
Corwin hizo un estudio similar en los Estados Unidos y observó que las cantidades de sangre extraídas por día en las UTI de ese país variaban aún más que en la investigación anterior y oscilaban entre 40 ml y 70 ml al día. Además, hizo otra observación interesante: los pacientes que necesitaron mayor número de transfusiones fueron los mismos a quienes se les extrajo mayores cantidades de sangre con fines de análisis (8).
La anemia de los pacientes con enfermedades críticas se puede deber también a una baja producción de eritrocitos; muchos de ellos sufren un proceso inflamatorio que induce una respuesta eritropoyética disminuida en condiciones de baja concentración de hemoglobina. En otras palabras, los pacientes no tienen su propia producción normal de eritropoyetina endógena al bajar el nivel de hemoglobina (1, 8, 9).
Se ha demostrado que los procesos inflamatorios afectan la producción de IL-6, TNF alfa e IL-1, y que estos tres mediadores inflamatorios inhiben las células precursoras de los eritrocitos y reducen la producción de eritropoyetina por inhibición de su transcripción genética; así, son una de las principales causas de que los pacientes en UTI sean anémicos (10).
Otro mecanismo que explica la anemia de los pacientes graves es la deficiencia funcional de hierro, asociada con trastornos inmunes. Los pacientes tienen reservas suficientes de este mineral, pero ellas no están disponibles para la producción de glóbulos rojos, lo que se traduce en una formación morfológica alterada de los glóbulos rojos, con gran activación de las células T, elevada concentración de proteína C reactiva y secuestro de hierro por parte de los macrófagos, de modo que el mineral se encuentra en el organismo, pero no está disponible (11, 12, 13).
De lo expuesto se deduce que la anemia del paciente de la UTI es muy parecida a la anemia del enfermo crónico y se caracteriza por una pobre transferencia de hierro o saturada, con concentraciones de hierro normales. En definitiva, como ya se dijo, hay hierro en el organismo, pero no está disponible para la producción de glóbulos rojos.
La cascada de episodios que forman parte del desarrollo de anemia se resume en el siguiente esquema (véase Figura 1):
 Tamaño completo
Tamaño completo Figura 1. Desarrollo de la anemia en pacientes críticos.
Indicación de transfusión en enfermos críticos
Uno de los motivos por los que se indican transfusiones en los pacientes críticos, es la presencia de anemia en el momento de ingresar a la UTI. En un estudio reciente, publicado en JAMA en 2002 y realizado en 3.534 pacientes de UTI, se encontró que la Hb media al ingreso era de 11,3 g/dl, lo que significa que muchos pacientes ya estaban anémicos en ese momento. En 63% de los casos, los pacientes tenían menos de 12 g/dl de Hb, valor que en muchos centros se considera límite para declarar una anemia. Un 29% tenía anemia aún más severa con 10 g/dl en el momento del ingreso (14).
El investigador responsable de esta investigación se preguntó también por qué se indicaban las transfusiones en la UTI, y comprobó ciertas pautas indicadoras. Los pacientes que recibían mayor número de transfusiones eran generalmente los más enfermos, los que habían permanecido en la unidad por más tiempo, los que llevaban más días en ventilador y, además, los que llegaban en estado anémico (30% de hematocrito o menos).
Según dos grandes estudios publicados recientemente, el ABC (Anemia and blood transfusion in the critically ill) en Europa y el CRIT (Anemia and blood transfusion in the critically ill - Current clinical practice in the United States) , dirigido por Corwin en los Estados Unidos, la práctica de la transfusión muestra cifras similares en América y Europa; en ambos lugares, 37% a 44% de los pacientes ingresados a una UTI son transfundidos al bajar el nivel de hemoglobina a 8,4 o 8,6 g/dl. Como promedio, al paciente que ingrese en la UTI se le transfunde entre 4 y 5 unidades de sangre (véase Tabla I) (1, 8).
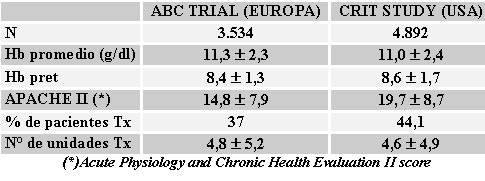 Tamaño completo
Tamaño completo Tabla I. Prácticas de transfusión en pacientes gravemente enfermos.
Con respecto a las pautas indicadoras, en 29% de las transfusiones, no hubo indicación alguna, lo que significa que se hicieron por mera intuición y a juicio del utiólogo, sin tener como base alguna evidencia concreta (véase Tabla II).
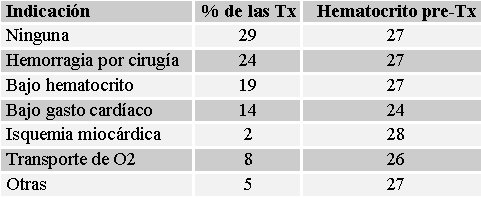 Tamaño completo
Tamaño completo Tabla II. Indicación de transfusión en pacientes críticos.
Tradicionalmente, se indica una transfusión cuando el nivel de Hb es inferior a 10g/dl o el hematocrito es menor de 30%, niveles que comprometerían la entrega de oxígeno a los tejidos. Pero varios estudios recientes refutan dicha regla, postulando que sería errónea y que la indicación de transfusión no debe basarse en la Hb ni en números absolutos, sino en las necesidades fisiológicas (15).
A continuación se presentarán algunos de estos estudios que concluyen que una indicación de transfusión de 7 g/dl de hemoglobina, en vez de 10 g/dl, se traducirá en menos transfusiones y menos complicaciones. La evidencia clínica obtenida en pacientes gravemente enfermos indica que ellos pueden tolerar niveles de Hb inferiores a lo establecido anteriormente.
En el estudio TRICC (Transfusion Requirements in Critical Care) , cuyos principales resultados se publicaron en 1999, participaron 25 UTI de Canadá (22 de centros de cuidado terciario y 3 UTI de nivel comunitario). El objetivo de esta investigación fue determinar si la transfusión marcaba alguna diferencia en la mortalidad durante los 30 primeros días, tanto en los hospitales como en las UTI (A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. Hebert PC. N Engl J Med. 1999 Feb 11;340(6):409-17) (16).
Se asignó a los pacientes en forma aleatoria a la estrategia de transfusión restrictiva, en la cual se indica la transfusión con niveles de Hb inferiores a 7 g/dl y se mantiene los niveles entre 7 y 9; o a la estrategia liberal, en que la transfusión se indica con valores de Hb inferiores a 10, y los niveles se mantienen entre 10 y 12 g/dl.
No hubo diferencia significativa en la tasa de mortalidad entre estas estrategias; tampoco hubo diferencia en el resultado a 30 y a 60 días, ni en las UTI ni en los hospitales. Hubo una tendencia a mayor mortalidad con la estrategia liberal, pero no fue estadísticamente significativa.
Hubo dos diferencias importantes en los grupos de estudio. Primero, los episodios adversos cardíacos, como el edema pulmonar y el infarto de miocardio, fueron más frecuentes con la estrategia liberal; y, segundo, en los subgrupos de pacientes más jóvenes y saludables la mortalidad a 30 días fue mucho menor en los pacientes adscritos a la estrategia de transfusión restrictiva. Con aquello el estudio demostró que este subgrupo de pacientes se benefició de tolerar un nivel de hemoglobina más bajo y recibir menos transfusiones.
Riesgos de las transfusiones (17)
Se sabe que las transfusiones no están exentas de riesgo. Algunas posibles complicaciones son:
- Riesgo de infección.
- Complicaciones de tipo no infeccioso.
- Transfusiones de glóbulos rojos alogénicos desencadenan el proceso de inmunomodulación y supresión inmune.
- Hay evidencia de que aunque una transfusión puede incrementar la Hb, a menudo no incrementa la entrega del oxígeno.
En un estudio realizado en el Reino Unido e Irlanda, entre 1996 y 1998, se recogieron datos provenientes de pacientes que o habían fallecido o sufrido complicaciones mayores secundarias a las transfusiones, y se comprobó que, en más de la mitad de los casos, el evento adverso fue causado porque la sangre no correspondía al grupo del paciente, debido a un error humano, que es el mayor riesgo que se corre al recibir sangre, en cualquier centro asistencial del mundo.
También se sabe que las transfusiones de glóbulos rojos causan supresión inmunológica, con lo que aumenta el riesgo de infecciones y de desarrollo de cáncer después de una intervención quirúrgica; también se pueden reactivar virus latentes.
Otro estudio importante es el de Taylor, que fue un análisis retrospectivo de 1.700 pacientes, realizado para determinar la incidencia de infecciones en las UTI y su posible relación con las transfusiones de sangre (Impact of Allogenic Packed Red Blood Cell Transfusion on Nosocomial Infection Rates in the Critically Ill Patient. Taylor R, Manganaro L. Crit Care Med 30(10):2249-2254, 2002) (18).
La tasa de infección en el universo de pacientes fue de 6%. Pero, al comparar a los que recibieron transfusiones de glóbulos rojos con los que no las recibieron, se observó que la tasa era mucho más alta en los transfundidos que en los no transfundidos (15 y 3% respectivamente). Por lo tanto, la administración de transfusiones de sangre en las UTI incrementaba el riesgo de infecciones nosocomiales por un factor de 5.
En esta investigación, además, se comprobó que la transfusión de sangre estaba asociada con un alto nivel de mortalidad, ya que el valor de este parámetro, que era de 14% para todos los pacientes, aumentó a 24% en el grupo que recibió transfusiones, en comparación con 10% del grupo de pacientes no transfundidos. En consecuencia, la transfusión duplicaba el riesgo de morir en este tipo de pacientes.
Otro estudio, en la literatura médica, también describe menores niveles de infección y de mortalidad en los pacientes que no reciben transfusiones. Dicho de otro modo, un paciente al que se le hace una transfusión en la UTI, tiene más probabilidades de contraer una infección y, por lo tanto, mayor riesgo de morir (19).
En esta misma investigación se encontró también una relación, según la cual, cuanto más alto el número de transfusiones que el paciente recibía, tanto mayor sería la probabilidad de que el paciente tuviera una infección o muriera durante su estadía en la UTI (19).
En un estudio realizado en pacientes con cáncer colorrectal, se encontró que la sobrevida de los pacientes no transfundidos era de 73%, significativamente mayor que la sobrevida de los transfundidos (60%). Aquí quedó demostrado que en este grupo de pacientes la transfusión se asocia significativamente con un mayor riesgo de muerte (20).
Otros problemas relacionados con las transfusiones
Hay evidencia de que las transfusiones pueden ocasionar una falla en el transporte de oxígeno, en pacientes críticos con septicemia, anemia o ventilación mecánica. En dos estudios acerca de la distribución o la absorción del oxígeno se demostró que, a pesar de que la cantidad de Hb fuera mayor en los pacientes transfundidos, este hecho no se asociaba con una mejoría en la absorción sistémica y tisular de oxígeno. Lo anterior se atribuyó a que las transfusiones se hacían con sangre conservada en los bancos durante 30 a 42 días, aproximadamente, la que sufría lo que se conoce como lesión o daño por almacenamiento 21, 22).
Se sabe que el almacenamiento de la sangre durante siete días produce una pérdida marcada del 2,3 DPG, que es indispensable para la entrega de oxígeno a los tejidos. También se observó cambios en la flexibilidad de los glóbulos rojos, lo que puede causar un “empantanamiento” microcirculatorio, junto con anormalidades de tipo electrolítico, especialmente hiperkalemia (23, 24).
Además, se demostró que las células entran en un proceso de destrucción a medida que transcurre el tiempo de almacenamiento de la sangre. En la Figura 2 se ve algunas imágenes de los glóbulos rojos en distintas etapas del tiempo de almacenamiento. Un día después de almacenados, los glóbulos rojos lucen normales, con formas suaves y armónicas; a los 21 días, las superficies se ven dentadas e irregulares y los glóbulos han perdido sus finas formas originales. En el día 35, las formas irregulares se intensifican, y se puede ver que la forma de los glóbulos rojos ha ido evolucionando de discos normales a equinocitos (glóbulos con formas dentadas irregulares), poco aptos para la óptima distribución del oxígeno (25).
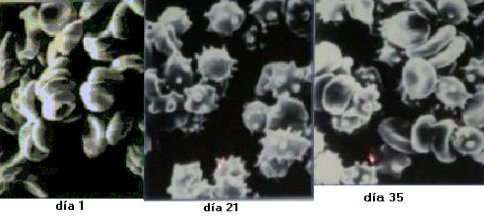 Tamaño completo
Tamaño completo Figura 2. Cambios morfológicos en los glóbulos rojos según el tiempo de almacenamiento.
Insuficiencia orgánica múltiple (IOM) y transfusiones (26, 27)
En un estudio prospectivo realizado en 63 pacientes que sufrieron un accidente y recibieron transfusión de sangre en las primeras 12 horas desde el episodio, se intentó establecer si había una relación entre la edad de la sangre utilizada para las transfusiones y la aparición de IOM. Se encontró este problema en 23 de los 63 pacientes, correspondiendo a los que recibieron la sangre que había permanecido almacenada por más tiempo.
El tiempo de estadía de la sangre en el banco, antes de la transfusión, fue de 30 días en promedio; es decir, se trataba de sangre casi vencida, a punto de ser desechada, y basta con recordar la figura anterior para saber cómo están los glóbulos rojos en esa etapa. En cambio, los días de almacenamiento de la sangre que recibieron los pacientes que no presentaron IOM fueron 24, en promedio.
Estos resultados indicarían una clara asociación entre el tiempo de almacenamiento en bancos de sangre y el desarrollo de IOM. Por último, en otro estudio se demuestra que los pacientes traumatizados que reciben transfusiones tienen un riesgo cuatro veces mayor de presentar el síndrome de respuesta inflamatoria sistémica, y la administración de glóbulos rojos aumentaba el riesgo de muerte por un factor de 10.
Estrategias para evitar la transfusión (28, 29)
Sabiendo que existen varias causas por las que los pacientes críticos pueden presentar anemia, y que las transfusiones no necesariamente mejoran sus condiciones, surge la necesidad de establecer estrategias para prevenir las transfusiones innecesarias. Entre éstas están:
- Reducir al mínimo la pérdida de sangre por flebotomías.
- Disminuir a menos de 10 g/dl el nivel de Hb bajo el cual se indica la transfusión.
- Estimular la producción de glóbulos rojos (eritropoyesis).
- Utilizar los sustitutos de la sangre a medida que salgan al mercado, para mejorar la distribución del oxígeno sin recurrir a las transfusiones sanguíneas convencionales.
Una manera de reducir al mínimo la pérdida de sangre por flebotomías es hacer un análisis por lotes, es decir, establecer la costumbre de extraer una sola muestra de sangre al día a los pacientes hospitalizados en la UTI y, con esa muestra, hacer todos los exámenes necesarios, en vez de tomar una nueva muestra cada vez que se necesite un nuevo análisis. Esto también reducirá la cantidad de sangre necesaria para realizar los análisis y permitirá usar tubos de recolección más pequeños.
Un método más eficiente es el uso de dispositivos electrónicos analizadores de sangre, que ocupan una simple gota para realizar el análisis y no dos tubos de sangre, como los métodos convencionales; y, por último, realizar sólo los exámenes realmente necesarios y pertinentes, ya que con frecuencia se solicitan análisis que no corresponden a la enfermedad o al momento, lo que causa pérdidas innecesarias de glóbulos rojos.
En cuanto al segundo punto, cabe destacar los resultados del estudio TRICC, hecho en Canadá, en el que se demostró que las transfusiones de sangre deben basarse en la fisiología del paciente y no sólo en los niveles de Hb o para restaurar volemia. Normovolemia se debe restaurar con cristaloides o coloides. Este estudio demostró que se puede usar una estrategia restrictiva y permitir que la hemoglobina baje a siete antes de transfundir, y los pacientes responden mejor. Demuestra también que los pacientes cardíacos tal vez no necesiten una hemoglobina de 10 g/dl. De hecho, al aplicárseles la estrategia restrictiva, estos pacientes tuvieron menos ataques y eventos coronarios que con la estrategia tradicional.
Con respecto a la posibilidad de estimular la eritropoyesis, se puede lograr mediante medicamentos como la eritropoyetina humana recombinada, que se administra junto a suplementos de hierro, para potenciar su efecto.
La eritropoyetina alfa reduce la necesidad de transfusiones sanguíneas en pacientes en UTI, como lo demostró el estudio de Corwin, en el que se inyectó eritropoyetina alfa o placebo a dos grupos de pacientes, desde el tercer día de su admisión en la UTI; se observó que los pacientes del grupo de estudio tuvieron menos necesidad de transfusiones que los del grupo placebo.
Los pacientes que recibieron de rutina eritropoyetina alfa subcutánea en la UTI solo recibieron la mitad de unidades transfundidas que los que recibieron placebo, y sin embargo tuvieron un hematocrito más alto (promedio 35,1%) que el grupo placebo (promedio 31,6%). En el mismo sentido, la cantidad de unidades de sangre utilizadas por cada paciente inyectado con eritropoyetina alfa fue menor (2,1 contra 3,8 en los pacientes con placebo). Estos pacientes no eran testigos de Jehová, de modo que estaban dispuestos a recibir transfusiones de glóbulos rojos. Pero, no deja de llamar la atención que el hematocrito era tan alto. Indica que probablemente se podría haber transfundido aun menos a esos pacientes, y todavía haber tenido un hematocrito muy seguro de 23% o 24%.
Un segundo estudio sobre el uso de eritropoyetina alfa en pacientes críticos es una investigación prospectiva, aleatoria y controlada, realizada en 65 instituciones de los Estados Unidos y Canadá, en la que se tomó al azar a 1.302 pacientes, de los cuales, un grupo recibió eritropoyetina alfa (650) y el otro (652) recibió placebo. Se les administró semanalmente una dosis de eritropoyetina de 40.000 UI, durante tres semanas, mientras se encontraban en la UTI.
El objetivo primario de esta investigación fue determinar si era posible eliminar la necesidad de transfusiones de sangre. Se comprobó que sólo 50% de los pacientes que usaban eritropoyetina necesitaron transfusiones, contra 60 % de los pacientes inyectados con placebo; y que, cuando se transfundieron, sólo necesitaron una unidad, en comparación con el promedio de dos unidades utilizadas por los pacientes con placebo. Además, la eritropoyetina alfa incrementó los niveles de Hb en la sangre: aumento de 1,32 g/dl en el grupo de estudio; 0,94 en el grupo placebo.
Sería útil mencionar que la eritropoyetina no se activa a menos que se asocie con ella un suplemento de hierro. En el pasado, el único suplemento disponible en los Estados Unidos era el Iron Dextran (100 mg/2ml), pero causó reacciones anafilácticas en ciertos pacientes, por lo que había que administrar primero una dosis de prueba.
Actualmente hay dos productos disponibles: el gluconato ferroso (62,5 mg/5ml) y el Iron Sucrose (100mg/5ml). Ninguno de estos productos más nuevos se ha asociado con anafilaxis. Ahora se utiliza iron sucrose de rutina en nuestra UTI, siguiendo las instrucciones del laboratorio. Ya no es necesario administrar una dosis de prueba ni preocuparse de reacciones anafilácticas.
Administración parenteral de hierro e infecciones (30)
Es importante mencionar que muchos médicos tienen miedo de administrar hierro por vía parenteral en las UTI, debido a que en algunos estudios se describe que este mineral estimula la virulencia o bloquea el proceso de inhibición del crecimiento bacteriano; y que en otros se ha descrito una disminución de la fagocitosis por parte de los neutrófilos, por lo que hay una controversia en curso con respecto a su utilización. Pero sin duda es muy importante utilizar hierro en pacientes que rechazan transfusiones de sangre.
Será necesario esperar los resultados de futuros estudios para saber si realmente hay una tasa de infección mayor asociada con el uso de hierro endovenoso.
Caso clínico (31)
Para terminar, se presenta un caso en el que se recurrió a la administración de eritropoyetina alfa en una paciente con pérdidas graves de sangre.
Se trataba de una paciente testigo de Jehová de 51 años de edad, que ingresó en la UTI con múltiples fracturas y gran cantidad de tejido blando dañado en los miembros inferiores, debido a un accidente automovilístico.
Su hematocrito de ingreso fue de 12%. Inicialmente solamente se le administró 20.000 UI de eritropoyetina alfa día por medio, sin hierro. Al tercer día la paciente no presentaba ninguna mejoría; por el contrario, el nivel de hematocrito había bajado a 7%, con Hb de 3 g/dl. Se decidió un tratamiento agresivo por lo que se le inyectó 7.000 UI de eritropoyetina IV c/8 horas, agregando hierro IV. Entonces comenzó a mejorar, mostrando que en la UTI, eritropoyetina sin hierro IV no da resultados. Es especialmente necesario dar hierro IV a pacientes con anemia severa que no aceptan glóbulos rojos.
Para el día 30, su nivel de hematocrito era de 35%, sin haber recibido ninguna transfusión. La lección es que tenemos que ser mucho más agresivo en la UTI con el uso de eritropoyetina y hierro IV. Tenemos que bajar los niveles que gatillan una transfusión. Es de esperar que así podremos eliminar transfusiones de glóbulos rojos para la mayoría de nuestros pacientes.
A modo de conclusión, es interesante dar a conocer una frase de Beal RW (Aust. NZJ Surg. 1976; 46:309) que dice que: “La transfusión de sangre es como el matrimonio: no se debe emprender a la ligera, imprudentemente, por capricho ni más a menudo de lo que sea realmente necesario” (32).

