Cursos
← vista completaPublicado el 1 de junio de 2007 | http://doi.org/10.5867/medwave.2007.05.3255
Probióticos en recién nacidos
Probiotics in infants
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos y Oportunidades en Gastroenterología y Nutrición, organizado por la Sociedad Chilena de Pediatría durante los días 3, 4 y 5 de mayo de 2007. Directores: Dra. Sylvia Cruchet y Dr. Francisco Moraga.
Introducción
Los probióticos se definen como “microorganismos vivos no patogénicos que colonizan el intestino y proveen beneficio al huésped”. Tienen múltiples acciones en el lumen intestinal: normalización de la flora intestinal; función de barrera; reducción de la permeabilidad intestinal; aumento de las defensas inmunes; mejoría de la nutrición enteral y reducción de la translocación bacteriana. El número de funciones que se les atribuye ha aumentado en forma considerable en los últimos años y está en plena investigación; antes de la década de los 90 el número de publicaciones sobre probióticos no llegaba al centenar, mientras que en los últimos diez años han aparecido miles de artículos sobre diversos aspectos del tema.
El recién nacido, en especial el recién nacido prematuro (RNP), tienen condiciones muy especiales: sistemas y órganos inmaduros; alto riesgo de morbilidad infecciosa, ya que se comporta como un individuo inmunocomprometido; retraso en el inicio de la alimentación; retraso en la colonización y establecimiento de la microflora, proceso que muchas veces ocurre en forma anormal; y frecuentes tratamientos con antibióticos de amplio espectro, que destruyen la microflora. Todos estos factores hacen que el RNP sea mucho más susceptible a colonización patológica e infecciones. Estudios epidemiológicos han señalado que el medio ambiente precoz, específicamente el que rodea al recién nacido, es una ventana de oportunidades para configurar el tipo de respuesta inmune del niño.
En un estudio publicado en 2005 en Journal of Pediatrics se evaluó el impacto de la alimentación con leche materna y de los probióticos sobre la composición de la flora intestinal y sobre la respuesta inmune humoral, que se midió en forma indirecta a través de células secretoras de inmunoglobulinas circulantes, específicamente IgM, IgA e IgG. En este estudio se incluyeron 96 niños con antecedentes de al menos un familiar con dermatitis atópica, rinitis o asma, que ingresaron durante el embarazo a un protocolo controlado, doble ciego y con placebo. Se administró a la madre, una vez al día, previo al parto, Lactobacillus rhamnosus GG en una concentración de 1 x 10(10) unidades formadoras de colonias (UFC) y después del parto se administró lo mismo al niño, mezclado en agua y con cuchara, desde el nacimiento hasta los 6 meses de edad; además se recomendó a las madres mantener la lactancia natural por mínimo 4 a 6 meses. A los 3, 6 y 12 meses se evaluó las características del niño (peso al nacer, edad gestacional), dieta (leche humana, fórmula o fórmula hipoalergénica), edad de introducción de fórmula o alimentos sólidos y duración de la alimentación con leche materna, exclusiva o parcial. Se midió CD14 soluble en calostro; se hizo hibridación fluorescente in situ (FISH) para bacterias intestinales (Bif 164 y Lab158) y específico para bifidobacteria y lactobacilo/enterococo, y se determinaron niveles de inmunoglobulinas M, A y G (ELISPOT).
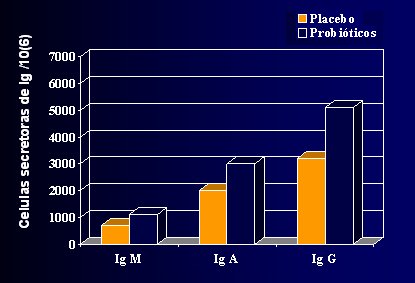
Las características clínicas de ambos grupos, control y probióticos, fueron similares en cuanto a peso al nacer y edad gestacional (35 a 41 semanas en el grupo control y 36 a 43 en el grupo probióticos). La duración de la lactancia materna exclusiva fue alrededor de 2,6 meses; hubo alimentación al pecho, al menos parcial, por un período de 6,9 meses (rango 6,0 a 7,7). A los 6 meses de edad, la alimentación predominante fue leche humana en 48% de los casos, fórmula adaptada en 45% de ellos y fórmula hidrolizada o de aminoácidos en sólo 4 y 3% de los casos, respectivamente. Los niños alimentados al pecho por al menos 3 meses tuvieron mejor recuento de bifidobacterias y lactobacilo/enterococos que los alimentados por menos de 3 meses; asimismo, aquellos alimentados parcialmente con leche humana por al menos 6 meses tuvieron mejor recuento que los alimentados por menos de 6 meses. Estas diferencias dejaron de ser evidentes a los 12 meses de edad. La cantidad de inmunoglobulina E, A y G fue significativamente mayor en el grupo que usó probióticos, en comparación con placebo (Fig. 1).
 Tamaño completo
Tamaño completo Figura 1. Efecto sinérgico de alimentación exclusiva al pecho y probióticos (1)
En este estudio se concluyó que:
- La terapia con probióticos más leche humana tiene un efecto sinérgico y podría constituir el paso inicial para una maduración sana del sistema inmune adaptativo y funcional.
- El bifidobacterio aparece postnacimiento y constituye entre 60 y 90% del total de la microflora fecal en los niños alimentados al pecho.
- Los bifidobacterios utilizan la leche humana y sus oligosacáridos como principal sustrato para el crecimiento.
- La administración oral de cepas de lactobacilos, incluyendo a Rhamnosus GG, estimula la microflora del bifidobacterio.
- Los resultados de este estudio sugieren que algunos compuestos derivados de la leche humana pueden ser mandatorios para los probióticos, en el sentido de estimular la respuesta inmune humoral.
- Gran parte de estos efectos se pueden atribuir a la leche humana, pero la sumatoria de probióticos potencia los efectos de ésta (1).
Probióticos y enterocolitis necrotizante
La enterocolitis necrotizante (ECN) es una patología muy importante y frecuente en el recién nacido de pretérmino y es una de las emergencias gastrointestinales más temidas por los neonatólogos y todos los profesionales que trabajan en unidades de neonatología. Su incidencia es variable, pero el grupo de mayor riesgo, que es el menor de 1.500 g de peso al nacer, la incidencia oscila entre 5 y 10% y en algunas unidades es aún mayor. La mortalidad de esta patología es de alrededor de 30% y 25% de los sobrevivientes quedan con secuelas a largo plazo, específicamente síndrome de intestino corto. Las causas son multifactoriales y hasta hoy no existen evidencias categóricas de que alguna de ellas sea determinante por sí sola; las principales son: la inmadurez, que implica compromiso de la función de barrera y de la motilidad, isquemia intestinal y colonización por patógenos; la exposición a antibióticos; y por supuesto, la exposición a patógenos, que desencadena la cascada inflamatoria.Se ha planteado que los probióticos podrían contribuir a reducir la incidencia de ECN en los recién nacidos pretérmino a través de: contribuir a la reducción de la colonización por patógenos; aumentar la barrera intestinal; disminuir el proceso inflamatorio intestinal; favorecer procesos de fermentación y producción de ácidos orgánicos, ácidos grasos y bacteriocina antimicrobiana; aumentar las defensas naturales del huésped (mucus y motilidad) y reducir la respuesta proinflamatoria.
Las primeras evidencias que apoyan esto datan de estudios en animales efectuados en el año 1974 por Barlow, que demostró que la alimentación con leche humana o una preparación oral de Lactobacillus evitaba el daño intestinal, en un modelo de enterocolitis en rata hipóxica neonatal; luego Caplan, en 1999, demostró una reducción de lesiones tipo ECN con suplementación de bifidobacteria y colonización intestinal (2) y en 2002, Butel describió que el bifidobacterio evitaba las lesiones cecales por Clostridium (3).
Los estudios clínicos sobre el efecto de los probióticos en recién nacidos pretérmino son de dos tipos: sobre tolerancia y sobre prevención de ECN. Entre los primeros destaca un estudio aleatorio japonés efectuado en recién nacidos de 28 semanas, con peso promedio de 1.000 g, que recibieron un aporte de Bifidobacterium breve de 5 x 10(9) microorganismos por día. El grupo que recibió probióticos tuvo colonización fecal significativamente más alta (73% versus 12%); además, se demostró que la colonización se produce lentamente, llegando a 92% a la sexta semana; y que a mayor colonización se produce mayor madurez intestinal y menos problemas de tolerancia. El resultado final fue que hubo mayor ganancia de peso a los treinta días en el grupo que usó probióticos (4).
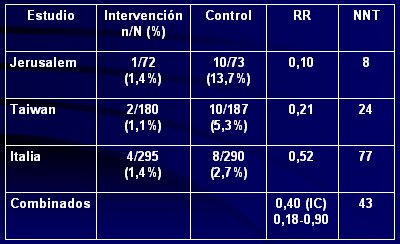
Entre los estudios de prevención, destacan cuatro. El primero es el de Hoyos, que se realizó en Colombia en el año 1999; en él se estudiaron 1.237 recién nacidos que se trataron con dos cepas de probióticos, L. Acidophilus 2 x 10(8) org/día y B. Infantis, 2 x 10(8) org/día, durante toda la hospitalización. Se incorporaron al estudio todos los recién nacidos que ingresaron a la unidad durante 1 año, de modo que los menores de 1.500 g, que es el grupo más susceptible a ECN, constituyo sólo 10% de la muestra. Este es el único trabajo de este tipo en el que se estudiaron recién nacidos de cualquier peso. La incidencia de enterocolitis fue de 3%, cifra que la autora comparó con la incidencia previa de esa unidad, que era de 6,6%; asimismo, la mortalidad se redujo a la mitad en comparación con el período previo: de 35 a 14 pacientes (5).
El segundo estudio fue realizado en Italia por el grupo de Dani y, a diferencia del anterior, fue aleatorio, multicéntrico, doble ciego y controlado con placebo. Se utilizó sólo Lactobacillus GG, en dosis de 6 x 10(9) UFC/día desde el inicio de la alimentación enteral hasta el alta y sólo se incluyó a niños menores de 1.500 g. La incidencia de morbilidad infecciosa y de enterocolitis fue menor en el grupo tratado, pero las diferencias no fueron significativas y no hubo diferencia en sepsis e infección urinaria (6).
El tercer estudio es el de Bin-Nun, en Jerusalén; también fue aleatorio y controlado y en él se administró una mezcla de tres probióticos: B. infantis, B. bifidus y S. thermophilus, desde la primera alimentación hasta las 36 semanas de edad postconcepcional. Se calculó el poder de la muestra para disminuir la incidencia de ECN de 15% a 5%. Se analizaron los resultados de ECN etapa 2 y 3 y se encontró que la incidencia fue de 4% en el grupo tratado versus 16,4% en el grupo no suplementado, diferencia estadísticamente significativa (p=0,03). No sólo disminuyó la incidencia de ECN etapa 2 y 3, sino que también se redujo la incidencia de enterocolitis grave en el grupo que recibió probióticos, pero no hubo diferencias en sepsis. Los pacientes tenían una edad gestacional de 29 semanas y un peso al nacer de 1.100 g, sin diferencias entre ambos grupos (7).
El cuarto estudio (tercero aleatorio) se hizo en Taiwán. En él se estudiaron 367 recién nacidos alimentados con leche materna, que pesaron menos de 1.500 g al nacer y tuvieron, en promedio, 1.100 g y 28 semanas de edad gestacional. Fue un estudio aleatorio y controlado y se usaron dos cepas: Lactobacillus acidophilus y Bifidobacterium infantis. En el resultado combinado de muerte o ECN hubo una clara diferencia, con 5% versus 13% en el grupo suplementado versus no suplementado; en ECN etapa 2 ó 3 la diferencia fue de 1,1% versus 5,3%; en sepsis, 12 versus 19%; en el resultado combinado de sepsis o ECN, 13% versus 25% y combinando sepsis, ECN o muerte hubo una reducción casi a la mitad en el grupo suplementado (17% versus 32%). Las características basales de ambos grupos eran similares (8).
En el año 2006, Schanler analizó todos los estudios aleatorios sobre el efecto de los probióticos en la ECN en recién nacidos de pretérmino. El análisis combinado de los tres estudios descritos, que fueron aleatorios, controlados y realizados en recién nacidos menores de 1.500 g, demostró un riesgo relativo de 0,40, lo que significa que el riesgo de presentar ECN se redujo en 60% en los grupos que recibieron probióticos, con un intervalo de confianza significativo. El número necesario a tratar (NNT) para disminuir el riesgo de ECN en un paciente, fue de 43 pacientes (9). En la Tabla I se resumen los tres estudios. Es importante señalar que éstos utilizaron distintas cepas y distinto número de cepas y que el único en que no se encontró una diferencia significativa en la incidencia de ECN fue el italiano, en el que se usó sólo una cepa.
 Tamaño completo
Tamaño completo Tabla I. Estudios aleatorios sobre el efecto de probióticos en ECN en recién nacidos pretérminos (9).
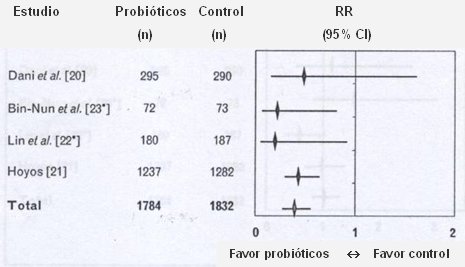
Hammerman hizo también un metaanálisis de los trabajos sobre diferentes patologías en recién nacidos para incidencia de enterocolitis. El resultado final dio un riesgo relativo de 0,4, con un intervalo de confianza significativo. En la Fig. 2, el gráfico muestra que sólo el estudio de Dani, que usó sólo una cepa, no fue significativo en términos de protección de ECN. En el mismo metaanálisis, no hubo diferencias significativas en mortalidad y sepsis (10).
 Tamaño completo
Tamaño completo Figura 2.
Comentarios
En relación al uso de probióticos, las evidencias disponibles parecen indicar que:- Su uso en recién nacidos de pretérmino tiene un beneficio potencial;
- es una terapia promisoria en ECN;
- es probable que su efecto sea más útil cuando se combinan con leche materna, pero es difícil aislar el efecto altamente protector de ésta;
- la mezcla óptima de probióticos todavía no está determinada y será motivo de futuras investigaciones;
- los ritmos de colonización son variables;
- falta por determinar si la colonización es el mejor indicador de su eficacia;
- el recién nacido pretérmino, que es el objetivo especial para ECN, es un individuo inmunocomprometido, por lo tanto es muy importante el tema de la seguridad.
Sobre el último punto, no debe existir ninguna probabilidad de que la administración de probióticos se asocie a sepsis por estos lactobacilos. La mayoría de los trabajos no se han hecho con el objetivo de evaluar la incidencia de sepsis por lactobacilos, pero en ellos no se ha encontrado una correlación con sepsis; si bien se han descrito en la literatura septicemias por lactobacilo, la próxima vez que esto ocurra se podrá hacer el estudio génico de la cepa, para determinar si la causa es o no el probiótico.
Todavía falta por responder las siguientes interrogantes: ¿Cómo elegir el probiótico adecuado? ¿Cuál es el régimen de dosis óptima? ¿Cuál es el tiempo de administración del probiótico? Y, si bien parecen ser inocuos en el recién nacido ¿son válidas las preocupaciones en cuanto a seguridad? Por otra parte, en el estado actual del conocimiento, la etiopatogenia de la ECN aún no está aclarada, se sabe que la fisiología de los probióticos es multifactorial y todavía no están completamente definidos los efectos adversos.
Referencias
- Rinne M, Kalliomaki M, Arvilommi H, Salminen S, Isolauri E. Effect of Probiotics and Breastfeeding on the Bifidobacterium and Lactobacillus/Enterococcus Microbiota and Humoral Immune Responses. J Pediatr 2005;147(2):186-191.
- Caplan MS, Miller-Catchpole R, Kaup S, Russell T, Lickerman M, Amer M, et al. Bifidobacterial supplementation reduces the incidence of necrotizing enterocolitis in a neonatal rat model. Gastroenterology 1999; 117:577-83.
- Butel MJ, Waligora-Dupriet AJ, Szylit O. Oligofructose and experimental model of neonatal necrotising enterocolitis. Br J Nutr 2002; 87(suppl 2):S213-9.
- Kitajima H, Sumida Y, Tanaka R, Yuki N, Takayama H, Fujimura M. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Arch Dis Child Fetal Neonatal Ed 1997;76:F101-7.
- Hoyos AB. Reduced incidence of necrotizing enterocolitis associated with enteral administration of Lactobacillus acidophilus and Bifidobacterium infantis to neonates in an intensive care unit. Int J Infect Dis 1999;3:197-202.
- Dani C, Biadaioli R, Bertini G, Martelli E, Rubaltelli F. Probiotics feeding in prevention of urinary tract infection, bacterial sepsis and necrotizing enterocolitis in preterm infants. Biol Neonate 2002;82:103-8.
- Bin-Nun A, Bromiker R, Wilschanski M, Kaplan M, Rudensky B, Caplan M et al. Oral Probiotics Prevent Necrotizing Enterocolitis in Very Low Birth Weight Neonates J Pediatr 2005;147(2);192-196.
- Lin CH, Su BH, Chen AC, Lin TW, Tsai CH, Yeh TF, et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics 2005;115:1-4.
- Schanler RJ. Probiotics and necrotising enterocolitis in premature infants. Current issue, Arch Dis Child Fetal Neonatal Ed. 2006; 91:395-397.
- Probióticos e infección intestinal. Hammerman C, Curr Opin Infect Dis 2006; 19:277-282.

