Cursos
← vista completaPublicado el 1 de julio de 2007 | http://doi.org/10.5867/medwave.2007.06.3326
Prevención de la reactivación de hepatitis B en pacientes inmunodeprimidos y con neoplasia
Prevention of hepatitis B reactivation in immunosuppressed patients with cancer
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Avances en Gastroenterología 2006, organizado por la Sociedad Chilena de Gastroenterología durante los días 8 al 11 de agosto de 2006.
Introducción
La prevención de la reactivación es un tema muy importante en hepatitis B (HB). En esta conferencia se discutirán los siguientes aspectos: fisiopatología de la infección viral por el virus HB (VHB) en pacientes inmunodeprimidos; tratamiento de la infección por VHB en inmunodeprimidos; tratamiento preventivo versus diferido con análogos de nucleósidos, según el momento de presentación de la reactivación; transferencia adoptiva de inmunidad para HB. No habrá tiempo para discutir sobre la vacunación de inmunodeprimidos ni sobre las formas en que se puede aumentar la respuesta inmune a la vacuna.
Fisiopatología de la infección por VHB
La infección crónica por VHB tiene cuatro etapas: fase replicativa o de tolerancia inmunológica; fase de clearance inmunológico del antígeno e del VHB; fase de replicación baja, que es la etapa de portadores inactivos y fase de reactivación. En la primera etapa el antígeno e es positivo, pero luego va desapareciendo a medida que se produce la seroconversión. La viremia por virus nativo disminuye a lo largo de los años, pero con frecuencia aparece una mutante precore, principalmente en pacientes con anti-e positivo. Estas cuatro etapas explican toda la cinética inmunológica de la infección por VHB.La primera etapa, o replicativa, se caracteriza por cargas virales elevadas (10(9) a 10(10) copias/ml), a menudo con aumentos leves de alanina aminotransferasa (ALT) y hepatitis crónica leve. Durante la etapa de clearance de antígeno e es frecuente que ocurran fluctuaciones en los niveles de ADN viral, aumento de ALT y hepatitis crónica moderada a grave, que puede llevar a cirrosis, con niveles aún positivos de antígeno e. En la etapa de replicación baja se produce una rápida disminución de la carga viral, de 10(5) o menos copias/ml, la ALT se normaliza y se produce el estado de portador inactivo. Por último, los pacientes que tienen anti-e positivo, por lo general (no siempre) experimentan una fase de reactivación, con aumento de la carga viral a 10(4) a 10(5) copias/ml y aumento de los niveles de ALT, y pueden llegar a hepatitis grave, cirrosis y muerte (Fig. 1).
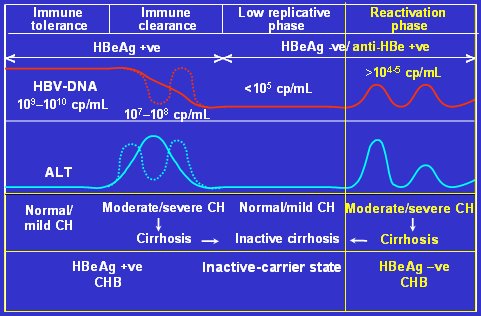 Tamaño completo
Tamaño completo Figura 1. Etapas de la infección crónica por VHB (Adaptado de Fattovich. Sem Liver Dis 2003)
La dinámica de la carga viral en relación con los niveles de ALT durante el curso de la reactivación de VHB es un concepto de suma importancia, en especial en pacientes que reciben quimioterapia por infección oculta o abierta por HB. Hay un momento en que el ADN viral comienza a aumentar hasta alcanzar un peak, lo que ocurre mucho antes que el aumento de ALT, por lo que existe un intervalo de tiempo variable de recaídas de hepatitis, entre el fin de la quimioterapia y el aumento de ALT. Esta fase es engañosa, porque en algunos de estos pacientes que interrumpen la quimioterapia, en quienes sería ideal tener pruebas de función hepáticas normales, se produce una activación explosiva de la infección. Durante el período entre la interrupción y el aumento de ALT se presenta una reconstitución inmunológica; luego, cuando el sistema inmune se recupera de la inmunodepresión producida por la quimioterapia hay tres resultados posibles: episodio agudo de hepatitis, transición a hepatitis crónica, que antes ocurría con frecuencia en estos pacientes y hepatitis fulminante, con insuficiencia hepática y muerte (Fig. 2).
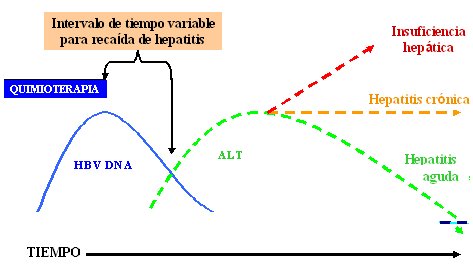 Tamaño completo
Tamaño completo Figura 2. Dinámica de la carga viral y ALT durante el curso de la reactivación de VHB tras la inmunosupresión inducida por quimioterapia. Mediana de inicio 16 semanas, rango 4 a 36 semanas (Xunrong et al 2001).
Los antecedentes sobre lo que ocurre en estos pacientes inmunodeprimidos indican que la reactivación del VHB ocurre hasta en 50% de los pacientes con antígeno de superficie (HbsAg) positivo y en 4% de los pacientes con anti-VHBc positivo: esto es muy importante. Alrededor de 10% presentarán ictericia, la mortalidad aumenta en al menos 5% y podría llegar hasta 70%, según algunos estudios, cuando se produce una recaída (Liang R et al. J Clin Oncology 1999;17:394, Yeo W et al. British J Cancer 2004;90:1306).
La reactivación clínica ocurre a menudo después de la suspensión de la quimioterapia, frente a la recuperación del sistema inmune. El tiempo de aparición promedio desde el término de la quimioterapia hasta el diagnóstico clínico de la reactivación es de 16 semanas, con un rango muy amplio, de 4 a 36 semanas.
No existe en la actualidad una forma confiable de prever la gravedad de la reactivación de hepatitis B durante o después de la quimioterapia; sin embargo, aparentemente se correlaciona con la carga viral y otros factores de riesgo, entre ellos el uso de corticoides, el grado de inmunodepresión y el sexo masculino.
En cuanto a los factores que afectan el control de la infección por VHB durante la reactivación, en primer lugar está la falta de tamizaje para marcadores virales de VHB previo al inicio de la quimioterapia o inmunodepresión. Es frecuente que los hematólogos no soliciten tamizaje de HB y uno de los mensajes más importantes de esta conferencia es que se debe informar a los hematólogos que el hecho de no solicitar marcadores virales de VHB previo al inicio de quimioterapia constituye una negligencia médica.
La falta de vacunación de los pacientes en riesgo en el momento adecuado es una causa frecuente de reactivación, aunque se debe recordar que las vacunas de VHB no son muy inmunogénicas en pacientes inmunodeprimidos, por lo que su eficacia durante la etapa de inmunodepresión es baja. Otros elementos importantes son: el momento de inicio de la terapia antiviral; la coinfección con VIH; carga viral elevada y la preexistencia de virus mutantes.
Los factores de riesgo más importantes para que se produzca una reactivación de VHB en inmunodeprimidos son: presencia de HbsAg; presencia de anti-VHBc; ADN de VHB; antígeno e positivo; pacientes jóvenes y uso de corticoides, factor muy importante, ya que el VHB tiene un factor promotor que es activado por estos fármacos, lo que aumenta la replicación viral. Los estudios sobre los efectos del nivel de ADN de VHB pre-trasplante hepático han demostrado que, a menor carga viral, menor es el riesgo de recurrencia de VHB (Fig. 3). Esto es válido no sólo para trasplante hepático, sino también para cualquier quimioterapia que se emplee.
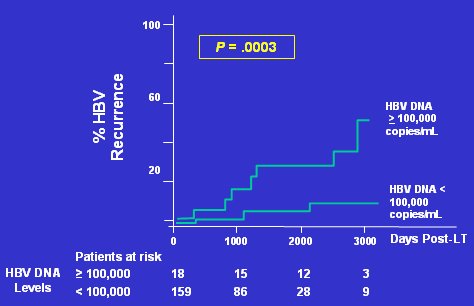 Tamaño completo
Tamaño completo Figura 3. El nivel de HBV DNA pre-trasplante predice el riesgo de recurrencia de HBV (Adaptado de CCO 2005)
El trabajo de Vento, publicado en Lancet Oncology en el año 2002, provee un buen ejemplo sobre los efectos deletéreos de los corticoides en la reactivación de hepatitis B. En este estudio controlado se comparó a dos grupos de pacientes con VHB con neoplasia, uno tratado con un protocolo con corticoides y otro, sin corticoides. Existe una gran diferencia en el número de muertes atribuibles a VHB en el grupo que recibió corticoides, comparado con el grupo que no recibió corticoides (Tabla I). No siempre es posible retirar los corticoides en el tratamiento de una neoplasia, linfoma, por ejemplo, pero se debe extremar las precauciones para proteger a los pacientes de una reactivación.
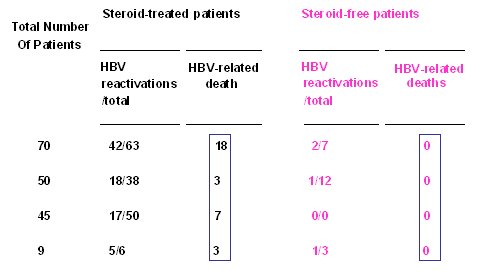 Tamaño completo
Tamaño completo Tabla I. Reactivación de la infección por VHB inducida por quimioterapia: comparación entre protocolos clásico y sin esteroides (Vento S. et al. Lancet Oncology 2002)
Se pueden encontrar alrededor de cien comunicaciones de reactivación de VHB en la literatura. Existe una gran cantidad de condiciones patológicas que aumentan el riesgo de que se produzca reactivación, entre ellas: linfoma, leucemia, mieloma, cáncer de mama, cáncer gástrico, trasplante de médula ósea y de células madres, trasplante hepático, renal y cardíaco, enfermedad de Crohn y artritis reumatoidea. El mensaje se dirige, entonces, no sólo a los hematólogos u oncólogos, sino también a los gastroenterólogos, que deben estar atentos a esta posibilidad, por ejemplo, al emplear anti-TNF en pacientes con enfermedad de Crohn.
Asimismo, la lista de pacientes que tienen alto riesgo de presentar una reactivación es larga. En primer lugar está cualquier paciente HbsAg + o anti-HBc, que esté recibiendo: quimioterapia (a mayor número de ciclos, mayor riesgo); corticoides; anti-TNF (infliximab), con el que se han descrito casos de hepatitis fulminante, de ahí el riesgo de tratar a los pacientes con enfermedad de Crohn sin solicitar marcadores virales de hepatitis B; anticuerpos anti-CD20 (rituximab) o anti-CD52 (Campath-1H, Alemtuzumab); trasplante de médula ósea o de células madre periféricas, incluido trasplante autólogo. Otros grupos de pacientes en riesgo son: receptores de trasplante de órganos desde donantes HbsAg positivos; pacientes con insuficiencia renal e infección, oculta o abierta, por VHB; y pacientes con enfermedades sistémicas, en la misma condición.
La biopsia de pacientes con reactivación de hepatitis B suele mostrar gran actividad: tractos portales distendidos, con edema, inflamación portal con neutrófilos, hepatitis de interfase, puentes, cuerpos apoptóticos, proliferación de ductos biliares, inmunohistoquímica positiva para antígenos HbcAg y HBsAg y esteatosis macro y microvesicular (Fig. 4).
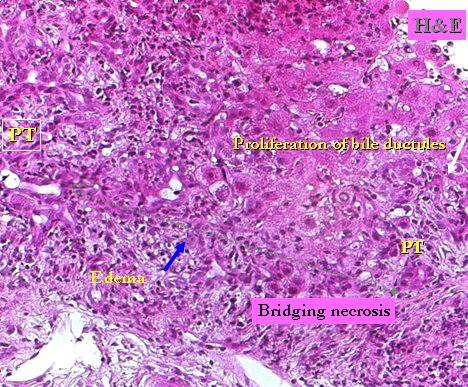 Tamaño completo
Tamaño completo Figura 4. Biopsia de paciente con reactivación de hepatitis B
En la histología se observa una imagen muy florida, con marcación de antígenos de superficie alrededor de los hepatocitos y antígeno c en el hígado, que habitualmente está cargado con estas partículas, debido a la inmunodepresión (Fig. 5 y 6).
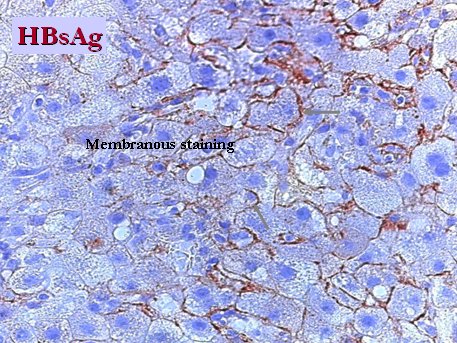 Tamaño completo
Tamaño completo Figura 5. HbsAg alrededor de los hepatocitos en paciente con reactivación de hepatitis B
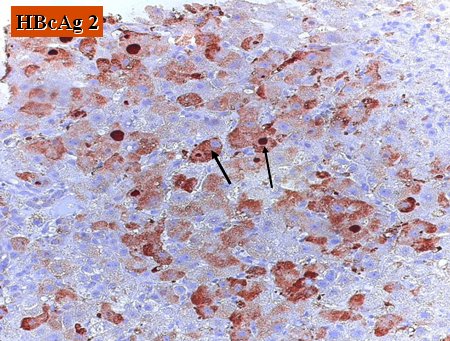 Tamaño completo
Tamaño completo Figura 6. HBcAg en paciente con reactivación de hepatitis B
La complicación más temida de la reactivación es la hepatitis colestásica fibrosante, que causa destrucción hepática por el VHB en un paciente inmunodeprimido, incapaz de montar una respuesta inmune capaz de controlar el virus; esto es algo excepcional (Fig 7).
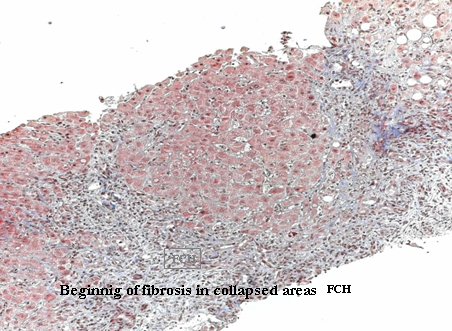 Tamaño completo
Tamaño completo Figura 7. Hepatitis colestásica fibrosante
Tratamiento de la reactivación por VHB en inmunodeprimidos
En primer lugar, es importante saber qué características debe poseer el antiviral ideal. Tiene que ser seguro, sin toxicidad mitocondrial; eficaz, es decir, capaz de lograr sobre 90% de erradicación de cccADN, cosa que todavía es imposible; activo en pacientes e positivo, e negativo y anti-e positivo; de una toma diaria y bajo costo o, al menos, asequible. A su vez, no debe producir recaídas, debe permitir un tratamiento de duración definida (no de por vida), sin resistencia, útil en pacientes con co-infección VIH y VHB y sin interacción con otras drogas. Esta droga aún no existe; lo que más se acerca, en la actualidad, son los análogos de nucleótidos y nucleósidos. En segundo lugar, se debe determinar cuándo un paciente que tiene riesgo de reactivación de la infección por VHB debe recibir tratamiento con un agente antiviral: ¿en el momento de la exacerbación, al terminar la quimioterapia o antes de ésta, en forma preventiva?El número de agentes disponibles ha aumentado en forma considerable. En Estados Unidos hay sólo tres drogas disponibles: lamivudina, adefovir y entecavir, y en algunos países sólo se puede conseguir lamivudina y adefovir en forma ocasional; pero hay una larga lista de presuntos candidatos, muchos de los cuales se usan en VIH con alta eficacia, como Tenofovir, Emtricitabine, Telbivudine (Ldt), Clevudine, Valtorcitabin, Remofovir, LB 80380 y Long-acting interferon alpha, de nombre comercial Albuferon (R). De las tres drogas antivirales disponibles en la actualidad, es importante recordar que, en el caso de una reactivación, la más importante es lamivudina y, en algunas situaciones, adefovir, aunque entecavir es la más potente. El principio de la prevención de resistencia indica que se debe utilizar el agente con mayor capacidad de supresión de ADN de VHB, de modo que el ideal sería usar entecavir, pero en la práctica este fármaco no está disponible en muchos países, por su alto costo.
La idea principal es que se debe prevenir el aumento de ADN de VHB, con lo que disminuye la elevación de ALT y las complicaciones. Esto se puede lograr con el uso de agentes antivirales. Entonces, se debe tener claro cuándo comenzar y cuándo suspender. Gran cantidad de trabajos en la literatura afirman que es posible obtener buenos resultados si se inicia el tratamiento en el momento de la exacerbación, apenas se detecte aumento de ALT, con lamivudina; algunos pacientes se salvarán, pero también algunos morirán, por razones complejas que se discutirán más adelante. El problema es que, si se revisa la literatura, el número de pacientes con hepatitis fulminante aumenta cuando los pacientes se tratan en el momento en que se diagnostica la reactivación: gran cantidad de trabajos describen pacientes con alta carga viral, que se reactivan y desarrollan una hepatitis fulminante.
Vento, en el trabajo que se comentó antes, revisó una serie de trabajos relativos a pacientes que recibieron quimioterapia y el número de ciclos recibidos; todos ellos sufrieron una reactivación. El intervalo entre el diagnóstico de reactivación y el fin de la quimioterapia fue de alrededor de cuatro semanas, pero una vez que fueron tratados, la supervivencia fue bastante buena, debido a que algunos pacientes se trataron en forma preventiva y no en el momento de la exacerbación. Cuando se revisa la literatura al respecto, como se observa en la Tabla II, que corresponde a una selección, se puede observar que, cuando se tratan en forma preventiva, muchos de estos pacientes evolucionan mucho mejor que cuando se interviene en el momento de la reactivación (Tabla II).
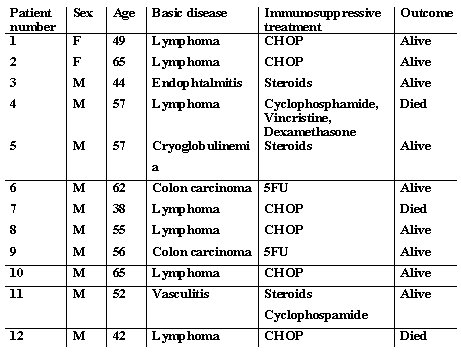 Tamaño completo
Tamaño completo Tabla II. Características clínicas de pacientes con HVB crónica tratados en forma profiláctica con lamivudina durante la inmunosupresión (Shibolet O. Shouval D et al. Blood 2002;100:392)
En un trabajo realizado por Lau, de Hong Kong, el tratamiento preventivo con lamivudina fue superior al diferido, en pacientes sometidos a quimioterapia. Este es el único estudio controlado disponible; en él, 30 pacientes portadores de hepatitis B, entre 402 pacientes con linfoma, en Hong Kong, se asignaron en forma aleatoria, uno a uno, para recibir lamivudina una semana antes del inicio de la quimioterapia (grupo 1) o en el momento de la reactivación serológica o virológica (grupo 2). La lamivudina se discontinuó seis semanas luego del último ciclo de quimioterapia. Se empleó el test de Digene de ADN, que hoy en día está obsoleto. No hubo ningún caso de reactivación en los 15 pacientes tratados con lamivudina preventiva; en cambio, ocurrió en 8 de 15 pacientes del grupo control; el tiempo promedio de aparición de la reactivación fue de 16 semanas, con un rango de 4 a 36 semanas. El peak de ALT ocurrió una semana después de la reactivación virológica; la supervivencia sin VHB en el grupo 1 fue significativamente superior al grupo 2 y tres pacientes sufrieron reactivación luego de la suspensión de lamivudina (Lau GKK et al. Gastroenterology 2003;125:1742).
¿Cuándo se debe suspender el tratamiento antiviral? ¿Al término de la quimioterapia, tres, seis o doce meses después, o nunca? En la Fig. 8 se resume un ejemplo de cómo se puede hacer lo correcto y luego cometer un error; se trata de un paciente con linfoma del grupo de Dai, del Este Asiático, que se trató por su linfoma con seis cursos de CHOP. Dado que era portador de hepatitis B, recibió lamivudina desde el primer día de tratamiento; en algún momento también recibió rituximab. La lamivudina se discontinuó a los seis meses y el paciente desarrolló rápidamente una reactivación, que primero se demostró en forma virológica y luego, por aumento del ALT. En este caso en particular se reinició la lamivudina y nunca más se suspendió. Si este paciente hubiera recibido lamivudina todo el tiempo, lo anterior no hubiera ocurrido, lo que no es menor, ya que la mortalidad de la reactivación es de 40% a 50%.
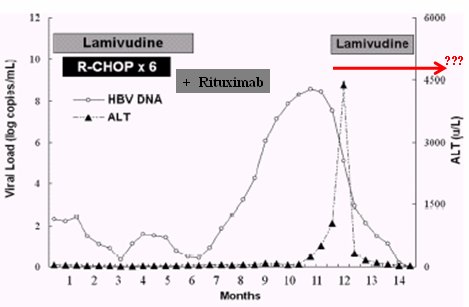 Tamaño completo
Tamaño completo Figura 8. Reactivación tardía de HBV después de la interrupción de lamivudina en un paciente con linfoma (Dai et al. Ann Hematol 2004;83:769).
Hui publicó un estudio con 46 pacientes hemato-oncológicos portadores de VHB que recibieron lamivudina una semana antes de la quimioterapia y la suspendieron luego de tres meses. El seguimiento fue de 26 meses. Cumplidos tres meses después del término de la quimioterapia y de la suspensión de lamivudina, casi 25% de los pacientes sufrieron una reactivación; en conclusión, tres meses no son suficientes (Hui et al. Gut Jul 14, 2005).
Transferencia de inmunidad adoptiva para VHB
La transferencia de inmunidad adoptiva para VHB es una maniobra inmunológica muy fácil de efectuar y que siempre deben considerar los hematólogos que realizan trasplantes de médula ósea o células madre periférica. Consiste en la inmunización de células hematopoyéticas donantes, para usar células y órganos de donantes inmunes a VHB.En un trabajo publicado en 1995, nuestro grupo evaluó a pacientes sometidos a trasplante de médula ósea de donantes inmunizados contra hepatitis B, es decir, donantes con un sistema inmune normal y anticuerpos contra hepatitis B. A las tres semanas del trasplante, los receptores desarrollaron anticuerpos anti hepatitis B, respondieron a un refuerzo de vacunación al final del período de inmunosupresión y presentaron respuesta anamnéstica. Esto se denomina transferencia de inmunidad adoptiva y es una maniobra muy simple, ya que lo único que hay que hacer es inmunizar a los donantes. Es una forma de proporcionar protección a pacientes inmunodeprimidos que reciben trasplantes de médula ósea o células madre, y su utilidad se ha confirmado constantemente en la literatura (Fig. 9).
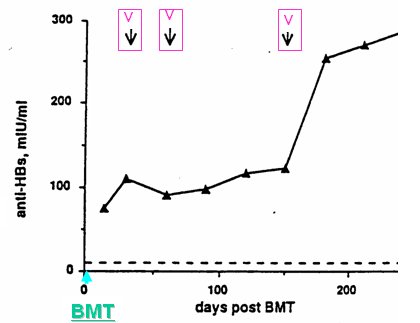 Tamaño completo
Tamaño completo Figura 9. Transferencia de inmunidad adoptiva para VHB en receptores de trasplante de médula ósea (memoria inmune preservada en 7/8 tests) (Shouval et al., Intervirology 1995;38:41)
Ilan describió un caso muy interesante de clearance de los marcadores séricos de HBV en un portador de HBsAg, después de un trasplante de médula ósea. Era un niño con linfoma, portador de HBsAg y portador de ADN viral. Recibió un trasplante de médula ósea, HLA compatible, de un hermano que tenía hepatitis B en recuperación y que era totalmente inmune a hepatitis B. El paciente, que tenía linfoma y trasplante de HBsAg, desarrolló anticuerpos anti-VHB con el refuerzo. Hubo una pequeña elevación de ALT, como una recaída de hepatitis y la enfermedad se curó (Ilan Y. et al., Gastroenterology 1993; 104:1818).
Lau, en Hong Kong hizo un seguimiento prospectivo de receptores de trasplante de médula ósea que eran HBsAg positivos y demostró que, después de la transferencia de inmunidad adoptiva para HBV, el HBsAg se negativiza, aparecen anticuerpos y se elimina el ADN viral; 6 de 17 pacientes eliminaron la hepatitis B luego de esta maniobra (Fig. 10).
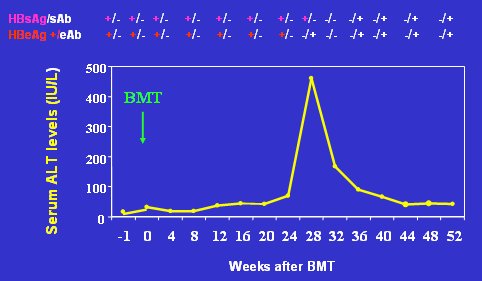 Tamaño completo
Tamaño completo Figura 10. Seguimiento prospectivo de receptores de trasplante de médula ósea, después de transferencia de inmunidad adoptiva a HBV (Lau et al. Gastroenterology 2002)
Este principio se ha demostrado en modelos experimentales en ratones, ratas y, en los últimos años, en receptores de hígado desde donantes con inmunidad. Al parecer, el órgano que se trasplanta contiene linfocitos inmunes contra hepatitis B y hay alguna evidencia de que estos pacientes desarrollan anticuerpos anti-VHBs.
Queda un gran número de temas sin resolver: ¿Con qué prontitud se debe iniciar el tratamiento preventivo en pacientes inmunodeprimidos? ¿Cuánto tiempo se debe administrar en pacientes de riesgo? ¿Cuál es la mejor estrategia para prevenir la aparición de cepas mutantes de escape? ¿Por qué se presentan reactivaciones en pacientes tratados en forma preventiva? Esto es importante, ya que algunos pacientes se van a reactivar, no importa lo que se haga, por razones muy complejas. ¿Cuál es la explicación de la ausencia ocasional de reactivación de VHB en pacientes con hepatitis B, oculta o evidente, luego de terminar la quimioterapia? El primer paciente con hepatitis B fue el clásico paciente con una reactivación: tenía ADN de VHB negativo, porque es probable que la medición haya coincidido con la caída del ADN y el aumento de ALT; además tenía IgM anti-VHBc positivo, por lo que había evidencia de reactivación, en cuya cinética no siempre se encuentran evidencias de ADN de VHB. Es probable que esta situación se deba a mutaciones que los test convencionales no detectan. La última pregunta es ¿con qué frecuencia se deben monitorizar los pacientes en riesgo de hepatitis B?
Conclusiones
- A los pacientes inmunodeprimidos con infección oculta o evidente por VHB se les puede proteger contra la reactivación de la infección de VHB, gracias a una nueva generación de antivirales disponibles.
- En este contexto, el tratamiento precoz y preventivo es superior al tratamiento diferido, una vez que se manifiesta la reactivación.
- No hay consenso en cuanto a la duración de la terapia; pero los análogos de nucleósidos proporcionan protección adecuada cuando se administran en forma preventiva y por al menos seis semanas luego del término de la quimioterapia, aunque este lapso podría no ser suficiente y lo ideal serían doce semanas.
- Todos los pacientes candidatos a trasplante de órganos e inmunodeprimidos se deben vacunar contra VHB tan pronto como sea posible, previo al trasplante.
- Se debe reforzar la preocupación sobre el riesgo de reactivación de VHB, especialmente entre los hematólogos, oncólogos y cirujanos de los equipos de trasplante.
- El screening para marcadores de HBV (y HCV) es absolutamente obligatorio en todos los pacientes programados para trasplante de órganos, diálisis, immuno o quimioterapia.
- La inmunización contra HBV se debe realizar cuanto antes y se debe documentar al paciente no respondedor.
- Los portadores de HBsAg, con independencia de su estado del ALT, se deben proteger contra la reactivación de HBV mediante un agente antiviral, durante e inmediatamente después de quimio o inmunoterapia.
- La longitud de la terapia antiviral no está establecida, pero es muy recomendable continuar el tratamiento durante 6 a 12 meses después de terminar la quimioterapia o inmunoterapia.

