Cursos
← vista completaPublicado el 1 de octubre de 2006 | http://doi.org/10.5867/medwave.2006.09.3388
Glicoproteína P como factor pronóstico y objetivo terapéutico en pacientes con leucemia mieloide aguda
P-glycoprotein as a prognostic factor and therapeutic target in patients with acute myeloid leukemia
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2005. Director: Dr. José Manuel Ojeda.
Entre las bases fundamentales de la terapia de las neoplasias hematológicas está el uso de quimioterapia, inmunoterapia y modificadores de la respuesta biológica; sin embargo, en muchos casos se observa resistencia a los fármacos antitumorales, la que puede ser primaria, que es aquella resistencia que se detecta desde el momento del diagnóstico, o secundaria o adquirida, que es la que se presenta después de una respuesta inicial satisfactoria.
La resistencia a fármacos antineoplásicos se puede clasificar en dos tipos: aquella que impide la buena distribución de las drogas en las células tumorales o aquella que surge de las células mismas, por alteraciones genéticas y epigenéticas que afectan la sensibilidad de la droga, por mecanismos celulares. En el caso de la mala distribución, ésta puede ser causada por: mala absorción; aumento del metabolismo y la excreción; bajo nivel de vascularización del tumor; y razones farmacológicas, ya que existen fármacos que no atraviesan barreras fisiológicas, como la barrera hematoencefalica, en el caso de la quimioterapia de inducción de las leucemias linfoblásticas agudas, lo que obliga al uso de quimioterapia intratecal (santuarios farmacológicos).
Los mecanismos celulares de resistencia a quimioterapia se pueden explicar por:
- descenso en la captación intracelular, como ocurre en el bloqueo o inactivación del sistema de transporte transmembrana del metotrexato;
- activación de sistemas detoxificantes, como la destoxicación por glutation, en el caso de mercapturatos, glucurónidos y metiltioderivados;
- inducción de la síntesis de metalotioneinas, oxidasas de función mixta dependientes del citocromo P450 que intervienen en el metabolismo del 70-80 % de los fármacos usados en clínica;
- activación de la reparación ADN a través del sistema 0 6 metiltransferasa, que elimina grupos metilo de la posición 0 6 de guanin, ya que la metilación de guanina en la citada posición es la principal lesión que causan fármacos como dacarbazina, estreptozocina y nitrosureas (BCNU y CCNU9, por lo que la capacidad reparadora de las lesiones en el ADN se ha relacionado con la resistencia a agentes alquilantes;
- inhibición de la apoptosis, sea por vía extrínseca, modificando el receptor ligando y dominio de muerte, o por vía intrínseca, a través de sobreexpresión de BCL 2;
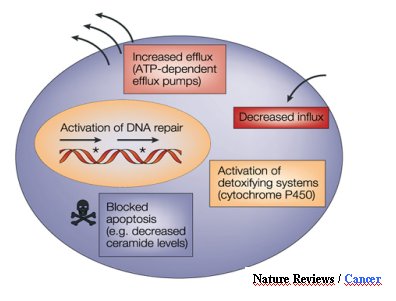
- finalmente, el aumento de la excreción extracelular de fármacos por mecanismos como los transportadores ABC, que son proteínas de transmembrana que usan ATP para transportar gran variedad de moléculas.
Los transportadores ABC se clasifican según su dominio de unión a ATP (NBFs, que se ubican en el citoplasma) y son unidireccionales, es decir, mueven sustancias hacia fuera de la célula o hacia compartimientos y funcionan como bombas de efusión de compuestos hidrofóbicos neutros y catiónicos, dependientes de energía. Se han descrito múltiples transportadores ABC, dentro de los cuales está la glicoproteína P, una proteína de transmembrana de 170 kDa que se considera como un marcador de la resistencia a múltiples fármacos (Figura 1).
 Tamaño completo
Tamaño completo Figura 1.
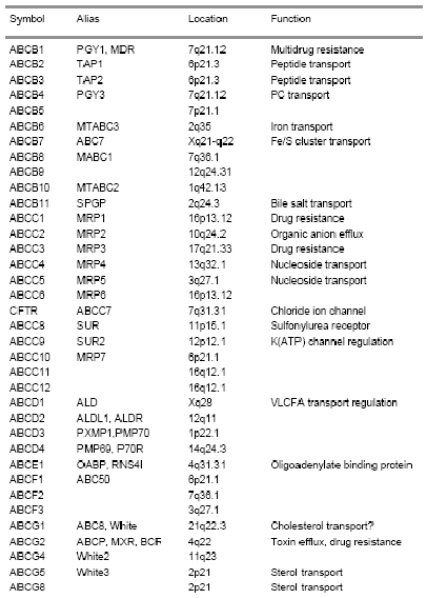
El estudio del genoma humano ha permitido identificar múltiples miembros de la familia de transportadores ABC (ATP-binding cassette), localizar el sitio exacto de sus genes y, en algunos de ellos su función (Tabla I). Algunas de estas proteínas tienen funciones fisiológicas y otras están vinculadas a la resistencia drogas. Desde su descubrimiento, en 1992, la glicoproteína P ha sido la más estudiada proteína de resistencia a multidrogas, ya que es capaz de transportar un amplio espectro de drogas anticancerosas a través de la membrana celular, limitando su acción antiproliferativa (1). El fenotipo de resistencia a drogas resulta de la expresión del gen MDR1 2 y su producto, la glicoproteína P, también se denomina ABCB1 3.
 Tamaño completo
Tamaño completo Tabla I.
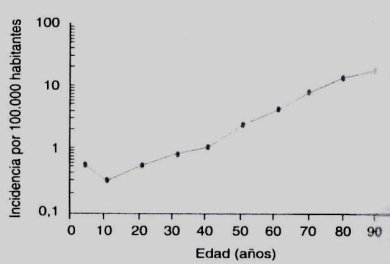
La incidencia de leucemia mieloide aguda (LMA) se van incrementando con la edad (Fig. 2), siendo de 5 x 100.000 habitantes a los 60 años y de 17 x 100.000 a los 80 años; la edad media de presentación es de 62 a 64 años y corresponde a 75 a 80 % de las leucemias agudas del adulto. El resultado del tratamiento de pacientes de edad con LMA, es hasta la fecha, altamente insatisfactorio: las tasas de remisión completa en mayores de 60 años oscilan entre 45 y 60%, la sobrevida media libre de enfermedad se estima en menos de 12 meses y la sobrevida total a 5 años es de aproximadamente 10% (4).
En Chile los resultados son algo inferiores que los descritos en la literatura internacional, según datos extraídos de la experiencia chilena con el protocolo PANDA (pacientes menores de 60 años), según los cuales la tasa de remisión completa es de 58%, la mortalidad precoz, de 24% y la sobrevida libre de enfermedad a 5 años, de 15%. Los resultados del tratamiento, en el ámbito nacional e internacional, obligan a la búsqueda de nuevas alternativas terapéuticas y a la determinación de nuevos factores pronósticos que inducirán, probablemente, el cambio en los actuales protocolos de tratamiento.
 Tamaño completo
Tamaño completo Figura 2.
Los factores de riesgo pronósticos en LMA incluyen la edad, aparición de novo o secundaria, recuento inicial de leucocitos, inmunofenotipo y características citogenéticas; sin embargo, un potencial e importante factor pronóstico biológico es la alta incidencia de un fenotipo intrínseco de resistencia a drogas (MDR).
La expresión y función de glicoproteÍna P, que actúa sobre drogas que se usan habitualmente en los protocolos de tratamiento de las LMA, se va incrementando con la edad, siendo de 17 % en pacientes menores de 35 años, 27% entre 35 y 50 años, 39% en pacientes sobre 50 años y sube hasta 71% en el grupo de edad media de 68 años (56-88 años) (5). En estudios retrospectivos, la expresión de glicoproteína P se asoció a tasas más bajas de remisión completa, disminución de la sobrevida total y sobrevida libre de enfermedad (6). Además, la expresión de fenotipo de resistencia a drogas medido por la expresión de glicoproteína P, sumado a otros factores, se usan actualmente para predecir la respuesta a la quimioterapia de inducción y la posibilidad de recaída una vez obtenida la remisión completa (Tabla II) (7).
 Tamaño completo
Tamaño completo Tabla II.
Dado que los pacientes de edad con LMA tienen una alta frecuencia de expresión de glicoproteína P, que es un mediador de la resistencia a múltiples drogas que se asocia a tasas más bajas de remisión completa, sumado a los resultados adversos conseguidos a la fecha en el tratamiento de esta patología, glicoproteina P representa un objetivo apropiado para la intervención terapéutica en este grupo de edad (8).
Existen diferentes agentes que inhiben la función de glicoproteína P, por ejemplo, drogas como verapamilo, quinina y ciclosporina A, pero su utilidad clínica está limitada por efectos adversos, como la hipotensión, en el caso de verapamilo, y potencial inmunosupresión y nefrotoxicidad, con ciclosporina A.
PSC-833 (Valspodar R) es un análogo de ciclosporina que no es inmunosupresor ni nefrotóxico y es 20 veces más potente que CSA en incrementar retención de daunorubicina en células resistentes a múltiples drogas (9) y las concentraciones de PSC-833 suficientes para bloquear la función de gpP in vitro se logran con dosis relativamente libres de efectos adversos (10); sin embargo, la aplicación clínica de PSC-833 está condicionada por el clearence de drogas citotóxicas que son susceptibles de su expulsión mediada por gp-P, por lo que es necesario reducir drogas como antraciclinas y epipodofilotoxinas cuando se administran en regímenes que contienen PSC-833.
Se han realizado estudios fase 1 (farmacológicos), que se realizan para determinar los niveles de seguridad de las dosis y/o esquemas de drogas en seres humanos, como el estudio CALGB 9420 (Cáncer and leukemia Group B Study 9420), que estableció las dosis equivalentes en toxicidad con esquemas con y sin PSC-833 (11). El establecimiento de estas dosis permitió realizar ensayos de fase 3 (comparativos) que se realizan para establecer la eficacia de un nuevo tratamiento comparado con el mejor tratamiento convencional, como el estudio del modulador de resistencia de multidrogas PSC-833 que se efectuó en pacientes previamente no tratados de 60 años o más con LMA (CALGB 9720) (8); es este estudio se planteó la hipótesis de que el uso combinado de quimioterapia más inhibidor de gpP podría aumentar la fracción de células destruidas por quimioterapia sin necesidad de ir escalando dosis y su objetivo fue determinar si PSC-833 más quimioterapia mejoraba las tasas de remisión completa, sobrevida libre de enfermedad y sobrevida total en pacientes con LMA mayores de 60 años.
En este estudio, la expresión de gp P se midió con un anticuerpo monoclonal MRK 16 unido a fluorocromo, con positividad de 0,10 o mayor; y la función de gpP se estudió por la expulsión de 3,3 diethiyloxacarbocyanine iodide DiOc2 (3) fluorescente, con y sin PSC-833. Se consideró que la muestra era positiva para ser modulada por PSC-833 con un valor de 0,20 o mayor; las muestras se analizaron por citómetro de flujo. La randomización debió ser detenida, debido a excesiva mortalidad en el brazo que contenía PSC 833. El análisis de las probables causas de la alta mortalidad durante la inducción en el grupo con PSC-833, comparado con el grupo sin inhibidor de gpP, incluyó la edad, antecedentes de SMD, fracción de eyección ventricular izquierda y creatininemia, pero ninguno de ellos se correlacionó con la mayor inducción de muerte en este grupo. La toxicidad hematológica fue similar en ambos grupos y la toxicidad no hematológica fue más frecuente en el grupo con PSC-833, con diferencia estadísticamente significativa para los efectos digestivos, lo que no explica la alta mortalidad. Se concluyó que la causa de muerte en la mayoría de los pacientes fue una falla multiorgánica ocurrida en el contexto de fiebre sin infección documentada, por razones no aclaradas. Los estudios fase 1 y 2 no predijeron una mayor mortalidad en el grupo con PSC-833.
Las conclusiones finales de este estudio se pueden resumir señalando que, aunque los regímenes comparados eran equivalentes en su toxicidad según los estudios fase 1 previos, la excesiva mortalidad precoz en el grupo PSC-833 obligó a cerrar el estudio, de modo que el poder para detectar diferencias en DFS y sobrevida fue bajo, debido al pequeño número de pacientes. Los pacientes del grupo sin PSC-833 con efflux positivo (expresión positiva de gpP) tuvieron una RC menor (41%) que aquellos con efflux negativo(91%), lo que hace de éste un factor pronóstico. En el subgrupo de pacientes con efflux positivo, DFS fue de 5 meses sin PSC-833 y 14 meses con PSC-833 (p= 0,07). Sin embargo, el bajo número de paciente impide análisis concluyentes. En relación con tasas de remisión completa, sobrevida total y sobrevida libre de enfermedad en ambos grupos, no hubo diferencias estadísticamente significativas, por lo que se concluyó, finalmente, que en futuros trabajos la asignación de QT más un modulador de la gpP se debería indicar sólo a pacientes con efflux positivo; y que en futuros estudios en pacientes mayores de 60 años se deberán utilizar esquemas menos tóxicos.
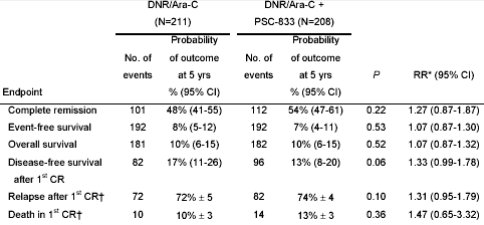
En un estudio reciente, publicado en la revista Blood online en junio de 2005 y titulado “The value of the MDR1 reversal agent PSC-833 in addition to daunorubicin and cytarabine in the treatment of elderly patients with previously untreated acute myeloid leukemia (AML), in relation to MDR1 status at diagnosis”, se trató de mejorar la respuesta al tratamiento agregando PSC-833, pero no hubo resultados favorables (12). Este estudio reclutó a 419 pacientes no tratados previamente, de 60 años o más, que fueron randomizados para recibir ciclos de inducción con daunorubicina y citarabina con y sin PSC-833, con lo que se demostró que PSC-833 no mejoraba la tasa de respuesta y sobrevida en pacientes con LMA mayores de 60 años (Tabla III).
 Tamaño completo
Tamaño completo Tabla III.
En este mismo trabajo se intentó establecer el valor pronóstico independiente de gpP, para lo cual se determinó el status de la gp P en los blastos en el momento del diagnóstico y se encontró que 73% de los pacientes se clasificaron como gpP positivos, lo que está de acuerdo con datos publicados previamente (13) y confirma que el status positivo para gpP es un factor de pronóstico adverso independiente en pacientes de edad con LMA. Las tasas de remisión completa, sobrevida libre de eventos, sobrevida libre de enfermedad y sobrevida total disminuyen cuando se incrementa el status positivo de gpP.
La conclusión final es que se debe continuar la búsqueda de nuevas estrategias para sobrepasar la resistencia mediada por MDR1.

