Cursos
← vista completaPublicado el 1 de diciembre de 2002 | http://doi.org/10.5867/medwave.2002.11.3501
Nuevas terapias en el cáncer de pulmón I
New therapies in lung cancer I
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la Universidad de Chile durante los días 3 de abril y 7 de agosto de 2002.
Editor Científico: Dr. José Manuel Ojeda.
El cáncer de pulmón da cuenta de 170.000 nuevos casos cada año. Menos del 15% de los pacientes sobrevivirán a esta enfermedad (1), a pesar de la tecnología refinada en la cirugía y avances en radioterapia y quimioterapia.
Los cánceres de pulmón son divididos, según la anatomía patológica, en cuatro variedades que incluyen: cáncer no células pequeñas (NSCLC) con tres subtipos: adenocarcinoma, cáncer de células escamosas y cáncer indiferenciado de células grandes, y cáncer indiferenciado de células pequeñas (SCLC).
Los pacientes con NSCLC en etapas tempranas son tratados con cirugía y los de etapas tardías con radioterapia y/o quimioterapia. La sobrevida a dos años para pacientes en Estadio III es de 20% y 5% en Estadio IV. Las cifras de sobrevida han permanecido sin cambios por muchos años. La identificación de nuevas terapias menos tóxicas es fundamental para mejorar las actuales estrategias de tratamiento y el desarrollo de estas nuevas terapias dependerá de la biología molecular de estos tumores. Numerosos estudios indican que el mecanismo de muerte celular inducido por radioterapia y quimioterapia es la apoptosis. Muchos de los genes implicados en la apoptosis han sido identificados y muchos están mutados o alterados. Muchos tumores resistentes a la radio y quimioterapia también son resistentes a la apoptosis en cultivos in vitro. En los años recientes ha quedado claro que el cáncer es causado por mutaciones de DNA que ocurren secuencialmente en el tiempo.
La patogénesis molecular del SCLC y NSCLC es diferente (2). Algunas de estas alteraciones pueden servir de blanco para nuevos agentes de terapia. Ellas son:
- Inmunoterapia
- Ihibidores de moléculas
- Oligonucléotidos antisense
- Terapias génicas
Esta clasificación es artificial ya que existe sobreposición en muchos aspectos de estas terapias.
Vías de traducción de señales
Los principales componentes de la vía de señales de la célula, tales como proteína tirosin kinasa (PTKs), proteína kinasa C (PKC) y los sistemas de proteína kinasa activada por ras(MAPK), están alterados en las células de cáncer de pulmón por oncogenes, ya sea por sobreexpresión o mutación, llevando a una desrregulación en las señales celulares y la proliferación celular.
Vías de señal intracelular
PTKs
PTKs es una gran familia de oncogenes dominantes. Los dos mayores grupos son: receptor tirosin kinasa y no receptor tirosin kinasa. Los receptores tirosin kinasa (RTKs) son glicoproteínas, la unión del ligando a RTKs induce oligodimerización del receptor, autofosforilándose. Posteriormente ocurren cambios conformacionales, uniones y activación de moléculas río abajo, tales como fosfolipasa C (PLC), kinasa 3 fosfoinosititida (PI3K) y ras (Figura 1).
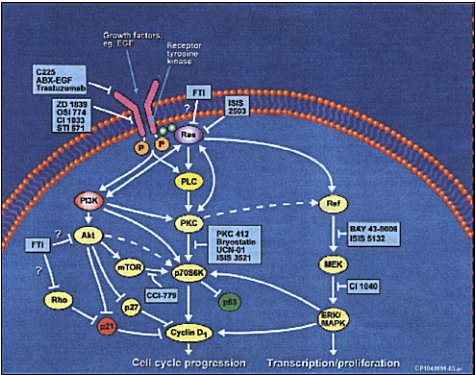 Tamaño completo
Tamaño completo Figura 1. Cambios conformacionales.
La actividad de los RTKs está controlada en células normales en reposo. En tumores malignos, genes que codifican para estos receptores escapan de los mecanismos intracelulares regulatorios.
Los RTKs han sido organizados en familias. Las variadas subfamilias incluyen los receptores del factor de crecimiento epidermal (EGFR), factor de crecimiento derivado de las plaquetas (PDGF), VEGF, factor de crecimiento de fibroblastos y factor de crecimiento del hepatocito.
La familia EGFR
EGFR difiere de los otros RTKs en que es codificada en el cromosoma 7p11 a 13. Otros tres miembros de esta familia, HER2, HER3 y HER4 (llamados también erbB2, erbB3, erbB4) son conocidos. Miembros de la familia de EGFR y sus ligandos son sobreexpresados o expresados de forma autocrina en un gran número de tipos tumorales, incluyendo cáncer pancreático, pulmón, ovario, renal, gástrico, hepatocelular y mama. EGFR sirve como receptor predominante para múltiples distintos ligandos incluyendo EGF, factor transformante de crecimiento alfa, anfirregulina y el factor de crecimiento que une heparina. La mayor función de estos otros receptores parece estar en los efectores río abajo de cada uno de éstos, fosforilan y modulan las señales de cada uno de los otros pares específicos. La unión de un ligando, produce dimerización y la subsecuente fosforilación de proteínas traduciendo proliferación celular y señales de sobrevida a través de ras/MAPK y PI3K/Akt (4)
Anticuerpos anti EGFR
Cetuximab(C225) y ABX-EGF: Uno de los agentes es el mAb quimérico ratón-humano 225 (C225). Inhibe completamente la activación de EGF-RTK, causando una detención del ciclo celular en G1 produciendo un aumento de los niveles de p27KIP1 y la inhibición de la actividad de la ciclina dependiente de kinasa (cdk2) (5). C225 mostró actividad sinérgica antitumoral con agentes como cisplatino, doxorrubicina, topotecán y paclitaxel. Estudios fase I han establecido la seguridad de la administración. Datos de estudios Fase II indican que la actividad antitumoral está aumentada al usarse en combinación con quimioterapia.
ABX-EGF: es una inmunoglobulina humanizada mAb que se une específicamente a EGFR humano con alta afinidad. Los modelos de estudio tumoral demuestran una erradicación completa de grandes tumores. No hay efecto en tumores EGFR negativos.
Anticuerpos antiHER2
Trastuzumab y una vacuna peptídica quimérica MVF-HER2 célula B (628-647): el protooncogen HER2/neu codifica la glicoproteína receptor transmembrana 185Kd (p185) con actividad intrínseca tirosin kinasa. Cuando la proteína HER2/neu está activa, puede interactuar con muchas proteínas diferentes tales como PLC y la vía ras/MAPK (6).
Está sobreexpresada en aproximadamente 30% de los NSCLC, predominantemente en adenocarcinoma y también en SCLC. Se ha relacionado con sobrevida más corta en SCLC avanzado.
La angiogénesis está también implicada como mecanismo de agresión inducido por HER2/neu porque la sobreexpresión de p185 resulta en una expresión aumentada del mRNA de VEGF con inducción y mejoramiento de la secreción de VEGF. Dando un aumento en la propensión de metástasis a distancia y además un aumento de la secreción de metaloproteinasas (7).
Estudios recientes han indicado que la sobreexpresión de p185 está asociada con aumento en la resistencia a una amplia variedad de quimioterápicos, incluyendo: cisplatino, etopósido, doxorrubicina y placlitaxel (8).
Trastuzumab: es un anticuerpo monoclonal recombinante humanizado contra el receptor HER2, con actividad demostrada en cáncer de mama metastásico. En células cultivadas que expresan altos niveles de HER2, trastuzumab causa una detención del crecimiento en GoG1 del ciclo celular.
En líneas celulares de cáncer de pulmón, la inhibición ocurrió sólo en líneas celulares con la expresión de HER2/neu (9). Estos datos sugieren que el tratamiento de células que sobreexpresan HER2 es antiproliferativo y la citostasis puede resultar de la inhibición de la progresión del ciclo celular. Anticuerpos anti HER2 también median la citotoxicidad dependiente de complemento y/o citotoxicidad celular dependiente de anticuerpos. En estudios preclínicos precoces, Slamon et al demostraron interacciones entre trastuzumab y los agentes anticancerígenos. La interacción sinérgica de trastuzumab con los agentes alquilantes, análogos de platino e inhibidores de topoisomerasa II así como la interacción aditiva con taxanos, antraciclinas y algunos antimetabolitos en células de cáncer de mama con sobreexpresión de HER2/neu, guiaron a estudios clínicos. Aunque datos preclínicos muestran una inhibición aditiva de líneas celulares de cáncer de pulmón que sobreexpresan HER2/neu con la combinación de trastuzumab y otros agentes citotóxicos, los resultados de la combinación de quimioterapia con trastuzumab en pacientes con NSCLC cuyos tumores sobreexpresan HER2/neu son desalentadores. Esto se puede relacionar con el grado de expresión de HER2/neu en NSCLC y la heterogenicidad de su expresión en los pacientes tratados.
Induce inmunidad activa, sin embargo, no es claro si los humanos pueden montar una respuesta inmune efectiva con estrategias de vacuna basadas en proteínas o células, porque HER2 es un antígeno propio no mutado. Además, algunos anticuerpos estimulan más que inhiben el crecimiento de tumores humanos y las vacunas HER2 presentan múltiples epítopes que podrían dar una respuesta humoral contraproducente.
MVF-HER2(628-647): Es una vacuna péptido quimérico células B que incorpora epítope del linfocito T helper dando altos títulos de anticuerpos a HER2 (10). Estos anticuerpos obtenidos tuvieron una actividad antitumoral in vitro y previnieron el desarrollo tumoral in vivo.

