Cursos
← vista completaPublicado el 1 de enero de 2008 | http://doi.org/10.5867/medwave.2008.01.3602
Pasado, presente y futuro de la diálisis peritoneal
Past, present and future of peritoneal dialysis
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
Introducción
En 1982, en Chile había 208 enfermos en programa de sustitución renal. Esto no significa que la enfermedad renal haya aumentado, sino que desde entonces se han producido cambios estructurales profundos, que han permitido la sobrevida de un gran número de pacientes (alrededor de 30.000) que en esa época hubieran fallecido.En el año 2005 había 10.693 pacientes en diálisis, con 685 por millón de población (pmp) en el país y 745 pmp en la Región Metropolitana; en 2006 ya hay más de 11.000 pacientes y sobre 700 pmp en Chile, que con estas cifras ocupa el segundo lugar en latinoamérica, después de Uruguay.
La diálisis peritoneal a través de la historia
Entre 1755 y 1763 tuvo lugar la guerra de los 7 años, en la que Prusia se unió a Inglaterra para atacar a Austria y Francia, en la invasión de Silesia. La publicación más antigua sobre diálisis peritoneal es de esa época: el autor es Chistopher Warrick, un cirujano inglés que, en un intento de tratar las ascitis, introdujo un catéter en el abdomen de un paciente con esta condición y le administró agua de Bristol y licor, con la idea de cerrar los linfáticos y curar la ascitis, según la idea de moda en ese momento. Es la primera publicación en que se describe la maniobra de introducción de catéter y administración de soluciones al peritoneo (1).Entre 1765 y 1775, una década después, ya establecida la independencia americana, Wegner y Starling fueron los primeros en elaborar métodos en animales para efectuar diálisis peritoneal, pero siempre pensando en el cierre del sistema linfático (2, 3).
Entre 1914 y 1918, con los vientos de la primera guerra mundial, apareció la primera publicación seria sobre el equilibrio de la sustancias cristaloides y coloides en el peritoneo. Putnam, fisiólogo, (1894-1975) descubrió que la teoría de Graham en membranas de celulosa también se puede aplicar al peritoneo y publicó por primera vez la idea de que el peritoneo se puede considerar como una membrana, a través de la cual se producen equilibrios osmóticos (4).
Georg Ganter (1885-1940), en Alemania, fue el primero que planteó que la capacidad de esta membrana peritoneal para mantener un equilibrio osmótico se podría utilizar para extraer sustancias (5).
Entre 1939 y 1945 ocurrió la segunda guerra mundial, el congreso de Nuremberg y la invasión de Normandía, entre muchos otros hitos históricos. Poco después, en 1946, Frank, Seligman y Fine describieron el primer caso de insuficiencia renal aguda (IRA) tratado con diálisis peritoneal con flujo continuo. En ese momento toda la atención estaba puesta en salvar a los enfermos con IRA, nadie pensaba en los enfermos crónicos. Ellos desarrollaron las bases de la instalación, administración y retiro de la solución, aunque pasó un tiempo hasta que se demostró que era necesaria su permanencia dentro del peritoneo (6).
Entre 1951 y 1953 sobrevino la guerra de Corea. De esa época data el gran aporte de Morton Maxwell (1924-2000), que junto a Kleeman fue el autor de un gran tratado sobre trastornos hidroelectrolíticos e inventó el “frasco colgante”, que en realidad es el “sistema cerrado”. Fue el primero que efectuó la administración, permanencia y extracción de ese líquido en un circuito cerrado (7).
En 1959, Doolan fabricó el primer catéter que se elaboró específicamente para este procedimiento y por primera vez utilizó la diálisis peritoneal para el tratamiento de un paciente con insuficiencia renal crónica. Este trabajo fue rechazado, pero fue la base para el desarrollo posterior del concepto de la diálisis peritoneal continua ambulatoria (DCPA), que fue introducido por Popovich y Moncrief entre 1976 y 1978 (8).
En Chile, en 1958 fue elegido el Presidente Alessandri y en 1960 fue ordenado el Cardenal Raúl Silva Henríquez; ese mismo año, un gran terremoto asoló al sur del país. El gran problema de los médicos chilenos de ese entonces era la insuficiencia renal aguda secundaria a aborto séptico, que mataba a muchas mujeres jóvenes; todo lo que se desarrolló en Chile, en cuanto a hemodiálisis y diálisis peritoneal, se hizo para salvar a estas mujeres. La primera publicación chilena disponible es la experiencia de Aguirre, Vaccarezza, Delgado y Arrellano, del hospital Deformes, en el Congreso de la Sociedad Médica de Valparaíso en el año 1964; ellos describieron los primeros resultados del tratamiento con esta modalidad de terapia en pacientes con IRA (9). En forma paralela, en el hospital Salvador de la Universidad de Chile, Castro, Aquiargo y Ordoniz, y en el hospital José Joaquín Aguirre Torretti, Silva, así como otros autores elaboraron sus primeras experiencias, que se publicaron un año después (10, 11). En 1966, dos años después, tanto el grupo de Valparaíso como el de Santiago publicaron en forma más extensa los resultados de estas experiencias preliminares (12, 13).
En 1978, Dimitrik G. Oreopoulos desarrolló el sistema cerrado de bolsas colapsables y el sistema de conexión en “Y”. Lo que ahora es de uso común, en esa época permitió avanzar en forma significativa en el control de las infecciones, puesto que este dispositivo evitó las conexiones y desconexiones múltiples (14). Posteriormente Díaz-Buxo creó la terapia con cicladora (DCPP) (15). Nada de esto hubiese sido posible sin los catéteres, que fueron “presentados en sociedad” por Henry Tenckhoff, en el Congreso de la ASAIO de 1968. Posteriormente se ha desarrollado una gran variedad de catéteres.
En esta época se destacó en Chile el Dr. Roberto Ortiz, que planificó y llevó a cabo la inserción de más de 100 enfermos con insuficiencia renal crónica terminal, en un programa de diálisis peritoneal crónica intermitente; logró esto sin apoyo ni reembolso de ninguna naturaleza. Presentó sus primeros resultados en el I Congreso Chileno de Nefrología, que se efectuó en el Hospital Van Buren, Valparaíso, en 1982 y en su última publicación, en 1995, resumió 12 años de experiencia en el desarrollo de la diálisis peritoneal (16). Murió en un accidente aéreo en el año 2002.
Diálisis peritoneal en Chile: estado actual
El presente de la diálisis peritoneal es un orgullo para los chilenos, ya que el rango actual de cobertura para la sustitución renal es 100%. Esto no fue fácil. En un número de 1987 de la revista del Colegio Médico de Chile, Vida Médica, se publicó el veredicto de la Cuarta Sala de la Corte de Apelaciones de Santiago, que benefició a una enferma de 21 años, Laura Vallejos: por primera vez en Chile, la Corte acogió un recurso de amparo para proteger la vida de una paciente lúpica que había sido trasplantada, había rechazado el trasplante, requería diálisis y no tenía acceso a ella (17). Lamentablemente esta paciente falleció poco después de que se inició el procedimiento, pero la respuesta a su caso se constituyó en ley y permitió a los chilenos compartir un lugar de privilegio, al lado de Suecia y Dinamarca, en cuanto a prevalencia de pacientes con enfermedad renal en etapa terminal (Fig. 1).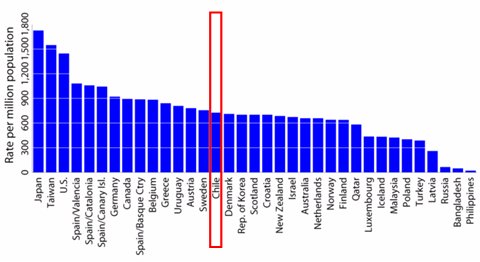 Tamaño completo
Tamaño completo Figura 1. Prevalencia de enfermedad renal en etapa terminal (tasa por millón de habitantes) ADR 2004
En Chile existe una extensa red de centros de hemodiálisis y trasplante, pero el número de centros de peritoneodiálisis todavía es reducido. Otro aspecto importante es que la mayor parte de las unidades en Chile está en el sistema privado, lo que significa que éste hizo una gran inversión en infraestructura. Así, en Chile existen 197 unidades de hemodiálisis, de las cuales 37 están en hospitales públicos y 160 (81%), en centros privados; los primeros a 1.518 pacientes y los privados, a 9.175 (90%). Esto contrasta con la situación de México, donde se diseñó un gran programa de diálisis peritoneal, pero no se implementó la infraestructura que se requería para dar cobertura a todos los enfermos, lo que acarreó un gran problema. Finalmente, un problema que existe en Chile es la baja cantidad de nefrólogos reconocidos por CONACEM (en total, 82).
En cuanto a la población en riesgo, se sabe que los principales factores que favorecen el desarrollo de insuficiencia renal crónica (IRC) son, en el mismo orden: diabetes, hipertensión, edad mayor de 60 años y tener familiares de primer grado hipertensos, diabéticos o nefrópatas. En Chile, datos del estudio CARMEN indican que casi 4% de las personas son diabéticas y los resultados de la Encuesta Nacional de Salud señalan que 33,7% son hipertensos, de modo que las probabilidades de que siga aumentando el número de portadores de IRC es enorme.
En el año 2004, la Sociedad Chilena de Nefrología hizo un cálculo de los costos de la IRC terminal en Chile y estimó el gasto anual en hemodiálisis, diálisis peritoneal y trasplante en 110 millones de dólares, considerando en 59 dólares el costo de una sola sesión de hemodiálisis. Cuando comenzó el AUGE, en el año 2005, se consideró un presupuesto de 20 mil millones de pesos para las tres patologías que entraron en ese momento; de ese monto, 16.500 millones se destinaron a la IRC, lo que da cuenta de la magnitud del problema.
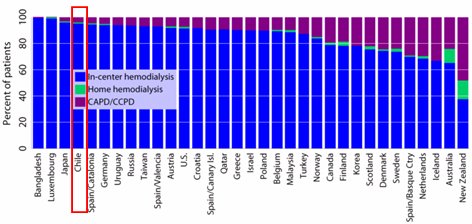
En cuanto a la modalidad de diálisis preferente en Chile, el porcentaje de uso de la peritoneodiálisis, que debería ser alrededor de 15 a 20%, es bastante bajo, menor de 5%, por razones que no se discutirán ahora (Fig. 2).
 Tamaño completo
Tamaño completo Figura 2. Prevalencia de pacientes en diálisis, según modalidad. ADR 2004.
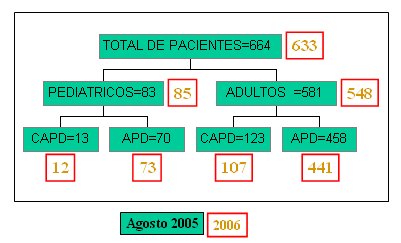
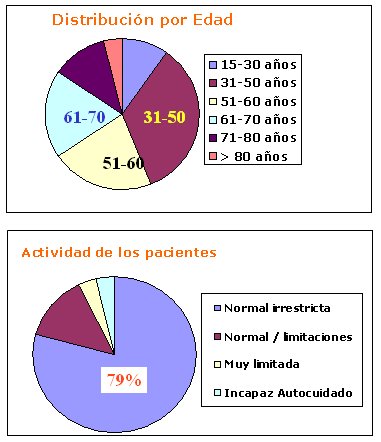
En la Fig. 3, los recuadros verdes muestran datos del año 2005 y los de borde rojo, del año 2006: las cifras van en descenso. Es de esperar que cuando se elimine la restricción del AUGE para la diálisis peritoneal se pueda revertir esta tendencia. En la Fig. 4 se muestra la edad de los pacientes y su grado de actividad, que es bastante alto.
 Tamaño completo
Tamaño completo Figura 3. Diálisis peritoneal en Chile, agosto 2005 y septiembre 2006
 Tamaño completo
Tamaño completo Figura 4. Edad y grado de actividad de los pacientes en Programa de Diálisis peritoneal en Chile (agosto 2005)
Los aranceles FONASA vigentes en Chile (2006) son: para Hemodiálisis Crónica (13 sesiones al mes, considerando 64 dólares por sesión), 834 dólares; y para Diálisis Peritoneal, mensual, cada modalidad, 1.144 dólares. Hay que recordar que en muchos países el arancel para hemodiálisis y para peritoneodiálisis es el mismo.
Futuro de la diálisis peritoneal en Chile
Uno de los grandes desafíos de los servicios de diálisis, hoy, enfrentar en forma adecuada el gran aumento de la población que requiere este procedimiento, cuya tasa de crecimiento en los próximos años, en Latinoamérica, se estima en 11% (Fig. 5).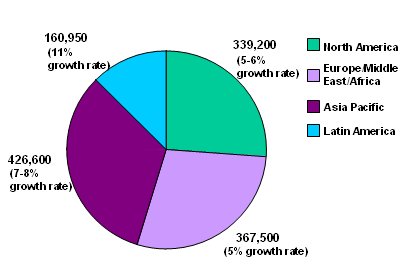 Tamaño completo
Tamaño completo Figura 5. Tasa de crecimiento de pacientes con enfermedad renal crónica etapa 5 en distintas regiones del mundo. No incluye pacientes trasplantados (n = 400.000). Población mundial total: 1,3 millones (18).
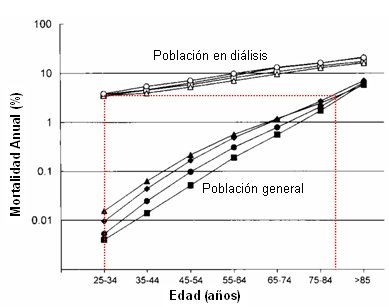
El otro desafío es lograr reducir la mortalidad; actualmente, la mortalidad cardiovascular de los pacientes en diálisis, a cinco años, es mucho mayor que la de la población general (Fig. 6).
 Tamaño completo
Tamaño completo Figura 6. Insuficiencia renal y mortalidad cardiovascular (19)
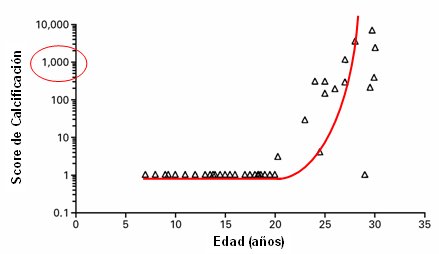
Otro parámetro importante es el grado de calcificación coronaria. En un trabajo de Goodman, efectuado en adultos jóvenes (18 a 35 años de edad) portadores de IRC terminal, se demostró que las calcificaciones coronarias aumentan en forma exponencial después de los 20 años de edad; y en este estudio, la mitad de los sujetos estaba en peritoneodiálisis (20) (Fig. 7).
 Tamaño completo
Tamaño completo Figura 7. Calcificación coronaria en adultos jóvenes portadores de IRC terminal (20)
En un estudio de Wolfe sobre la mortalidad de los pacientes con IRC terminal según modalidad de tratamiento, se encontró una tasa de mortalidad de 16,1/100 pacientes/año para todos los pacientes en diálisis; 6,3 para los pacientes en lista de espera; y 3,8 para los receptores de trasplante de cadáver (21). La diferencia es la misma para hemodiálisis y diálisis peritoneal, comparado con trasplante y es independiente del sexo y de si el paciente es o no diabético.
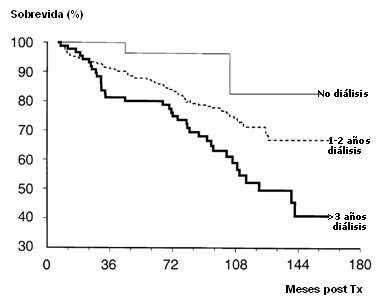
En la Fig. 8 se resumen datos de un estudio de 1998 el impacto de la diálisis previa al trasplante en la sobrevida de los pacientes después del trasplante renal; sin embargo, los grandes avances actuales en hemodiálisis y en diálisis peritoneal, con la diálisis automatizada sin duda que esta situación mejorará en forma sustancial.
 Tamaño completo
Tamaño completo Figura 8. Impacto de la diálisis previa al trasplante en la sobrevida de los pacientes después del trasplante renal (22)
Otro desafío es prolongar la diálisis peritoneal a largo plazo. Siempre se ha dicho que ningún paciente persiste en esta modalidad por más de 10 años, debido a las alteraciones que se producen en la estructura y función del peritoneo (23, 24, 25). Esto podría cambiar en el futuro, gracias a los avances en el conocimiento de los fenómenos celulares y moleculares que ocurren en la membrana peritoneal, en especial lo que se refiere a la transición de las células mesoteliales desde epiteliales a mesenquimáticas. Selgas y colaboradores demostraron que la célula mesotelial se trans-diferencia desde un fenotipo mesotelial a un fenotipo fibroblástico, lo que demuestra que los fibroblastos, que son los responsables últimos de la fibrosis de la membrana peritoneal, no provienen de la médula ósea ni de la circulación, sino de células mesoteliales que son inducidas a transformarse en fibroblastos por un estímulo determinado por la diálisis peritoneal (Fig. 9).
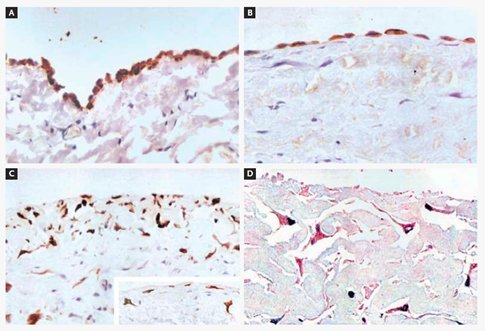 Tamaño completo
Tamaño completo Figura 9. Evidencia de transición epitelial-a-mesenquimática de las células mesoteliales del tejido peritoneal de pacientes en diálisis peritoneal ambulatoria continua (26)
Los mismos autores desarrollaron un algoritmo para explicar el mecanismo mediante el cual la diálisis peritoneal desencadena este proceso, en el cual está involucrado el TGF-beta, por un lado y los factores angiogénicos, entre ellos VEFG, por otro. Estos últimos han cobrado vital importancia, porque el peritoneo tiene una neoangiogénesis muy activa. Si se pudiera intervenir en estos fenómenos, es posible que se pueda evitar o reducir el daño y la fibrosis peritoneal secundaria a la diálisis (Fig. 10).
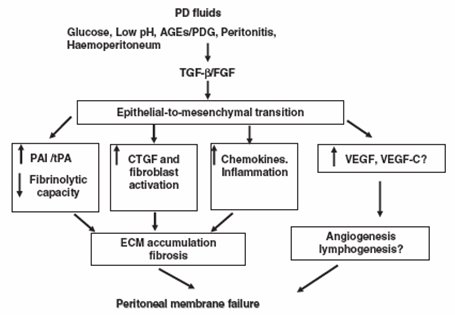 Tamaño completo
Tamaño completo Figura 10. Posible mecanismo que subyace la transición epitelial-a-mesenquimática de las células mesoteliales.
En el futuro, también habrá avances en el desarrollo de mejores líquidos para diálisis peritoneal. Los líquidos convencionales son incompatibles, debido a que tienen elevada concentración de glucosa y lactato, pH bajo, osmolaridad elevada, presencia de PDG (esterilización por calor) y formación de AGEPs (glicación de proteínas). Existe consenso en que el líquido ideal, es decir, el que logra equilibrio osmótico de la sustancia y además ultrafiltración, debe tener las siguientes propiedades: osmolaridad y pH fisiológicos; carecer de toxicidad peritoneal o sistémica; no provocar trastornos bioquímicos, metabólicos, inflamatorios; no inhibir los mecanismos de defensa local; tener nula o lenta y mínima absorción del agente osmótico; capacidad de ultrafiltrar agua y depurar toxinas urémicas; aportar nutrientes y electrólitos en caso de necesidad; corregir el equilibrio ácido-base; fácil fabricación y bajo costo; que el proceso de esterilización no produzca productos tóxicos; y que mantenga la estabilidad durante el almacenamiento. Los nuevos líquidos para diálisis peritoneal contienen aminoácidos, icodextrinas o bicarbonato.
El líquido para DP con aminoácidos aporta un suplemento de aminoácidos; remplaza la pérdida de aminoácidos y proteínas; mejora el patrón plasmático de aminoácidos; mejora el balance nitrogenado; mejora el estado de nutrición; evita los efectos indeseables de la glucosa; y mejora la biocompatibilidad.
El líquido para DP con icodextrina se caracteriza por: contiene un polímero de la glucosa; es isoosmolar con el plasma; pH de 5,2 a 5,6; perfil de UF mayor o igual el de la glucosa al 3,86 %; es ideal para períodos largos de permanencia; muy útil en altos transportadores y en peritonitis; y reduce las anomalías lipídicas del uso de glucosa.
El líquido para DP con bicarbonato: no produce dolor a la infusión; tiene pH más fisiológico; disminuye la producción de PDGs y AGEPs; no tiene efectos nocivos sobre el mesotelio peritoneal y leucocitos; viene en bolsas con doble compartimiento. Se ha dicho que “una combinación acertada de estas tres soluciones, (diálisis a la carta), pudiera prevenir el síndrome MIA (malnutrición, inflamación, arterioesclerosis) y, merced a su biocompatibilidad, alargar el tiempo de funcionamiento adecuado de la membrana peritoneal”.
Resumen
Los desafíos para el futuro son: desarrollar nuevas técnicas (DPA, DPFC) y nuevos líquidos de diálisis; aumentar su capacidad para ofrecer una diálisis adecuada; (eliminación de solutos y de agua); evitar el daño provocado en la membrana; mejorar el estado de nutrición; y aumentar la supervivencia de los pacientes.Con respecto a la adecuación, es importante recordar las palabras de Ronco, quien señaló que “más que KT sobre V (Kt/V), lo mejor es MD sobre P (MD/P), médico sobre paciente: el médico evaluando al paciente en forma diaria y acuciosa”.

