Cursos
← vista completaPublicado el 1 de octubre de 2007 | http://doi.org/10.5867/medwave.2007.09.3604
Anatomía y fisiología de la membrana peritoneal
Anatomy and physiology of the peritoneal membrane
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
Anatomía de la membrana peritoneal
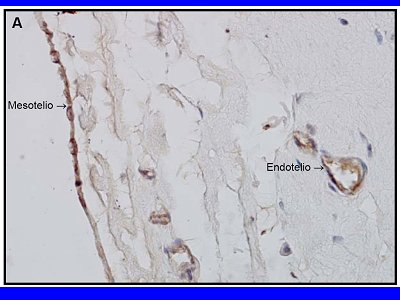
La membrana peritoneal es una membrana serosa cuya área es similar a la superficie corporal, entre 1 a 2 metros cuadrados y también es similar a la superficie que tienen los filtros de hemodiálisis, con la diferencia de que la membrana peritoneal tiene irrigación propia. 80% del peritoneo es peritoneo visceral, su circulación proviene de las arterias mesentéricas y su flujo de salida se dirige principalmente hacia la vena porta; la menor parte es peritoneo parietal, cuya irrigación proviene en su mayor parte por arterias y venas de la pared abdominal. Por otra parte, a diferencia de lo que ocurre en hemodiálisis, hay un drenaje linfático continuo por vía transdiafragmática, que roba fluido de manera constante.La membrana peritoneal difiere mucho de las membranas de hemodiálisis: consta de una monocapa de células mesoteliales productoras de fluido lubricante y bajo esta capa hay una esponja de tejido conjuntivo laxo, muy rica en vasos sanguíneos y linfáticos. La Fig. 1 corresponde a una tinción de peritoneo obtenido de un paciente en el momento en que se instala un catéter de peritoneodiálisis; se observa la delgada capa de células mesoteliales y la gran esponja, en la cual se distinguen con facilidad los vasos sanguíneos.
 Tamaño completo
Tamaño completo Figura 1. Peritoneo durante instalación de catéter de peritoneodiálisis
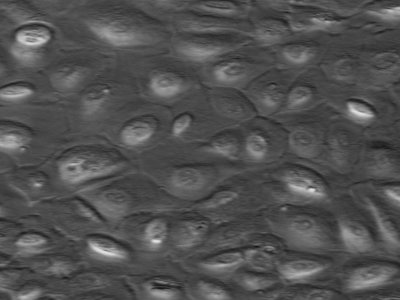
La Fig. 2 es una microfotografía electrónica de mesotelio peritoneal humano, que en cultivo tiene el aspecto de un verdadero mosaico de células.
 Tamaño completo
Tamaño completo Figura 2. Células mesoteliales de peritoneo humano
El conocimiento de las células mesoteliales ha ido cambiando en los diez últimos años; inicialmente se las consideraba sólo como un grupo de células por las que transcurrían fluidos y solutos desde un lado hacia otro, pero luego se descubrió que ejercen gran cantidad de funciones: como toda célula constituyente de serosa, pueden producir surfactante; poseen canales de acuaforina I inducibles, en la medida en que se exponen a concentraciones mayores de glucosa; producen citoquinas proinflamatorias y factores de crecimiento (TGF , MGF, VEGF, FGF, PGF), que pueden participar en respuestas inflamatorias y fibróticas a mediano y largo plazo; expresan in vitro todos los componentes del sistema renina-angiotensina, hecho que se descubrió recientemente; finalmente, un aspecto muy importante es que se pueden transformar en fibroblastos, migrar hacia el interior del tejido conectivo subyacente y promover fenómenos de fibrosis.
Anatomía peritoneal: "las resistencias"
Debido al gran tamaño de la membrana peritoneal, en términos de componentes y distancias, un soluto debe superar varios puntos de resistencia a medida que migra desde los capilares hacia el espacio peritoneal. Entre estas resistencias, el endotelio vascular, el intersticio y el fluido peritoneal son las más importantes.El modelo de tres poros, que explica el transporte peritoneal, se basa en la que probablemente es la diferencia más importante entre la membrana peritoneal y la membrana de hemodiálisis: que la primera es heteroporosa, mientras que la dimensión de los poros de la membrana de hemodiálisis es uniforme. En la membrana peritoneal hay tres tipos de poros: grandes (100-200 A), que corresponden a uniones endoteliales, son escasos y transportan macromoléculas, probablemente albúmina y proteínas; pequeños (40-60 A), que son numerosos y transportan solutos pequeños, como creatinina, urea, potasio y agua; y poros ultrapequeños (4-6 A), que no tienen estructura visible, corresponden a proteínas intracelulares que se denominan acuaforinas, transportan el mayor volumen que se retira en diálisis peritoneal y sólo transportan agua.
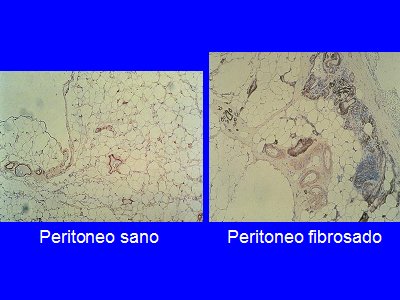
En la Fig. 3 se muestra un corte histológico de peritoneo sano, en el que se ve la capa de células mesoteliales y la abundancia de vasos sanguíneos; si se compara con un peritoneo fibrosado, destaca la hipervascularización de la membrana.
 Tamaño completo
Tamaño completo Figura 3. Comparación peritoneo sano y fibrosado
En la hemodiálisis, la distancia entre el flujo sanguíneo y el flujo dializado es relativamente constante y depende principalmente del espesor de la membrana; en cambio, en la membrana peritoneal los capilares se ubican a distintas distancias de la superficie mesotelial y la participación de cada uno de ellos es diferente, según la distancia que los separa del mesotelio. La vascularización peritoneal es más importante que la superficie anatómica: sin ella no podría haber transporte; para que una membrana peritoneal trabaje en forma eficaz son indispensables tanto la superficie como la vascularización, lo que da origen al concepto de superficie peritoneal efectiva, que corresponde a la superficie que está vascularizada y que participa en los intercambios de soluto.
El flujo sanguíneo peritoneal es relativamente bajo, si se compara con los flujos que se utilizan en hemodiálisis: 50 a 100 ml/min, pero permite obtener un clearance de urea de 20 a 30 ml/min, aunque la presión arterial sistólica llegue a ser tan baja como 70 mmHg, lo que sería prácticamente imposible con la hemodiálisis convencional. Hay evidencias de que la inflamación y algunas drogas aumentan el clearance, por aumento de la superficie peritoneal efectiva. Los capilares que más participan en los intercambios con el líquido peritoneal son, probablemente, los que están cerca de la membrana peritoneal, especialmente los de la superficie mesotelial.
Transporte peritoneal
El transporte peritoneal se produce a través de tres procesos distintos: difusión, ultrafiltración y reabsorción. Los determinantes de la difusión son la gradiente de concentración entre plasma y líquido de diálisis y el coeficiente de transferencia, que se relaciona con la superficie peritoneal efectiva y con las características difusivas de la membrana para ese soluto. En la Fig. 4 se grafica el tiempo versus la concentración dializado/plasma (D/P), es decir, el grado de saturación del líquido de diálisis a lo largo del tiempo, con distintos solutos (urea, creatinina). La mayor parte de la saturación, en el caso de urea y creatinina, ocurre en los primeros 120 minutos, llegando a 65%-70%, según el tipo de transporte para urea, cifra que sube a 80%-90% para urea a las 6 horas de un recambio. Si se retira el recambio y se inicia otro, se producirían dos curvas de este tipo en el mismo tiempo: es lo que ocurre en la diálisis peritoneal automatizada, que permite mantener la máxima gradiente de concentración, la mayor parte del tiempo posible.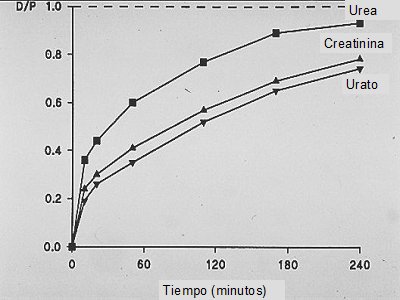 Tamaño completo
Tamaño completo Figura 4. Diálisis peritoneal
La difusión es mayor en las primeras 2 horas y después disminuye. La herramienta que se utiliza para medir la saturación es la creatinina, a través del test de equilibrio peritoneal o PET. Habitualmente se mide como D/P, que es la saturación del líquido de diálisis con un determinado soluto. Los cuatro carriles característicos de los tests de ultrafiltración (PET) tienen que ver con la elevación de la creatinina a lo largo de la zona del líquido peritoneal y reflejan los carriles clásicos, es decir, los transportadores altos, los transportadores promedio altos, los transportadores promedio bajos y los transportadores bajos. Hay un rango bastante amplio, lo que permite diferenciar los cuatro grupos con cierta seguridad, mientras que en el caso de la urea la distancia que separa los carriles máximos y mínimos es muy pequeña, por lo que es más fácil y seguro utilizar la creatinina (Fig. 5).
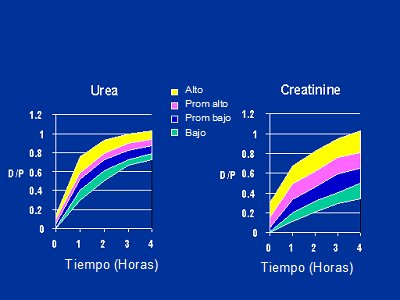 Tamaño completo
Tamaño completo Figura 5. Test de equilibrio peritoneal de creatinina y urea (prom.: promedio)
La difusión se puede aumentar manteniendo el mayor gradiente de concentración posible, lo que se logra usando recambios más rápidos; o bien, aumentando la superficie útil mediante volúmenes de infusión mayores. Por ejemplo, si se aumenta el volumen de la solución de 2 litros a 2,5 litros, el clearance se incrementa entre 18% y 23%.
La remoción de solutos en la diálisis peritoneal depende de la saturación de cada litro drenado, es decir, D/P de urea o de creatinina, y de la cantidad de volumen drenado por día o por semana. La D/P x litros drenados da cuenta de los litros efectivos, esto es, los litros que efectivamente contienen el soluto que se está midiendo como clearance. En diálisis peritoneal, el cálculo las adecuaciones se hace de acuerdo con lo que va hacia el exterior; en cambio, en hemodiálisis se calcula como un descenso porcentual del nitrógeno ureico, antes y después de la diálisis. En hemodiálisis se mira desde el lado de la sangre, mientras que en la diálisis peritoneal se mira desde el punto de vista de la sangre y del líquido peritoneal; sin embargo, en diálisis peritoneal se puede importar este concepto y medir los litros de urea que salen por el desagüe en hemodiálisis, para calcular el Kt/V.
Un aspecto que hay que tener claro es que los D/P y los litros drenados se mueven en direcciones opuestas y dependen de las características de cada peritoneo en un momento dado. Lo anterior quiere decir que cuanto mejor sea la saturación de un paciente, en términos de D/P, tanto mejor será la eliminación de solutos, pero, en general será tanto peor, dado que son pacientes transportadores altos que usualmente tienen problemas con la eliminación de volúmenes; de manera tal que, por un lado, se está saturando muy bien, pero, por otro, hay dificultad en la remoción de volúmenes. Cabe recordar que la remoción de solutos en diálisis peritoneal, igual que en hemodiálisis, equivale a la suma de los clearance convectivos y difusivos del soluto considerado. En diálisis peritoneal, el clearance difusivo es mucho más importante que el clearance convectivo, por las condiciones físicas de la membrana.
La ultrafiltración depende de varios factores: gradiente osmótico de glucosa; perfil de desaparición de la glucosa; superficie peritoneal útil; juego de presiones hidrostáticas y oncóticas capilares versus peritoneales, y las características propias de la membrana.
La reabsorción peritoneal de fluidos, fenómeno que no ocurre en la hemodiálisis, es muy típico de la diálisis peritoneal y suele ser bastante alta: se estima entre 60 y 120 ml/hora. No se sabe aún cómo se puede modificar la reabsorción; algunos trabajos han demostrado alguna variación con la administración de lecitina, pero son estudios aislados, con pocos pacientes y no están bien validados. En la práctica no hay manera de cambiar el flujo linfático; en un recambio de 6 horas, esta reabsorción significa una sustracción de ultrafiltrado de 360 a 720 cc, lo que constituye un inconveniente de la reabsorción linfática.
Dinámica de un baño de 4,25% en el peritoneo
Durante un baño de 4,25% en el peritoneo, la ultrafiltración comienza rápidamente, alcanza su nivel máximo a las 2-3 horas y después se va reduciendo, en la medida en que la concentración de glucosa se reduce por dilución y reabsorción y por la misma reabsorción linfática. Después de 8 a 10 horas, el volumen de I/P es igual o inferior al que se infundió, debido al cese de la ultrafiltración y absorción linfáticas; es decir, se podría recuperar menos de lo infundido en el momento cero, debido a estos hechos. Por lo tanto, en diálisis peritoneal el factor tiempo juega en contra de la glucosa y de la ultrafiltración y cuanto más tiempo se deja un recambio, más se va a saturar y menos ultrafiltración se va a lograr. Esto último resulta particularmente cierto en los pacientes llamados transportadores altos, porque su control de volumen es muy malo.El gráfico de la Fig. 6 ilustra las curvas de ultrafiltración neta de una solución al 1,25% y de una solución al 4,25%: las curvas corren por carriles distintos, pero en forma paralela. Se ve que una solución al 4,25% puede llegar a tener una ultrafiltración máxima, a las tres horas, cercana a 1.000 ml; en cambio, con una solución al 1,25% se logra 200 ó 250 ml, en el mejor de los casos. Con un baño al 1,25%, luego de 8 a 10 horas cesa la ultrafiltración, la que todavía se mantiene si se usan soluciones al 4,25%. Esto depende de las características específicas de transporte de cada membrana en particular, definidas por su PET.
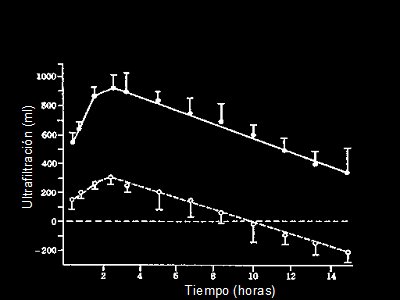 Tamaño completo
Tamaño completo Figura 6. Ultrafiltración neta, usando soluciones de dextrosa al 1,25 y 4,25%
Para aumentar la remoción de volumen de un paciente:
- Se puede maximizar el gradiente osmótico: aumentando la concentración de glucosa o bien, reduciendo el tiempo de permanencia del baño, como ocurre en la diálisis peritoneal automatizada (APD); es decir, por un lado se trabaja la parte rápida de la curva de la remoción y, por otro lado, en la ultrafiltración, sin necesidad de exponer el peritoneo a una concentración más alta de glucosa.
- La diálisis peritoneal muchas veces conserva la función renal residual, de tal manera que se puede sacar provecho de ésta y aumentar la diuresis residual con diuréticos.
- Se pueden utilizar soluciones que contengan un agente que no se absorba como la glucosa, como la icodextrina, polímero de glucosa de peso molecular 16.800 que tiene una gran diferencia con la glucosa en su dinámica intraperitoneal: no se absorbe por vía capilar, sino por vía linfática y su efecto no es osmolar, sino coloidoosmótico, de tal manera que la ultrafiltración de fluido depende del tiempo, lo cual no ocurre con la glucosa.
- Otra posibilidad sería reducir la absorción linfática, pero aún no se ha logrado.
El PET es una prueba que mide y clasifica las capacidades de transporte peritoneal; su principal utilidad es dirigir al paciente a diálisis peritoneal ambulatoria continua (CAPD) o APD. No es una prueba para medición de adecuación, sino que, básicamente, permite decidis cuál técnica conviene más a un paciente, en un momento determinado.
Es importante recordar que no es bueno tener a un paciente saturador o transportador alto en CAPD, porque en esos pacientes la ultrafiltración efectiva es baja, porque ese efecto anula la buena saturación y adecuación y porque no tiene control del volumen. En ese sentido, se parece a la diálisis corta de alta eficiencia, es decir, hay buena depuración y buena saturación, pero mala ultrafiltración.
Adecuación de la diálisis peritoneal
En los últimos años el concepto de adecuación de la diálisis peritoneal ha cambiado, a la luz de la información bibliográfica disponible Las últimas guías publicadas coinciden en que la meta de ultrafiltración ya no es un Kt/V de 2 ó 2,1, sino de 1,7, como mínimo. La adecuación en diálisis peritoneal tiene la misma filosofía que la que se hace en hemodiálisis, pero enfrentando los litros totales de urea con el volumen de agua total (Kt/V); para la creatinina, los litros producidos no se confrontan con el volumen, sino con la superficie corporal. En general, las nuevas guías prefieren el Kt/V para determinar la adecuación, en lugar de las mediciones de creatinina, que se reservan para casos muy específicos. Los litros totales de cada soluto corresponden a la suma de lo producido por peritoneo y la función renal residual, cuando la hay; de esta manera, la depuración total corresponde a los litros de urea y creatinina peritoneal más los litros de urea y creatinina renal.También se sabe que la presencia de función renal residual vale mucho más, desde el punto de vista de sobrevida y calidad de vida, que los litros de urea y de creatinina peritoneales, tanto en diálisis peritoneal como en hemodiálisis. Si hay una cosa que la diálisis peritoneal ha enseñado a la hemodiálisis es a respetar y cuantificar la función renal residual.
Los determinantes de la adecuación en diálisis peritoneal son:
- saturación de cada litro (D/P);
- volumen total drenado;
- función renal residual;
- volumen y superficie corporal del paciente.
La remoción de soluto se puede aumentar: maximizando el gradiente de concentración, por medio de intercambios más frecuentes, mayor volumen de recambio (+/-20%) y en APD, dejando recambio diurno; o bien, maximizando la ultrafiltración, mediante recambios más hipertónicos, recambios más frecuentes o mayor volumen de cada recambio, si la tolerancia lo permite.
Las estrategias para el manejo práctico de la ultrafiltración y difusión son: aumento del número de recambios; aumento del volumen de cada recambio; aumento de la osmolaridad de los baños, que funciona preferentemente para la ultrafiltración neta; baños diurnos en APD, en especial en los pacientes que tengan características de transporte bajo, para quienes representa una muy buena alternativa sin afectar la ultrafiltración; uso de la técnica tidal en APD, es decir, no permitir que se drene todo el baño anterior, sino dejar cierto remanente para que no haya tiempos muertos de pérdida de ultrafiltración, debido a que un baño ha salido y el otro no ha terminado de entrar; uso de icodextrina y preservación de la función renal residual.
Proteínas y sodio en diálisis peritoneal
Se sabe que duarnte la diálisis peritoneal, las proteínas pasan al líquido y que hay una pérdida diaria de 6 a 10 g/día y 2 a 4 g de aminoácidos; usualmente el hígado compensa esto, a diferencia de lo que ocurre en el síndrome nefrótico, en que la misma pérdida de proteínas se asocia a hipoalbuminemia e hipoproteinemia grave. En diálisis peritoneal esto no sucede, probablemente porque el hígado compensa esta pérdida, pero se debe considerar esto en la dieta. Este déficit es mayor en los transportadores altos. La absorción linfática previene una pérdida de albúmina mayor en la diálisis peritoneal. Cabe recalcar que las pérdidas en peritonitis pueden ser extremadamente altas, hasta 30 a 40 g/día.Con respecto al sodio, el gradiente de difusión es pobre inicialmente, de modo que difunde poco sodio por este mecanismo. Al pasar más agua que sodio, se diluye el sodio del dializado, aumenta el gradiente y pasa sodio por difusión. A las 4 horas se remueven cerca de 70 mEq de sodio con soluciones de glucosa al 4,25%, y 5 mEq, con soluciones al 1,5%. En la diálisis peritoneal CAPD se remueven normalmente 85 a 90 mEq de sodio.
La composición habitual de las soluciones de la diálisis peritoneal son las siguientes:
- sodio 135 mEq/l
- cloro 96 mEq/l
- calcio 3,5 mEq/l
- magnesio 0,5 mEq/l
- lactato 40 mEq/l
- pH 5,2
- glucosa 1360-2270-3860 mg/dl
- osmolalidad 345-395-484 mosm/kg.
Las concentraciones y osmolalidades son variables y dependen de la solución que se esté considerando. Hay que recalcar que se trata de una solución principalmente ácida, por el lactato, y que no tiene potasio. Uno de los grandes focos actuales de interés de la industria y de la biotecnología en diálisis peritoneal es ubicar una solución “amistosa” con el peritoneo en el largo plazo, para lo cual se ha planteado utilizar: bicarbonato en lugar de lactato; soluciones con aminoácidos; soluciones con icodextrina en lugar de glucosa; y soluciones libres de productos de degradación de glucosa. La tendencia actual es mejorar la biocompatibilidad de la solución, ya que, en diálisis peritoneal, la incompatibilidad está dada por la solución y no por la membrana, como en el caso de la hemodiálisis.
Manipulación del peritoneo con fármacos
El manejo del peritoneo con fármacos aún está en fase experimental; en un estudio en peritoneo canino se encontró que el área capilar aumenta con bloqueadores del sistema renina-angiotensina-aldosterona, específicamente con benazepril y cs866 (ARB), en dosis de 10 y 8 mg oral, respectivamente. En cambio, el amlodipino no causa cambios en dicho parámetro, aunque este fármaco podría aumentar la expresión de acuaforina I. En modelos humanos, unos pocos estudios han demostrado ciertos cambios en el transporte de glucosa y creatinina con el uso de captopril (1); y otros han demostrado que en pacientes diabéticos en CAPD disminuyen las proteínas peritoneales (2). Estudios en ratas han demostrado que la instilación I/P de verapamilo y diltiazem aumenta el clearance de urea, sin cambios en la pérdida proteica peritoneal (3).Un trabajo muy reciente demostró que en las células mesoteliales humanas se expresan, en condiciones normales, todos los elementos del sistema renina-angiotensina; que la producción de angiotensina II se incrementa en 20% cuando son expuestas a glucosa; asimismo, la angiotensina exógena aumenta la expresión de TGF-B y de fibronectina. Lo interesante es que losartán y captopril, en mesotelio peritoneal humano, inhiben la expresión de TGF-B y de fibronectina (4).
En un estudio experimental, en ratas expuestas por 4 semanas a diálisis peritoneal con glucosa hipertónica y enalapril 100 mg/l en agua, se encontró que se preservaba la ultrafiltración y se producía menor D/P de urea, menos inflamación y vascularización peritoneales y menos adherencias al peritoneo (5).
Conclusión
La comprensión de la fisiología peritoneal es una herramienta fundamental para el manejo de la diálisis peritoneal.Referencias
- Perit Dial Int 1992; 12: 287-291
- Nephron 1989; 51: 443
- Asaio Trans 1986; 32:564-566
- H Noh et al. Angiotensin II mediates high glucose-induced TGF-beta1 and fibronectin upregulation in HPMC through reactive oxygen species. Perit Dial Int 2005, 25: 38-47.
- Duman, AI et al. Does enalapril prevent peritoneal fibrosis induced by hypertonic (3,86%) peritoneal dialysis solution? Perit Dial Int 2001, 21: 219-224.

